Кадгерин
| Кадгерин-1; E-кадгерин | ||
|---|---|---|
| Свойства человеческого белка | ||
| Масса / длина первичной конструкции | 728 лет назад | |
| Вторичная к четвертичной структуре | Гомодимер | |
| Идентификатор | ||
| Имена генов | CDH1 ; Арка-1; CD324; CDHE; ECAD; LCAM; УВО | |
| Внешние идентификаторы | ||
| Вхождение | ||
| Родительский таксон | Эвтелеостомия | |
| Ортолог | ||
| человек | мышь | |
| Entrez | 999 | 12550 |
| Ансамбль | ENSG00000039068 | ENSMUSG00000000303 |
| UniProt | P12830 | Q4KML8 |
| Refseq (мРНК) | NM_004360 | NM_009864 |
| Refseq (белок) | NP_004351 | NP_033994 |
| Генный локус | Chr 16: 67.33 - 67.43 Мб | Chr 8: 109,49 - 109,56 Мб |
| PubMed поиск | 999 |
12550
|
Кадгерины (от английского кальция , прилипшие , как Ca-adherine ) являются трансмембранными гликопротеинами из группы , состоящие из адгезионных белков, которые зависят от ионов кальция (Ca 2+ ) . Они встречаются в десмосомах и сращениях и вызывают клеточные контакты в различных тканях. Кадгерины играют роль в стабилизации межклеточных контактов , эмбриональном морфогенезе , поддержании полярности клеток и передаче сигналов .
С помощью криоэлектронной томографии можно было продемонстрировать, что стабилизация происходит за счет нитевидных адгезионных белков, которые выступают из клеточных мембран и блокируются.
Структура и подразделение
Из суперсемейства кадгеринов в настоящее время известно более 300 белков только у позвоночных . На сегодняшний день у человека идентифицировано более 80 кадгеринов. Общими для всех кадгеринов являются несколько внеклеточных доменов кадгерина (ЭК). EC имеет длину около 100 аминокислот , эволюционно очень консервативен и имеет отрицательно заряженные мотивы последовательности, которые опосредуют кальций-зависимые гомофильные связи. Эти ЭК повторяются в тандеме от 5 до 34 раз по коротким линкерным последовательностям длиной примерно десять аминокислот, причем ЭК пронумерованы последовательно, начиная с N- конца. Основываясь на этом количестве ЭК, а также на цитоплазматическом домене и размере кадгерина, а также на кластерах генов , суперсемейство кадгеринов делится на семь групп:
| Подтип | Примеры |
|---|---|
| классический Кадгерин Тип I. | E- и N-кадгерины |
| классический кадгерин типа II | VE-Cadherine |
| десмосомальные кадгерины | Десмоколлин, Десмоглен |
| Протокадгерины | α-, β- и γ-протокадгерины |
| Кадгерин-подобные сигнальные белки | FAT, Daschous, Фламинго |
| Кадгерины протеинкиназы | k. А. |
| 7 трансмембранных кадгеринов | k. А. |
Наиболее важными и наиболее изученными представителями являются классические кадгерины, такие как E- и N-кадгерины, а также P (planzetare) и VE-кадгерины. Они также играют важную роль в развитии злокачественных новообразований. Параллельно они образуют цис-димеры в клетке. В этой конформации они способны образовывать транс-димеризацию с идентичным димером кадгерина в противоположной клетке и, таким образом, соединять внеклеточное пространство между двумя клетками. Классические кадгерины состоят из пяти внеклеточных доменов с сайтами связывания ионов кальция между отдельными доменами, которые имеют фундаментальное значение для адгезивной функции кадгеринов. Взаимодействие молекул кадгерина с противостоящими клетками (транс-взаимодействие) происходит через N-концевые домены клеток. Эти связи обычно специфичны для белка (гомофильны), то есть E-кадгерин в одной клетке может связываться только с E-кадгерином в другой клетке, но не, например, Б. N-кадгерин. Однако гетерофильные взаимодействия разных подтипов кадгерина также наблюдаются редко.
Неклассические кадгерины включают десмоколлин (в основном обнаруженный в коже в десмосомах), десмоглеин (в основном обнаруженный в коже в десмосомах), Т-кадгерин (в основном в нейронах и мышцах).
E-кадгерин
Е-кадгерин, один из классических кадгеринов, который встречается в основном в эпителии, является наиболее изученным кадгерином и рассматривается как молекула-прототип для всего подсемейства кадгеринов. Он имеет 5 ЭК во внеклеточном домене, трансмембранном домене и внутриклеточном домене, который связывает p120-катенин и β-катенин . Этот внутриклеточный домен имеет сильно фосфорилированную область, которая важна для связывания β-катенина (и, следовательно, для функции E-кадгерина).
Ген Е-кадгерина человека расположен на хромосоме 16q22.1, кодирующая область состоит из 2652 пар оснований.
Мутации в этом гене можно найти при синдроме Эльшнига .
N-кадгерин
N-кадгерин (кадгерин нейронов) соответствует по своей структуре классическому кадгерину и был выделен Грюнвальдом в 1982 году в виде молекулы 130 кДа из сетчатки курицы. Он играет важную роль в эмбриональном развитии, потому что N-кадгерин образуется в мезодерме и хорде на ранней эмбриональной стадии. С другой стороны, на поздней эмбриональной стадии он обнаруживается в нервной ткани, сердце, скелетных мышцах и хрусталике.
Во взрослом организме он образуется, среди прочего, в нервной ткани и сетчатке. N-кадгерин стимулирует миграцию и инвазию клеток через межклеточные контакты и вместе с высокоэкспрессированным E-кадгерином в небольших количествах подавляет образование рака.
VE кадгерин
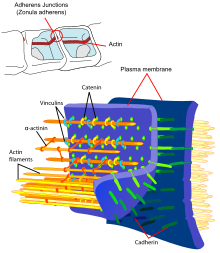
Эндотелиальный кадгерин сосудов (VE-кадгерин) - особый представитель классического кадгерина, который встречается в точках контакта соседних эндотелиальных клеток. В отличие от эпителиальных клеток, точки контакта эндотелиальных клеток не имеют десмосом. В эндотелиальных контактных точках VE-кадгерин выполняет функцию классических кадгеринов адгезивных контактных точек («адгезивных соединений»), а также десмосомальных кадгеринов. Цитоплазматический домен связывает, как и другие классические кадгерины, β-катенин, который, в свою очередь, регулирует актиновый цитоскелет через α-катенин.
В организме человека известно более 80 различных членов семейства кадгеринов. Из них более 30 кадгеринов были идентифицированы в развивающемся мозге человека. Каждый кадгерин имеет паттерн экспрессии, который специфичен и определяется областью синтеза и уровнем развития организма.
Протокадгерин GammaC3
По выражению гаммы -Protocadherin-A3- EGFP - слитый белка в культивируемой первичных гиппокампе нейронов колокализации наблюдались после контрастной с синаптическими маркерами синаптофизином. Кроме того, Нозерн-блоттинг общей РНК из различных тканей взрослых мышей показал самую высокую экспрессию (приблизительно 4,8 т.п.н.) в центральной нервной системе. Однако более низкий уровень экспрессии также может наблюдаться в легких, а после длительного воздействия также в сердце и почках. В отличие от других изоформ гамма- протокадгеринов, которые в основном экспрессируются во время эмбриогенеза, изоформа C5 гамма- протокадгерина демонстрирует повышенную постнатальную экспрессию в головном мозге, что совпадает с пиком синаптогенеза. Кроме того, может быть показана сильная экспрессия в обонятельной луковице , полосатом теле , зубчатой извилине , области СА1 гиппокампа, слоях I и II коры головного мозга и молекулярном слое мозжечка. Кроме того, сильная экспрессия изоформы была обнаружена в клубочках обонятельной луковицы.
Было продемонстрировано гомофильное взаимодействие между двумя идентичными изоформами гамма- протокадгерина, которые трансгенно экспрессировались в клетках лейкемии K562, свободных от кадгерина. В то же время можно было показать, что, в отличие от N-кадгеринов, это взаимодействие происходит независимо от кальция. Клонирование химерных гамма- протокадгеринов также подтвердило зависимость гомофильного взаимодействия от доменов 2 и 3 поверхностных белков , что является дополнительным отличием от N-кадгеринов, чье гомофильное взаимодействие опосредуется через домен 1. В дополнение к количественному анализу клеточной агрегации высокоспецифичное гомофильное взаимодействие также было проиллюстрировано качественным конфокальным микроскопическим анализом после смешивания красных и зеленых меченных изоформ экспрессирующих клеток.
В дополнение к этому транс-взаимодействию было продемонстрировано очень беспорядочное или неспецифическое образование тетрамеров из широкого разнообразия изоформ. На следующем этапе можно также продемонстрировать, что беспорядочное образование тетрамеров на клеточной мембране связано с высокоспецифическим транс-взаимодействием между клетками, которые имеют такое же образование тетрамеров в своей мембране. Формирование взаимодействия между этими клетками также постепенно снижается с увеличением неравенства образующихся тетрамеров . Подводя итог, можно сказать, что дифференциальная экспрессия 22 изоформ 224 (234,256) дает начало различным возможностям образования тетрамера. Если состав этих тетрамеров идентичен, опосредуется высокоспецифичное клеточно-клеточное распознавание. Обнаружение внутриклеточного цис-мультимерного образования изоформ гамма- протокадгерина с таковыми из альфа- протокадгеринов также увеличивает количество возможных специфических межклеточных взаимодействий.
Передача сигнала
Кадгерин-опосредованная адгезия клеток - это динамический процесс. Этот процесс зависит от топологии и стадии дифференцировки клетки, но также влияет на них. Это означает, что кадгерины являются не только молекулами адгезии, но и важными сигнальными молекулами. Передача внеклеточных сигналов в клетку осуществляется цитоплазматическим кадгериновым доменом.
Катенины
Катенины - это цитоплазматические белки, для которых впервые была описана ассоциация с классическими кадгеринами. Семейство катенинов включает α- и β-катенин, γ-катенин (плакоглобин) и δ-катенин (p120-катенин). Во внутриклеточном пространстве катенины образуют регуляторную точку переключения между трансмембранными кадгеринами и актиновыми филаментами цитоскелета. Наиболее важным катенином в развитии рака является β-катенин, который также играет центральную роль в сигнальном пути WNT. β-катенин связывается с цитоплазматическим доменом классических кадгеринов, а также с α-катенином, важным регулятором актинового цитоскелета. γ-катенин идентичен плакоглобину, белку, который был впервые выделен из десмосом. Подобно β-катенину, γ-катенин также связывается как с цитоплазматическим доменом кадгерина, так и с α-катенином. Другой белок, связанный с цитоплазматическим доменом классических кадгеринов, - это p120-катенин. p120-катенин модулирует действие кадгеринов, регулируя оборот кадгерина на поверхности клетки и, влияя на RhoA, Rac и Cdc42, также на динамику цитоскелета.
Кадгерины и прогрессирование карциномы
E-кадгерин играет важную роль в прогрессировании злокачественных опухолей, поскольку он является основным эпителиальным кадгерином. Е-кадгерин является продуктом гена CDH1 . В ходе эмбрионального развития CDH1 экспрессируется уже на стадии бластомера. Этот генный продукт участвует в уплотнении бластомеров. В дальнейшем E-кадгерин обнаруживается во всех эпителиях, независимо от того, происходят ли они из экто-, мезо- или энтодермы. В большинстве карцином человека потеря E-кадгерина происходит из-за снижения транскрипции гена CDH1 из-за метилирования промотора или изменения регуляции транскрипционными факторами. В некоторых типах опухолей E-кадгерин также инактивируется мутацией последовательности гена CDH1 . В основном это рак желудка и груди. Инактивирующие мутации CDH1 обнаруживаются в основном в опухолях, в которых опухолевые клетки распространяются диффузно и в значительной степени индивидуально. Как и в случае с другими генами-супрессорами опухолей, большинство мутаций CDH1 приводят к преждевременному обрыву цепи или потере более крупных белковых сегментов . Большинство мутаций приводят к обрыву цепи и секреции фрагментов E-кадгерина. Это объясняет, почему Е-кадгерин больше не может быть обнаружен в опухоли. Недостаток E-кадгеринов из-за канцерогенной мутации приводит к неэффективному связыванию между опухолевыми клетками, в результате чего клетки карциномы отделяются и могут переноситься кровотоком или лимфатическим дренажом в далекие и отдаленные области тела, где они могут развиваться. метастазы. Как показывают эксперименты на мышах, у которых этот ген был выключен, отсутствие E-кадгерина несовместимо с жизнью. Эмбриональное развитие заканчивается до стадии бластоцисты. Мыши с дефицитом N-кадгерина умирают на эмбриональной стадии на 9 или 10 день, поскольку происходит дифференциация отдельных тканей, таких как, например, Б. сердца не проходит.
Индивидуальные доказательства
- ↑ а б в г д Б. М. Гумбинер: Клеточная адгезия: регулирование адгезии, опосредованной кадгерином, в морфогенезе. В: Nat Rev Mol Cell Biol . 2005 г.
- ↑ F. Nollet et al.: Филогенетический анализ суперсемейства кадгеринов позволяет идентифицировать шесть основных подсемейств, помимо нескольких отдельных членов. 2000 г.
- ↑ M. Takeichi: Рецепторы адгезии кадгериновых клеток как регулятор морфогенеза. 1990 г.
- ↑ K. Hatta et al.: Пространственный и временной паттерн экспрессии молекул адгезии клеток N-кадгерина коррелировал с морфогенетическими процессами куриных эмбрионов. 1987 г.
- ↑ М. Такеичи: Кадгерины: молекулы межклеточной адгезии, контролирующие морфогенез животных. 1988 г.
- ↑ Дерик, Брак, 2004.
- ↑ a b B. D. Angst et al.: Суперсемейство кадгеринов: разнообразие форм и функций; Журнал клеточной науки. 2001 г.
- ^ A b М. Дж. Уилок, К. Р. Джонсон: кадгерины как модуляторы клеточного фенотипа. В: Ежегодный обзор клеточной биологии и биологии развития. 2003 г.
- ↑ Обст-Пернберг К., Редис К. Кадгерины и синаптическая специфичность. В: Журнал исследований нейробиологии. 1999 г.
- ↑ М. Франк, М. Эберт, В. Шань, Р. Филлипс, К. Арндт, ДР Колманы, Р. Kemlera: Дифференциальная экспрессия отдельных гамма - протокадгерины во время развития мозга мыши. В кн . : Мол. Neurosci. 29, 2005, стр. 603-616.
- ↑ Y. Li, DR Serwanski, CP Miralles, CG Fiondella, JJ Loturco, ME Rubio, AL De Blas: Синаптическая и несинаптическая локализация Protocadherin- гамма C5 в мозге крысы. В: Журнал сравнительной неврологии. 518, 2010, стр. 3439-3463.
- ↑ Д. Шрайнер, JA Веинер: Комбинаторное гомофильное взаимодействие между гамма протокадгерином мультимерами значительно расширяет молекулярное разнообразие клеточной адгезии. В: Proc Natl Acad Sci USA . 107, 2010, стр. 14893-14898.
- ^ С. Бонн, PH Seeburg, MK Schwarz: Комбинаторная экспрессия альфа- и гамма-протокадгеринов изменяет их пресенилин-зависимую обработку. В: Mol Cell Biol. 27 (11), июнь 2007 г., стр. 4121-4132. Epub 2007 2 апреля.
- ↑ a b M. Conacci-Sorrel et al: Система адгезии кадгерин-катенин в передаче сигналов и раке. В: Журнал клинических исследований. 2002 г.
- ^ WJ Nelson, R. Nusse: Конвергенция путей Wnt, {бета} -катенина и кадгерина. В кн . : Наука. 2004 г.
- ↑ AR Brooks-Wilson et al.: Мутации E-кадгерина зародышевой линии при наследственном диффузном раке желудка: оценка 42 новых семей и обзор критериев генетического скрининга. В: Британский медицинский журнал. 2004 г.
- ↑ К. Редис: Кадгерины в центральной нервной системе; Успехи нейробиологии. 2000 г.