Флуоресцентная микроскопия

Флуоресцентная микроскопия - это особый вид световой микроскопии . Он основан на физическом эффекте флуоресценции . Если флуоресцентные вещества возбуждаются светом определенных длин волн , они излучают свет других, более длинных волн ( стоксов сдвиг ).
При флуоресцентной микроскопии увеличенное изображение исследуемого объекта создается только за счет излучаемого (испускаемого) света. Цветные фильтры предотвращают попадание возбуждающего света на изображение. Флуоресцентные микроскопические изображения информативны, если весь микроскопический образец флуоресцирует неравномерно, а освещаются только некоторые структуры. Эти структуры генерируют световые сигналы на темном фоне.
Каждую флуоресцентную молекулу в препарате можно рассматривать как новый источник света. Если интенсивность флуоресценции, испускаемой этими молекулами, превышает предел обнаружения, структуры, которые намного меньше предела разрешения микроскопа, также могут быть обнаружены с помощью флуоресцентной микроскопии. Предел разрешающей способности не преодолевается с помощью классической флуоресцентной микроскопии, поскольку обнаружение возможно на небольшом расстоянии, но не указывается, вызван ли сигнал одной или несколькими структурами. В этом отношении он похож на микроскопию темного поля .
Помимо классической, существует множество усовершенствованных специальных форм флуоресцентной микроскопии. К ним относятся, например, конфокальная лазерная сканирующая микроскопия и многофотонная флуоресцентная микроскопия . Начиная с 1990-х годов, были разработаны различные методы, которые фактически позволяют значительно улучшить разрешение. Эти так называемые методы сверхвысокого разрешения или сверхвысокого разрешения также относятся к типу флуоресцентной микроскопии.
Основы
флуоресценция


Флуоресцентный молекула имеет электрон , который может изменяться от низкой энергии состояния (S 0 ) , чтобы более энергично, возбужденное состояние (S 1 ) путем поглощения в фотон . И S 0, и S 1 имеют несколько подсостояний, которые различаются содержанием энергии колебаний (также: энергии колебаний) электрона. Разность энергий между начальным колебательным состоянием в пределах S 0 и состоянием колебания, достигнутым в S 1, точно соответствует содержанию энергии поглощенного фотона.
Если электрон возвращается в основное состояние, излучается фотон. Это световое излучение происходит через несколько наносекунд после поглощения - это флуоресценция. Для того, чтобы это произошло, должна быть четкая разница в содержании энергии между S 0 и S 1, и не должно быть дополнительных уровней энергии между ними, поскольку возбужденные электроны в противном случае возвращаются в основное состояние посредством неизлучающих процессов.
Поскольку как основное состояние S 0, так и возбужденное состояние S 1 имеют несколько подсостояний, могут поглощаться или испускаться не только фотоны с точно определенным содержанием энергии, но также фотоны с аналогичным содержанием энергии. Поскольку содержание энергии фотона обратно пропорционально его длине волны , это означает, что флуоресцентное вещество возбуждается несколькими одинаковыми длинами волн: это называется спектром возбуждения . Он также излучает некоторые похожие длины волн, спектр излучения .
Флуоресценция излучается с нижнего возбужденного энергетического уровня ( правило Каша ). Если электрон переводится в более высокое возбужденное состояние за счет поглощения возбуждающего фотона, он сначала достигает самого низкого возбужденного энергетического уровня посредством неизлучающего излучения энергии до того, как испускается фотон. Это имеет несколько важных последствий для флуоресцентной микроскопии:
|
Вещества, которые флуоресцируют, называются флуорофорами. Флуорофоры, которые используются для окрашивания препаратов, называются флуоресцентными красителями или флуорохромами.
Автофлуоресценция и флуорохромы

Когда образец флуоресцирует сам по себе, это называется аутофлуоресценцией, аутофлуоресценцией или первичной флуоресценцией. Многие растения имеют очень сильную автофлуоресценцию в различных частях, например семенные растения в деревянных частях их стебля . Хлорофилл в хлоропластах зеленых растительных клеток сильно флуоресцентный красном цвете. Для сравнения, клетки животных флуоресцируют очень слабо, но все же достаточно сильно, чтобы при определенных обстоятельствах маскировать флуоресцентные метки. Основными источниками здесь являются флавины , содержащиеся в митохондриях, и липофусцин, содержащиеся в лизосомах . Кофермент NADPH также показывает аутофлюоресценцию.
Искусственно созданная флуоресценция в препарате с флуорохромами является вторичной флуоресценцией. Процесс, который приводит к этому, называется флуоресцентным маркированием . Хорошие флуорохромы сочетают в себе несколько свойств: (1) они имеют высокую вероятность поглощения фотона, то есть имеют высокий коэффициент поглощения . (2) Большинство поглощенных фотонов фактически приводят к испусканию фотона флуоресценции (высокая квантовая эффективность ). Оба вместе обеспечивают высокий уровень яркости. (3) Флуорохромы не должны обесцвечиваться , что означает, что их можно часто возбуждать без разрушения. (4) Кроме того, флуорохромы должны флуоресцировать в как можно более узком диапазоне светового спектра, чтобы можно было одновременно использовать как можно больше флуорохромов с разными флуоресцентными цветами для окрашивания различных структур.
Цветовые каналы
Если спектры возбуждения и излучения двух флуорохромов сильно перекрываются, то их невозможно отличить друг от друга. Например, флуоресцеин , зеленый флуоресцентный белок , спектр зеленого и ряд других коммерчески доступных красителей имеют очень похожие спектры, поэтому их нельзя различить по цвету флуоресценции. Если разные флуоресцентные красители должны использоваться бок о бок для окрашивания разных структур, эти красители должны иметь разные спектры. Обычно ультрафиолетовый свет возбуждает синие флуоресцентные флуорохромы, синий свет возбуждает зеленые флуорохромы, а зеленый свет возбуждает красные флуорохромы. Таким образом, эти три цветовых канала можно использовать для представления различных структур в одном и том же образце.
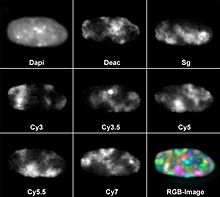
Однако это не исчерпывает количество цветов, которые могут быть обнаружены одновременно. Параллельно уже использовались восемь различных флуорохромов. С этой целью DAPI использовался в качестве синего флуоресцентного контрастного красителя для ДНК, а также семь других красителей, которые были связаны с генными зондами для флуоресцентной гибридизации in situ : диэтиламинокумарин (Deac), Spectrum Green и цианиновые красители Cy3, Cy3.5, Cy5. , Cy5 .5 и Cy7. Большинство флуоресцентных микроскопов имеют от трех до пяти цветовых каналов.
Устройство флуоресцентных микроскопов
При «нормальной» световой микроскопии, микроскопии в светлом поле в проходящем свете изображение создается светом, который проходит через образец. С флуоресцентной микроскопией дело обстоит иначе. Здесь изображение создается флуоресцентным светом, который создается только в образце. С другой стороны, возбуждающий свет, излучаемый образцом, исключается из формирования изображения специальными фильтрами. Поскольку при нормальных условиях флуоресцентный свет распространяется равномерно во всех пространственных направлениях, не имеет значения, исходит ли возбуждающий свет сверху, снизу или сбоку. Фактически были реализованы все три варианта.
В начале флуоресцентной микроскопии, в первой половине 20 века, были построены флуоресцентные микроскопы проходящего света . Сегодня они представляют только исторический интерес (см. Раздел истории ниже). Наличие дихроичных зеркал (также: дихроичных светоделителей) позволило примерно с 1970 года создавать флуоресцентные микроскопы падающего света, в которых возбуждающий свет излучается в образец через объектив. Их также называют эпифлуоресцентными микроскопами от греческого ἐπί, что означает «на». Этот тип зданий использовался почти исключительно с конца 20 века. Боковое освещение используется со специализированным флуоресцентным микроскопом, световым дисковым микроскопом (см. Ниже).
Эпифлуоресцентный микроскоп: типичный флуоресцентный микроскоп
По сравнению с светлопольными микроскопами в проходящем свете, эпифлуоресцентные микроскопы имеют дополнительную ось освещения падающим светом для света возбуждения флуоресценции. Наблюдаемый объект освещается через линзу. Следующая нумерация относится к схематическому чертежу.
- Подходящим образом подобранный оптический фильтр , фильтр возбуждения , позволяет используемой лампе пропускать только ту часть генерируемого света, которая содержит длины волн, необходимые для возбуждения флуоресцентного красителя. Область спектра, в которой светит флуоресцентный краситель, не должна проходить мимо фильтра возбуждения .
- Расщепитель луча отражает свет возбуждения к цели, после чего флуоресценция возникает в образце. Объектив также выполняет функцию конденсатора . Флуоресценция имеет более длинную волну, чем свет возбуждения.
- Часть флуоресцентного света, собираемая объективом, достигает светоделителя. Благодаря своим особым свойствам, этот длинноволновый свет проходит в окуляр или детектор (а не отражается). С другой стороны, возбуждающий свет, который отражается от образца, в основном направляется обратно в лампу.
- Поскольку светоделители не работают идеально, небольшая часть возбуждающего света, отраженного от образца, все равно достигает окуляра или детектора. Поскольку интенсивность флуоресценции очень мала по сравнению с возбуждением, требуется другой оптический фильтр, называемый блокирующим фильтром или фильтром излучения , для устранения этого оставшегося возбуждающего света.
Три упомянутых фильтра часто встраиваются в общий блок современных флуоресцентных микроскопов. В вертикальных микроскопах он расположен по оптической оси над объективом. В случае инвертированных флуоресцентных микроскопов он соответственно располагается под объективом. В устройствах с бесконечной оптикой он находится в бесконечном пространстве между объективом и линзой трубки.
Источники света
Генерация флуоресценции в образце не является эффективным процессом: флуоресцентными красителями поглощается только часть возбуждающего света. Поэтому для того, чтобы по-прежнему иметь возможность генерировать яркие сигналы, видимые глазом, требуется очень высокая сила света.
Люминесцентные микроскопы обычно оснащены ртутными лампами , металлогалогенными лампами , ксеноновыми газоразрядными лампами или, начиная с 21 века, светодиодными лампами. Большинство источников света излучают во всем видимом спектре, а также в ультрафиолетовом диапазоне. Длины волн, необходимые для исследования конкретного флуорохрома, выбираются соответствующим фильтром, а все остальные подавляются.
фильтр
Если раньше использовались цветные фильтры из цветного стекла, то сегодня часто используются интерференционные фильтры . Однако интерференционные фильтры значительно дороже, поэтому по-прежнему используется цветное стекло. Оба типа могут использоваться для фильтров возбуждения и излучения. Дихроичный светоделитель может быть изготовлен только в качестве интерференционного фильтра.
Интерференционные фильтры состоят из оконного стекла, на которое нанесено несколько тонких слоев материала. Между слоями возникает интерференция , так что одни длины волн могут проходить, но другие отражаются. В отличие от цветного стекла, свет не поглощается. Выбирая подходящие материалы и толщину слоя, можно изготавливать фильтры для разных длин волн. Свет, который попадает на интерференционный фильтр под разными углами, покрывает расстояния разной длины в соответствующих слоях. Следовательно, свойства фильтра меняются в зависимости от угла падения света. Поэтому для правильной работы в микроскопе необходимо установить интерференционный фильтр под заданным углом.
Различают короткие, длинные и полосовые фильтры с точки зрения их функциональности. Короткочастотные фильтры пропускают свет до определенной длины волны. KP480 будет пропускать свет до 480 нм и блокировать свет с более длинными волнами. Напротив, фильтры с длинной полосой пропускания пропускают свет с определенной длиной волны, LP520, то есть свет с длиной волны более 520 нм. Полосовые фильтры пропускают только определенный участок спектра. Полосовой фильтр с обозначением 525/50 позволяет пропускать спектральное окно размером 50 нм, центр которого находится на 525 нм, то есть окно 500–550 нм. Свойства фильтра обычно связаны только с видимым диапазоном. и непосредственно соседние спектральные диапазоны. Поэтому возможно, что, например, полосовой фильтр для видимого диапазона в инфракрасном диапазоне снова станет проницаемым. Это может привести к проблемам с возбуждением двухфотонной флуоресценции (см. Ниже).
Более сложные спектральные свойства также могут быть достигнуты с помощью интерференционных фильтров. Например, фильтр может пропускать несколько спектральных окон, но блокировать области между ними (многополосный). Также возможны дихроичные делители луча, которые отражают несколько спектральных областей и допускают области между ними (мульти-дихроичные). Это позволяет одновременно видеть несколько каналов флуоресценции. Некоторые источники света могут очень быстро переключаться между различными длинами волн возбуждения, например, некоторые светодиодные устройства. Используя мультидихроичный и многополосный фильтр в качестве эмиссионного фильтра, можно очень быстро поочередно использовать разные каналы флуоресценции, поскольку нет необходимости перемещать фильтры.
В эпифлуоресцентных микроскопах фильтры возбуждения, светоделители и эмиссионные фильтры обычно объединены в блоки фильтров. От одного канала к другому все три фильтра меняются вместе либо путем перемещения ползунка, который содержит комбинации для трех-четырех цветов, либо путем поворота колеса, на котором установлено несколько кубиков фильтров для каждого канала.
В некоторых лазерных сканирующих микроскопах, которые работают с флуоресценцией, функцию фильтров возбуждения или светоделителей заменяют акустооптические модуляторы (AOM, также: акустооптический перестраиваемый фильтр (AOTF) или акустооптический светоделитель (AOBS)). Эмиссионный фильтр можно заменить спектральным разделением флуоресцентного света, который в этих устройствах исходит только из одной точки, перед обнаружением, и тогда обнаруживаются только желаемые части спектра. Такое разделение достигается с помощью призмы или дифракционной решетки .
Детекторы
Препараты с яркой флуоресценцией в диапазоне, хорошо видимом человеческим глазом, вплоть до длины волны около 620 нм, можно наблюдать непосредственно через окуляр. Камеры используются для документации. В то время как фотопленка использовали ранее , произошел переход на электронные камеры в конце 20 - го века . Часто используются камеры CCD, которые делают черно-белые изображения . Поскольку в камере нет цветного фильтра, все пиксели могут записывать любой цвет, а изображение ярче, чем в случае с цветными камерами. Какой цвет фактически регистрируется камерой, определяется фильтром излучения на входе. Флуоресцентные красители разного цвета в препарате вводятся один за другим и могут накладываться друг на друга в компьютере. Соответствующим красителям может быть назначен любой цвет, необязательно их естественный цвет или другой, последний, например, для лучшего контраста цветов.
Сложность флуоресцентной микроскопии
Затухание флуоресценции

Флуоресцентные молекулы нельзя возбуждать так часто, как они хотят, потому что они могут быть разрушены возбуждающим светом. Процесс, известный как фотообесцвечивание, происходит быстрее или медленнее в зависимости от фотостабильности флуоресцентных препаратов. Тогда для одной флуоресцентной молекулы обесцвечивание более или менее вероятно.
Молекула в возбужденном состоянии не может вернуться в основное состояние (S 0 ) только за счет флуоресценции . Вторая возможность - это внутреннее преобразование , при котором энергия преобразуется в тепло при переходе в основное состояние. Третий - выцветание, при котором краситель разрушается в результате фотохимических реакций. Эти реакции связаны со спиновыми состояниями электронов.
Электроны флюорохрома , как правило , находятся в синглетном состоянии , в котором все электроны в молекуле спин - парные. Поэтому основное состояние также обозначается как S 0 , а «нормальное» возбужденное состояние - как S 1 (см. Рисунок с энергетической диаграммой). Как описано выше , S 0 и S 1 имеют несколько подсостояний, каждое из которых мало отличается по уровню энергии. Кроме того, существуют другие, еще более энергичные возбужденные состояния, уровень энергии которых значительно выше, чем S 1 . Они обозначаются как S 2 , S 3 и так далее. У них также есть несколько подсостояний. Фотон высокой энергии может переместить молекулу из основного состояния в одно из этих состояний. Затем в спектре поглощения появляется локальный максимум на длинах волн с соответствующим содержанием энергии (см. Иллюстрацию спектров). Однако спектр флуоресценции остается прежним, поскольку фотон флуоресценции всегда испускается из самого нижнего возбужденного состояния (см. Также выше).
Помимо синглетных состояний встречаются и триплетные состояния. Триплетное состояние с наименьшей энергией обозначается как T 1 (см. Энергетическую диаграмму), более энергичное - как T 2 , T 3 и так далее. Переход от синглетного к триплетному состоянию называется межсистемным кроссингом . Во время этого перехода спин электрона должен повернуться, так что тогда присутствует неспаренный набор электронных спинов. Вероятность этого обычно мала, но значительно увеличивается, когда молекула находится в одном из более высоких возбужденных состояний, то есть S 2 или выше. Чтобы минимизировать вероятность перехода в триплетные состояния, по возможности следует избегать возбуждения до S 2 или выше, потому что флуоресценция не может возникать из триплетных состояний, и эти состояния являются долгоживущими.
Из триплетного состояния электрон может либо отдать свою энергию в виде тепла, чтобы вернуться в основное состояние, либо испустить фотон. Этот фотон возникает в виде флуоресценции намного позже после возбуждения; это фосфоресценция .
Однако из триплетного состояния флуорохром также может быть разрушен, то есть обесцвечен . В отличие от возбужденных синглетных состояний, время пребывания в триплетном состоянии значительно больше, поэтому существует большая возможность химического взаимодействия с другими молекулами в окружающей среде. Если флуоресцентный краситель прореагировал химически, продукт реакции обычно не флуоресцирует, и краситель обесцвечивается. Реакция с молекулярным кислородом , O 2 , особенно важна , поскольку она имеет триплетное основное состояние, а реакции триплет-триплет очень эффективны.
Следовательно, отбеливание можно уменьшить, если удалить из препарата кислород. Этого можно добиться с помощью так называемых антибликовых веществ (англ. Anti-bleaching agent), которые обладают уменьшающим эффектом. Используются антиоксиданты , такие как пара-фениламиндиамин, DABCO или галлат . Однако полностью предотвратить обесцвечивание невозможно. Поэтому важно выбирать флуорохромы для флуоресцентной маркировки, которые являются как можно более фотостабильными.
Фототоксичность
Реакции, описанные в предыдущем разделе, также происходят при флуоресцентной микроскопии живых клеток или органов. Здесь не только происходит обесцвечивание, но и активные формы кислорода, которые возникают во время реакции с кислородом, могут повредить клеточные компоненты в последующей реакции и, таким образом, привести к гибели клетки. Здесь также может помочь добавление восстанавливающих веществ, таких как аскорбиновая кислота или тролокс .
Коротковолновый свет, особенно УФ-свет, также может напрямую повреждать клетки, не вызывая флуоресценции. Это создает проблему с источниками света с широким спектром и высоким содержанием УФ-излучения, например с ртутными лампами . Фильтры не могут полностью блокировать высокий УФ-компонент источника света. Поэтому использование источников света без УФ-излучения, таких как светодиоды, лазеры или галогенные лампы, является преимуществом для прямых наблюдений.
Обе проблемы уменьшаются, если выдерживать как можно более низкий уровень воздействия на соответствующий вопрос. Этому также могут способствовать особо чувствительные камеры или другие детекторы. Образование активных форм кислорода может быть уменьшено, если поиск области изображения (клеток) и фокусировка выполняются не с помощью флуоресценции, а с помощью светлого поля, фазового контраста , дифференциального интерференционного контраста или сопоставимых методов, и тем самым уменьшается флуоресцентное микроскопическое исследование. до минимума.
Помимо упомянутых фототоксических эффектов, чрезмерные концентрации веществ, используемых для флуоресцентной маркировки, могут привести к прямому отравлению клеток.
Перекрестные помехи сигналов в соседних цветовых каналах
Как bleedthrough (английский язык для просвечивания), или перекрестных помехи , то есть перекрестные помехи, то вызывается , когда сигнал можно также увидеть в соседнем цветовом канале в множественном выборе. Длинноволновый конец спектра излучения большинства флуорохромов очень медленно спадает до нуля. Следовательно, при одновременном возбуждении и обнаружении соседних флуорохромов в спектре часто возникают перекрестные помехи, например зеленый флуорохром в соседнем канале оранжевого цвета. Этого можно избежать или, по крайней мере, уменьшить, если используются узкополосные фильтры и / или красители возбуждаются не одновременно, а один за другим.
Подготовка препаратов и приложений в науках о жизни
Флуоресцентная микроскопия широко используется в биологических науках . Некоторые исследуемые объекты по своей природе флуоресцентны. Это известно как автофлуоресценция . Например, у растений есть хлорофиллы и другие пигменты, которые естественным образом флуоресцируют. Однако автофлуоресценция часто нежелательна, поскольку, как фоновая флуоресценция, затрудняет обнаружение искусственной флуоресценции.
Для биомедицинских приложений были разработаны различные методы флуоресцентного мечения. Некоторые флуоресцентные красители связываются непосредственно с исследуемой структурой благодаря своим химическим свойствам. В эту группу входят, например, красители для ДНК, такие как DAPI , акридиновый оранжевый и Hoechst 33342, или мембранные красители, такие как нильский красный или DiI . Некоторые из этих красителей также могут окрашивать живые клетки.
В других случаях нефлуоресцентная молекула, которая связывается с исследуемой структурой, химически связана с флуоресцентным красителем. Примерами этого подхода являются иммунофлуоресценция , в которой используются флуоресцентно-меченые антитела , флуоресцентная гибридизация in situ , метод микроскопического обнаружения больших участков ДНК или окрашивание актина меченным флуоресценцией фаллоидином .
Белки могут быть генетически слиты с флуоресцентным белком, таким как GFP . Затем на основе флуоресцентного микроскопического изображения можно сделать выводы о распределении и расположении исследуемого белка в живой и в основном фиксированной клетке ( например, в ядре клетки , в цитоплазме , связанном с клеточной мембраной или экспортированном наружу) или Компоненты клетки можно визуализировать по их специфическим белкам (например, актиновые филаменты через актин или микротрубочки через тубулин ). Взаимодействие между белками также можно наблюдать, когда они сливаются с различными флуоресцентными белками. Флуоресцентные белки могут также контролировать тип клеток -специфического промотор , выраженный идентифицировать определенные типы клеток.
Другая группа состоит из зондов, поведение флуоресценции которых меняется в зависимости от условий окружающей среды. Кальцийзависимые красители, такие как экворин , фура -2 , фураптра , кальцеин и индо-1, могут указывать на колебания концентрации ионов кальция в клетке. Изменения напряжения в клетке могут отображаться с помощью зависимых от напряжения красителей или репортерных белков VSFP или PROPS. С окислительно - восстановительными , чувствительными к репортерным белкам , такому rogfp , rxYFP или HyPer может окислительно - восстановительные потенциалы преследуются. Флуоресцентные индикаторы pH могут показывать разные значения pH в ячейке.
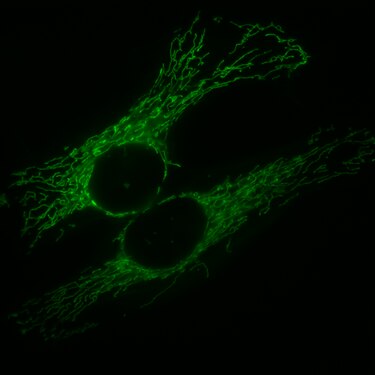
- Изображения с флуоресцентного микроскопа
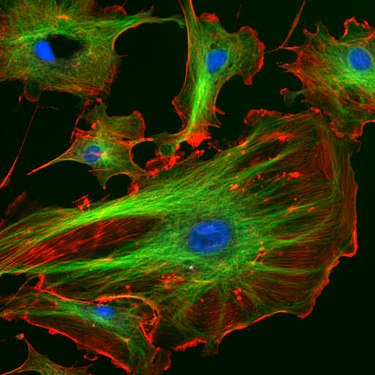
Эндотелиальные клетки под флуоресцентным микроскопом. В микротрубочки зеленые (с FITC - меченым антителом), актиновые филаменты являются красный (с фаллоидином - TRITC ). ДНК в ядрах клеток окрашивали DAPI (синий).
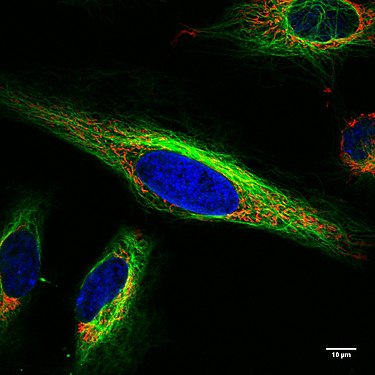
Живые клетки HeLa под конфокальным микроскопом. Митохондрии - красным, ядро клетки - синим, микротрубочки - зеленым.
Иммунофлуоресцентное изображение в спинномозговом ганглии крысы. Два разных белка окрашивали красными или зелеными флуоресцентными маркерами.
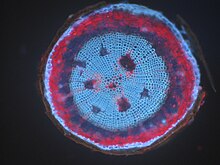
Метафазные хромосомы из женских лимфоцитов человека, окрашенные хромомицином A3.
Ядро клетки фибробласта мыши , территории хромосом 2 (красный) и 9 (зеленый) окрашивали флуоресцентной гибридизацией in situ. Контрастное окрашивание ДНК синим цветом.
Клетки HeLa, митохондрии, помечены GFP, который слит с соответствующим сигнальным пептидом .
Приложения в материаловедении
В отличие от наук о жизни флуоресцентные красители редко используются в материаловедении . Использование флуоресцентной микроскопии в основном ограничивается случаями, когда материал является автофлуоресцентным. Например, некоторые компоненты композитных материалов являются флуоресцентными и их можно отличить от других нефлуоресцентных компонентов. Для лучшего представления ситуации флуоресценцию можно совместить с отражением в конфокальном микроскопе . Это означает, что флуоресцентные связующие (базовый полимер) можно отличить от нефлуоресцентных волокон, например, в композитных материалах , армированных стекловолокном .
Органические волокна бумаги , дерева или луба изучались в ряде исследований с целью определения их расположения или состава.
Различные типы солнечных элементов также можно исследовать с помощью флуоресцентного микроскопа. Часто используется конфокальная флуоресцентная микроскопия, также в сочетании с конфокальной отражательной микроскопией. В органических солнечных элементах можно исследовать потерю флуоресцентных органических компонентов, вызванную окислением кислородом, проникшим в элемент; при условии, что продукты разложения не являются флуоресцентными. Влияние света на формирование одноименного перовскитного слоя было проанализировано в перовскитных солнечных элементах .
Хотя ряд минералов флюоресцируют, флуоресцентная микроскопия мало используется в петрологии . Заметным исключением является изучение угля и органических включений в отложениях . Чистые минералы обычно не флуоресцируют, но флуоресценция может быть вызвана различными неорганическими или органическими примесями. Такие породообразующие компоненты угля, имеющие органическое происхождение, называются мацералами . Подгруппа - липтиниты, богатые липидами. Эти флуоресцентные компоненты можно микроскопически отличить от нефлуоресцентных неорганических компонентов, особенно на полированных поверхностях . Во время образования угля флуоресцентные свойства меняются, так что можно различать материалы из разных месторождений .
Специальные процедуры флуоресцентной микроскопии
Световая дисковая микроскопия
Во флюоресцентной микроскопии светового листа ( англ. Light sheet microscopy ; также микроскопия светового листа или микроскопия с одноплоскостным освещением , SPIM) - это возбуждающий свет сбоку в виде линзы или светового листа, облучаемого. Это можно сделать с помощью второго объектива или соответствующей цилиндрической линзы, которая перпендикулярна объективу наблюдения и освещает узко ограниченную плоскость образца. Флуоресценция генерируется только на этой освещенной панели, и эта плоскость фокусируется в объективе наблюдения. Поэтому в других плоскостях не возникает нечеткой фоновой флуоресценции, которая могла бы привести к снижению контраста при нормальной флуоресцентной микроскопии. Метод позволяет улучшить осевое разрешение обычного флуоресцентного микроскопа, если световой лист тоньше, чем глубина резкости линзы наблюдения. Боковое освещение объекта исследования аналогично расположению в щелевом ультразвуковом микроскопе .
Конфокальная и двухфотонная флуоресцентная микроскопия
Образец сканируется как в конфокальном, так и в двухфотонном микроскопах: возбуждающий свет фокусируется на точке, флуоресценция из этой точки достигает детектора. Точка перемещается по образцу, и интенсивности флуоресценции, измеренные в каждом случае, объединяются для формирования изображения в управляющем компьютере.
При конфокальной флуоресцентной микроскопии флуоресценция также возникает в конусе освещения выше и ниже плоскости фокуса. Однако он не достигает детектора, потому что он заблокирован отверстием в промежуточной плоскости изображения. Блокируя эту фоновую флуоресценцию, сигнал в фокальной плоскости лучше выходит из фона, чем в классической флуоресцентной микроскопии. Из-за этих явно более контрастных изображений конфокальные микроскопы широко используются в биологических исследованиях.
Флуоресцентный краситель также может возбуждаться двухфотонным поглощением вместо поглощения одного фотона . Предпосылкой для этого является то, что эти два фотона достигают флуоресцентного красителя почти одновременно, и что оба вместе имеют правильное содержание энергии, чтобы поднять электрон красителя до возбужденного энергетического уровня. Оба условия могут быть выполнены, если для возбуждения используется импульсный лазер , который, в зависимости от возбуждаемого флуоресцентного красителя, генерирует волны с длиной волны от 700 до 1200 нм с высокой интенсивностью, и этот свет фокусируется объективом в точку. Тогда плотность фотонов настолько высока, что существует достаточная вероятность того, что два фотона достигнут флуоресцентной молекулы одновременно. В отличие от конфокальной микроскопии, где объем считывания ограничен, здесь ограничен объем возбуждения. Более длинноволновый свет проникает в биологические ткани в большей степени, так как они меньше поглощаются ими и менее сильно рассеиваются . Поэтому двухфотонная флуоресцентная микроскопия используется для более глубокого проникновения в ткань, чем это возможно с помощью других методов. Наряду с методами, не основанными на флуоресценции, эта процедура известна как многофотонная микроскопия или нелинейная микроскопия.
Флуоресцентная корреляционная спектроскопия
Флуоресцентная корреляционная спектроскопия (сокращенно FCS для флуоресцентной корреляционной спектроскопии ) - это метод флуоресцентной микроскопии, но он не генерирует изображения. В конфокальном микроскопе возбуждающий лазер не сканирует образец, а размещается в одном месте. Таким образом, очень небольшой объем наблюдается в течение более длительного периода времени. Если флуоресцентные молекулы перемещаются в этот объем или из него, измеренная яркость изменяется. Такую серию измерений можно использовать, например, для определения того, насколько быстро молекулы диффундируют в растворе . Поскольку скорость диффузии зависит, среди прочего, от размера, можно, например, исследовать, связывается ли меченный флуоресценцией белок со вторым белком, который также присутствует в растворе, и, таким образом, движется ли он медленнее.
Процесс с повышенным разрешением
В микроскопии разрешение - это расстояние, на котором должны находиться две структуры, чтобы они воспринимались как отдельные структуры. Эрнст Аббе был первым, кто понял в 19 веке, что это разрешение принципиально ограничено дифракцией . Поэтому этот предел называется пределом Аббе. Его можно точно рассчитать, используя соответствующие формулы, и для хороших микроскопов, использующих масляную иммерсию и в зависимости от длины волны, он составляет около 200 нм.
Предел Аббе долгое время считался непреодолимым. Однако со второй половины 20-го века были разработаны некоторые микроскопические методы, разрешение которых лучше, чем предсказывалось пределом Аббе. Безусловно, самым старым из этих методов является конфокальная микроскопия (см. Также раздел о разрешении в статье Конфокальный микроскоп). Теоретическое улучшение, однако, происходит только с коэффициентом корня 2 ≈ 1,41. По практическим соображениям это тоже недостижимо.
В 80-е годы это была микроскопия TIRF ( английская предложенная флуоресцентная микроскопия полного внутреннего отражения ). Он возбуждает только флуоресцентные красители в образце, очень близкие к покровному стеклу. Если препарат, например живые клетки, находится в водной среде, возбуждение от покровного стекла проникает только в слой толщиной 100-200 нм. Таким образом, толщина слоя значительно меньше, чем это было бы возможно при обычной микроскопии из-за дифракции. Это приводит к значительно более высокому контрасту, поскольку только небольшое количество материала возбуждается во флуоресценцию. Эта особая форма возбуждения достигается за счет освещения образца под таким большим углом, что полное отражение происходит на краю покровного стекла в водную среду, и луч света вообще не проникает через образец. Однако на краю возникает затухающая волна , которая может привести к возбуждению, но очень быстро ослабевает по мере увеличения расстояния от покровного стекла.
В то время как «разрешение» по определению означает минимальное расстояние между двумя структурами, точное положение на объекте может быть измерено очень точно. Таким образом, флуоресцентная микроскопия может обойти предел Аббе, определяя точное положение объектов в разных цветовых каналах и затем измеряя расстояние между ними. Этот метод был разработан в 1990-х годах и позже получил название спектральной прецизионной дистанционной микроскопии (SPDM). Его можно использовать для измерения расстояний между небольшими флуоресцентными структурами с точностью около 70 нм. Однако это не приводит к общему улучшению разрешения, поскольку каждый из записанных цветовых каналов подвержен дифракции.
Однако в конце 20-го и начале 21-го века были разработаны некоторые методы, с помощью которых возможно общее улучшение. На английском они все вместе называются микроскопией сверхвысокого разрешения , иногда также как наноскопия . Их всех объединяет то, что они основаны на флуоресцентной микроскопии. Три из этих методов приобрели некоторую популярность и коммерчески доступны: STED, структурированное освещение и локализационная микроскопия. Существуют также другие методы, которые не могут противостоять вышеупомянутому или которые до сих пор использовались только отдельными группами. Некоторые процедуры объединены в группу микроскопов RESOLFT из-за их общих свойств .
Флуоресцентная микроскопия высокого разрешения была названа журналом Nature Methods методом года 2008. Уильям Моернер , Эрик Бетциг и Стефан Хелл получили Нобелевскую премию по химии 2014 года за разработку некоторых из этих методов.
STED-микроскопия

В STED-микроскопии ( англ. Стимулированное истощение эмиссии ) дифракционный предел значительно преодолевается. Возбуждение ограниченного дифракцией объема в образце сопровождается кольцевым девозбуждением светом с большей длиной волны. Возбужденные молекулы в области снятия возбуждения возвращаются в основное состояние посредством вынужденного излучения . Тем самым значительно снижается объем излучения флуоресценции и повышается разрешение микроскопа.
Структурированное освещение
При структурированном освещении или 3D-SIM-микроскопии (англ. « Структурированная микроскопия с освещением» ) возбуждаются не все флуорохромы, а только часть препарата в виде определенной «структуры», полосатого узора. Когда известный образец освещения накладывается на неизвестное распределение флуорохрома в образце, возникают эффекты муара , размер которых превышает предел разрешения, даже если неизвестная структура меньше. Путем сдвига и поворота шаблона освещения можно вычислить дополнительную информацию из шаблонов муара соответствующих изображений для создания окончательного изображения с разрешением до двух раз.
Локализационная микроскопия
Локализационная микроскопия - это термин, используемый для обобщения микроскопических процедур, основанных на общем базовом принципе: в то время как в классической флуоресцентной микроскопии все флуорохромы возбуждаются одновременно, здесь они возбуждаются один за другим, так что только небольшая часть из них возбуждается одновременно. всегда горит. Многие снимки делаются один за другим с одного уровня фокусировки, часто более тысячи. Точное положение светящихся флуорохромов теперь определяется на каждом из этих изображений, и это положение переносится на окончательное изображение. Процедуры различаются способом включения и выключения отдельных молекул красителя, то есть заставляют их «мигать».
Фотоактивирована локализация микроскопия (ЛАДОНЬ) основана на вариантах зеленого флуоресцентного белка , один с учетом определенных длинами волн и отпустить. STORM и dSTORM используют подходящие флуоресцентные красители, которые редко флуоресцируют в определенных буферных растворах. Истощение основного состояния (GSD) основано на том факте, что в любой момент времени большинство флуорохромов находятся в нефлуоресцентном триплетном состоянии, которое может быть создано сильным световым возбуждением. DNA-Paint основан на временном связывании коротких одноцепочечных молекул ДНК с комплементарными молекулами-мишенями.
Дальнейшие методы улучшения разрешения
4Pi-микроскопия была первым коммерчески доступным методом сверхвысокого разрешения , но сегодня он больше не доступен. Еще одна технология - Vertico-SMI , разработанная в Гейдельберге.
Флуоресцентная пожизненная микроскопия (FLIM)
После возбуждения флуоресцентное вещество остается в возбужденном состоянии в течение короткого периода времени, прежде чем оно испускает флуоресцентный свет. Продолжительность этого периода времени варьируется для конкретного вещества в определенном диапазоне, поэтому для конкретного вещества можно определить среднее время жизни флуоресценции . Он находится в наносекундном диапазоне, например, для флуоресцеина - 3,25 нс, для Texas Red - 3,41 нс и для эозина - 1,1 нс. Если возбуждение флуоресценции в микроскопическом препарате происходит с помощью импульсного или модулированного лазера и используются специальные детекторы, то временной промежуток, по истечении которого флуоресценция достигает детектора, может быть определен с помощью специальных методов измерения . Таким образом, флуоресцентные красители можно отличить друг от друга не только по цвету, но и по сроку службы. Это используется в микроскопии времени жизни флуоресценции (англ. Fluorescence life imaging microscopy , FLIM). Доступны импульсные и модулированные лазеры в видимом диапазоне длин волн для возбуждения фотоном. FLIM также может использоваться в сочетании с многофотонным возбуждением (см. Выше), для которого в любом случае требуются импульсные лазеры.
Фёрстеровский резонансный перенос энергии (FRET)
При резонансной передаче энергии Фёрстера (иногда также: резонансной передаче энергии флуоресценции) энергия возбужденного флуоресцентного красителя, донора, не испускается флуоресценцией, а передается непосредственно другому флуоресцентному красителю (акцептору). Это возможно, если, во-первых, донор и акцептор находятся на расстоянии менее 10 нм друг от друга и, во-вторых, энергия излучения донора соответствует энергии возбуждения акцептора. Поэтому спектр излучения донора должен перекрываться спектром возбуждения акцептора. Например, зеленый флуоресцентный краситель может служить донором для оранжевого флуоресцентного акцептора. Другой пример - голубой флуоресцентный белок CFP в качестве донора для желтого флуоресцентного белка YFP.
Если происходит FRET, донор не испускает флуоресценции, несмотря на возбуждение донора; вместо этого можно наблюдать флуоресценцию акцептора. Эффективность FRET уменьшается с увеличением расстояния между донором и акцептором в шестую степень. Таким образом, появление FRET указывает на непосредственную близость этих двух объектов с точностью, значительно ниже предела разрешения.
Преднамеренное обесцвечивание для измерения диффузии (FRAP и FLIP)
В FRAP ( восстановление флуоресценции после фотообесцвечивания ) молекула, меченная флуоресценцией, в живой клетке намеренно обесцвечивается в части клетки путем кратковременного сильного воздействия света, обычно с помощью сфокусированного лазерного луча. Затем наблюдают, как быстро молекулы из неотбеленной части клетки возвращаются в обесцвеченную часть. Выводы о связывающем поведении молекулы можно сделать на основании определенной скорости диффузии.
С другой стороны, с FLIP ( потеря флуоресценции при фотообесцвечивании ) часть клетки постоянно обесцвечивается. Наблюдают, как быстро уменьшается флуоресценция в неотбеленной части клетки.
история
1904: открытие Келера
Первые флуоресцентные микроскопические наблюдения были случайными и неудобными. Август Кёлер , сотрудник производителя микроскопов Carl Zeiss , хотел повысить разрешение светового микроскопа. Разрешение зависит от длины волны, поэтому он построил микроскоп для ультрафиолетового света, чтобы использовать его более короткую длину волны. Созданное таким образом изображение было невидимо для глаз, но могло быть зафиксировано фотографическим способом. Он обнаружил, что
«Сам объект флуоресцирует под воздействием падающего на него ультрафиолетового излучения. Такая флуоресценция наблюдается у большинства образцов. ... Флуоресцентный свет ... в любом случае частично находится в видимом диапазоне спектра; ... Очевидно, что это затрудняет, а то и делает невозможным восприятие изображения, создаваемого ультрафиолетовыми лучами, которые действительно важно. ... При определенных обстоятельствах, конечно, наблюдение этого прямого изображения может также заинтересовать ... "
Поэтому Кёлер с самого начала осознавал, что флуоресценция, которая является разрушающим фактором в УФ-микроскопии, также может быть полезной для применения.
1910–1913: Первые флуоресцентные микроскопы и их применение.
Первый коммерчески доступный флуоресцентный микроскоп был разработан Оскаром Хеймштадтом , который возглавлял вычислительное и конструкторское бюро венского производителя микроскопов Карла Райхерта . Он был представлен лично Райхертом в 1911 году на встрече немецких естествоиспытателей и врачей . В том же году Хаймштадт опубликовал работу под названием «Флуоресцентный микроскоп» в журнале по научной микроскопии.
Ультрафиолетовый свет хорошо подходит для возбуждения флуоресценции, так как он не виден глазом, и поэтому блокирующий фильтр не требуется. Хорошая стимуляция требует, чтобы на образец не попадал видимый УФ-свет от источника света, а было как можно больше УФ-света. Подходящий фильтр возбуждения был разработан незадолго до этого, в 1910 году, Хансом Леманом из Zeiss. Он состоял из фильтровальной кюветы, состоящей из двух камер вдоль оптической оси. Три стенки были выполнены из йенского голубого увиолового стекла , одна камера была заполнена насыщенным раствором сульфата меди , другая - разбавленным раствором нитрозодиметиланилина . Генерируемый таким образом возбуждающий свет назывался «фильтрованным ультрафиолетом». Поскольку обычное стекло поглощает ультрафиолетовый свет, немного позже был использован кварцевый конденсатор для получения высоких уровней освещенности. Однако возникла новая проблема: стеклянные линзы объектива начали флуоресцировать. Поэтому Леманн использовал конденсор темного поля : возбуждающий свет проходил мимо линзы, и на микроскопическом изображении также избегались остатки видимого света от источника света.
Хаймштадт писал о возможностях и будущих перспективах флуоресцентной микроскопии.
"Это З. Например, легко обнаружить присутствие в муке очень небольшого количества спорыньи ... потому что крахмал флуоресцирует ярко-пурпурным, а спорынья излучает желтовато-белый свет. ...
Будущее должно научить нас, насколько и насколько флуоресцентный микроскоп ... [включает] возможность расширения области микроскопических изображений ".
Также в 1911 году Михаил Цветт описал флуоресценцию хлоропластов. В 1913 году Станислав фон Провазек опубликовал первую работу, в которой использовались флуоресцентные красители, а именно эозин и нейтральный красный .
Спустя год после создания флуоресцентного микроскопа Райхерта «люминесцентный микроскоп» Zeiss, разработанный Леманом, был представлен на собрании немецких естествоиспытателей и врачей в 1912 году. Освещение темного поля приводит к уменьшению числовой апертуры и, следовательно, к уменьшенному разрешению. Поэтому Lehmann полагался на обычное яркое поле с УФ-светом. Чтобы предотвратить проникновение ультрафиолетового света в глаза, он использовал стеклянный фильтр, блокирующий ультрафиолет, сделанный из стекла Euphos, который использовался в качестве покровного стекла . Фильтр должен был находиться между образцом и объективом, чтобы избежать возбуждения флуоресценции в объективе, поэтому никакое другое положение для фильтра было невозможно. Конденсор имел кварцевые линзы, а используемые предметные стекла микроскопа были сделаны из горного хрусталя для обеспечения пропускания УФ-излучения. Рекомендуемое стандартное увеличение составляло 62 × (включая увеличение окуляра), 300 × не должно превышаться. Дополнительное флуоресцентное оборудование без самого микроскопа стоит около 500 марок с самым дешевым источником возбуждающего света - дуговой лампой с ручной регулировкой . Также было 4,50 М для предметного стекла из горного хрусталя 30 × 25 мм толщиной 0,5 мм и одна отметка на покровное стекло Euphos. Помимо черно-белых фотографий, с помощью процесса автохромирования можно также создавать цветные изображения .
1933–1940: Макс Хайтингер и флюорохромирование

На заре флуоресцентной микроскопии исследовались почти исключительно автофлуоресцентные объекты. Даже Макс Хайтингер, первые частные исследователи в Вайдлинге недалеко от Вены, а затем в Венском университете , начали с изучения флуоресценции вина и фруктовых вин. Однако с 1933 года он разработал флуоресцентные пятна, которые он назвал «флуорохромами». Термины вторичная флуоресценция для генерируемых сигналов и первичная флуоресценция для тех, которые в природе присутствуют в препарате, исходят от него. Он также ввел термин флуорохром для обозначения флуоресцентного красителя. Сначала он использовал экстракты растений в качестве флуорохромов, а затем и ряд химических веществ. Это позволило ему окрашивать тонкие срезы тканей животных и человека, так что гистологи также начали интересоваться флуоресцентной микроскопией. Поскольку требовались только очень низкие концентрации флуорохромов, также были возможны живые пятна, которые в основном использовались в ботанике. С окрашиванием аурамином O управляемых бактерий туберкулеза . Возможно также множественное окрашивание. Хайтингер опубликовал первую статью в 1934 году, его книга «Флуоресценция - ваше приложение в гистологии и химии» была опубликована в 1938 году.
Хайтингер тесно сотрудничал с Райхертом над улучшением их флуоресцентного микроскопа. Новая модель «Кам Ф» продавалась с 1931 года. В ней также использовалась дуговая лампа с железными электродами в качестве источника света, поскольку она имела сравнительно высокую УФ-составляющую от 300 до 400 нм. Тем не менее, ему требовалось до 20 минут выдержки для своих фотографий. Для малых увеличений он указывает время выдержки с угольными дуговыми лампами от одной до десяти минут. Раствор нитрозилдиметиланилина в кювете фильтра возбуждения можно было заменить фильтрами из черного стекла, содержащими оксид никеля. Раствор сульфата меди, который отфильтровывал оставшийся красный компонент в возбуждающем свете, не заменялся синими стеклянными фильтрами до начала 1940-х годов. Освещение осуществлялось конденсатором яркого поля с нормальным стеклом; Оказалось, что кварцевое стекло для этого не требуется. Оставшийся возбуждающий свет блокировался окуляром с помощью блокирующего светофильтра из желтого стекла толщиной 1 мм. Если требовался бесцветный барьерный фильтр, вместо него можно было использовать кювету со слоем раствора нитрита натрия толщиной 5 мм. Покровные стекла из стекла Euphos больше не требовались благодаря желтому блокирующему фильтру, а также было показано, что подходят обычные предметные стекла. Это значительно снизило эксплуатационные расходы.
В своей книге 1938 года Хайтингер также описывает освещение падающим светом для флуоресцентной микроскопии непрозрачных объектов (Epicondensor от Zeiss-Jena, Epilum от Optical Works C. Reichert-Wien (см. Схематический рисунок), Ultropak от E. Leitz-Wetzlar и Univertor от E Буш-Ратенов ). Однако их нельзя сравнивать с сегодняшним возбуждением флуоресценции падающим светом с помощью дихроичного светоделителя. В качестве примеров применения он приводит исследования продуктов питания, лекарств и красителей, а также первоначальные исследования препаратов, из которых должны быть изготовлены тонкие срезы . Он описывает освещение падающим светом для исследований на живых животных как «особенно ценное».
Примерно в 1940 году Osram вывела на рынок ртутные лампы сверхвысокого давления , для которых вскоре было добавлено осветительное оборудование в Zeiss и, при совместной разработке Haitinger, в Reichert (Lux UV и Lux UW). Помимо значительно упрощенного обращения и большей яркости, эти лампы излучали не только отдельные линии, но и непрерывный спектр, с помощью которого можно было стимулировать все флуоресцентные вещества. Они также не производили неприятного дыма, как железные дуговые лампы. Подобные лампы используются до сих пор.
В 1940-х годах цветная слайд- пленка стала использоваться для документирования. Несмотря на весь прогресс, время экспозиции в основном все еще находилось в двухзначном диапазоне минут.
1942–1958: Развитие иммунофлуоресценции и флуоресценции обычных красителей.
Прорывом в флуоресцентной микроскопии стало внедрение иммунофлуоресценции . Опубликованная тысяча девятьсот сорок два Альберт куны и его коллега сцепных флуоресцеина - изоцианат с антителами . Благодаря своей ярко-зеленой флуоресценции этот флуорохром лучше выделялся на фоне синеватой автофлуоресценции многих тканей, чем ранее испытанный изоцианат антрацена . Антитела были направлены против пневмококков , которые можно было обнаружить в ткани мыши с помощью флуоресцентной микроскопии. Однако связывание антител было технически сложным, и конъюгаты были нестабильными.
Siegfried Strugger отметил , что некоторые известные обычные красители и флуоресцируют, такие , как нейтральные красные и родамин B . Он также ввел акридиновый оранжевый в флуоресцентную микроскопию. В книге 1949 года он подробно описал возможности возбуждения флуоресценции синим светом вместо УФ. Струггер использовал падающий свет, чтобы отслеживать поток воды в растениях.
Значительное улучшение иммунофлуоресценции было достигнуто в 1958 году Дж. Л. Риггсом и его коллегами за счет использования изотиоцианатов вместо изоцианатов. Тем временем другой рабочей группе удалось обнаружить два цвета с помощью изоцианата флуоресцеина и оранжевого флуоресцентного изоцианата родамина B. Риггс и его коллеги теперь преуспели в маркировке антител гораздо более стабильным изотиоцианатом флуоресцеина (FITC) и изотиоцианатом родамина B.
1962–1972: Йохан Себастьян Плоэм и введение интерференционного фильтра.
В 1950-х годах флуоресцентная микроскопия выполнялась только с использованием возбуждающего УФ, фиолетового или синего света. Это изменилось только с появлением в 1960-х годах интерференционных фильтров, которым руководил голландец Йохан Себастьян Плоэм . Первыми, кто использовал дихроичный светоделитель в микроскопии, были русские Брумберг и Крылова в 1953 году. Однако работа, опубликованная на русском языке, осталась неизвестной на Западе и была «открыта заново» лишь позже.
В связи с разработкой множества антител для иммунофлуоресценции возникла потребность в флуорохромах разного цвета. Однако их часто трудно стимулировать обычным использованием ультрафиолетового света. Примерно в 1962 году Ploem начал сотрудничество с заводами Schott в Майнце для разработки дихроичных светоделителей, отражающих синий или зеленый свет. Schott ранее производил многие из стеклянных фильтров, обычно используемых в флуоресцентной микроскопии. Компания Leitz поставила Ploem непрозрачный падающий свет с полупрозрачным, независимым от цвета зеркалом. Он был перестроен в Universiteit van Amsterdam и получил слайд с четырьмя позициями для дихроичных светоделителей для возбуждения УФ, фиолетовым, синим и зеленым светом, чтобы можно было удобно выбрать соответствующую длину волны возбуждения. Впервые возбуждение шло через линзу, как это принято сегодня. Выбирая узкополосные интерференционные фильтры для синего или зеленого возбуждающего света, красители FITC (зеленый флуоресцентный) и тетраметилродамина изотиоцианат (TRITC; оранжевый флуоресцентный), которые часто используются в иммунофлуоресценции, могут быть возбуждены близко к максимуму их поглощения без одновременного большого количество автофлуоресценции из-за ненужных длин волн возбуждения запускается. Плоэм опубликовал свои результаты в нескольких статьях, начиная с 1965 года.

Затем Лейтц разработал PLOEMOPAK, устройство, на котором четыре светоделителя могли попеременно вращаться на пути луча. Более поздние версии были дополнены блокирующими фильтрами и фильтрами возбуждения, пока в 1972 году на рынке не появился вариант, содержащий четыре куба флуоресцентного фильтра, каждый с фильтром возбуждения, светоделителем и блокирующим фильтром. Пользователь мог менять кубики, чтобы адаптировать их к используемым флуорохромам.
На этом разработка эпифлуоресцентного микроскопа, который используется до сих пор, была в принципе завершена. Однако прошло несколько лет, прежде чем этот тип строительства стал общепринятым. В британских учебниках по микроскопии 1975 и 1977 годов упоминается только возможность УФ-возбуждения и освещения проходящим светом. Позднее в 1982 г. говорилось, что освещение обычно осуществляется с помощью конденсатора темного поля, но также описывалось освещение падающим светом с помощью дихроичного светоделителя и представлялось его более чувствительным к свету. Также была упомянута возможность обнаружения флуорохромов, таких как FITC и родамин, один за другим путем замены всех фильтров.
В западногерманском учебнике 1985 года описаны все три возможности: яркое и темное поле в проходящем свете, а также возбуждение светлого поля в отраженном свете через линзу, причем последнее объясняется особенно простой настройкой (поскольку конденсатор не требуется), а также высокой интенсивностью возбуждения. с отличным контрастом и упомянул возможность быстрой замены фильтрующих блоков. Производителями таких систем были названы Leitz, Olympus , Reichert, Zeiss и Jena, что, вероятно, имел в виду VEB Carl Zeiss Jena . В учебнике 1988 г. упоминались старые методы, но затем говорилось: «Современные флуоресцентные микроскопы работают по принципу возбуждения светлого поля отраженным светом» с дихроичной разделительной пластиной. Далее было сказано: «Большинство производителей микроскопов предлагают оборудование для флуоресцентной микроскопии в проходящем и отраженном свете».
веб ссылки
- Майкл Волгер (Ред .: Ирен К. Лихтшайдл): Флуоресцентная микроскопия. Проверено 25 марта 2017 г. (теоретическое введение и инструкции для практического применения в Венском университете. Univie.ac.at (PDF)).
- Многоволновое эпи -освещение в флуоресцентной микроскопии . Авторы: Йохан Себастьян Плоэм и Фридрих Вальтер из Leica Science Lab.
- Базы данных флуоресцентных красителей: Fluorophores.org , Spectra Database в Университете Аризоны, Fluorescence SpectraViewer в Thermo Fisher.
Индивидуальные доказательства
- ↑ а б Йорг Хаус: Оптическая микроскопия . Wiley-VCH, Weinheim 2014, ISBN 978-3-527-41127-6 , стр. 163-173 .
- ↑ б с д е е г ч я J к л м Г Кокс: Оптические методы визуализации в клеточной биологии . Второе издание: CRC Press, Taylor & Francis Group, Бока-Ратон, Флорида, США, 2012 г., ISBN 978-1-4398-4825-8 , стр. 35-48 .
- ^ Markus Axmann, Йозеф Madl, Герхард Дж Шютц: одномолекулярная Микроскопия в области наук о жизни . В: Ульрих Кубичек (Ред.): Флуоресцентная микроскопия . Wiley-Blackwell, Weinheim 2013, ISBN 978-3-527-32922-9 , стр. 293-343, здесь с. 309 .
- ↑ И. Георгакуди, BC Jacobson, MG Müller, EE Sheets, K. Badizadegan, DL Carr-Locke, CP Crum, CW Boone, RR Dasari, J. Van Dam, MS field: NAD (P) H и коллаген как in vivo количественные флуоресцентные биомаркеры предраковых изменений эпителия. В: Исследования рака . Выпуск 62, номер 3, февраль 2002 г., стр. 682-687, PMID 11830520 .
- ^ MR Speicher, S. Gwyn Ballard, DC Ward: Кариотипирование человеческих хромосом с помощью комбинаторной мультифлуоресцентной FISH. В кн . : Природная генетика . Том 12, номер 4, апрель 1996 г., стр. 368-375, DOI: 10.1038 / ng0496-368 . PMID 8630489 .
- ↑ А. Больцер, Г. Крет, И. Соловей, Д. Келер, К. Сараджоглу, К. Фаут, С. Мюллер, Р. Эйлс, К. Кремер, М. Р. Спайхер, Т. Кремер: Трехмерные карты всего хромосомы в ядрах мужских фибробластов человека и розетках прометафаз. В кн . : Биология PLoS . Том 3, номер 5, май 2005 г., стр. E157, DOI : 10.1371 / journal.pbio.0030157 . PMID 15839726 , PMC 1084335 (полный текст).
- ^ A b Дуглас Б. Мерфи, Майкл В. Дэвидсон: Основы световой микроскопии и электронной визуализации . Второе издание. Wiley-Blackwell, Hoboken, NJ, USA 2013, ISBN 978-0-471-69214-0 , стр. 45-50 .
- ↑ Гай Кокс: Методы оптической визуализации в клеточной биологии . Второе издание: CRC Press, Taylor & Francis Group, Бока-Ратон, Флорида, США, 2012 г., ISBN 978-1-4398-4825-8 , стр. 75-81 .
- ↑ Дуглас Б. Мерфи, Майкл В. Дэвидсон: Основы световой микроскопии и электронной визуализации . Второе издание. Wiley-Blackwell, Hoboken, NJ, USA 2013, ISBN 978-0-471-69214-0 , стр. 389-413 .
- ↑ Рольф Теодор Борлингхаус: Конфокальная микроскопия в белом: оптические срезы всех цветов . Springer Spectrum, 2016, ISBN 978-3-662-49358-8 .
- ^ Ян Д. Джонсон: Практические соображения при выборе и применении флуоресцентных зондов . В: Джеймс Паули (ред.): Справочник по биологической конфокальной микроскопии . 3-е издание. Springer Science and Business Media LLC, 2006, ISBN 0-387-25921-X , Глава 1, стр. 353-367 .
- ^ A b Дуглас Б. Мерфи, Майкл В. Дэвидсон: Основы световой микроскопии и электронной визуализации . Второе издание. Wiley-Blackwell, Hoboken, NJ, USA 2013, ISBN 978-0-471-69214-0 , стр. 361-365 .
- ↑ a b c Герд Ульрих Ниенхаус, Карин Ниенхаус: флуоресцентная маркировка . В: Ульрих Кубичек (Ред.): Флуоресцентная микроскопия . Wiley-Blackwell, Weinheim 2013, ISBN 978-3-527-32922-9 , стр. 143-173, здесь стр. 147-148 .
- ↑ Дуглас Б. Мерфи, Майкл В. Дэвидсон: Основы световой микроскопии и электронной визуализации . Второе издание. Wiley-Blackwell, Hoboken, NJ, USA 2013, ISBN 978-0-471-69214-0 , стр. 227 f .
- ↑ a b Гай Кокс: Методы оптической визуализации в клеточной биологии . Второе издание: CRC Press, Taylor & Francis Group, Бока-Ратон, Флорида, США, 2012 г., ISBN 978-1-4398-4825-8 , стр. 181-190 .
- ↑ Гай Кокс: Методы оптической визуализации в клеточной биологии . Второе издание: CRC Press, Taylor & Francis Group, Бока-Ратон, Флорида, США, 2012 г., ISBN 978-1-4398-4825-8 , стр. 169-180 .
- ↑ Дуглас Б. Мерфи, Майкл В. Дэвидсон: Основы световой микроскопии и электронной визуализации . Второе издание. Wiley-Blackwell, Hoboken, NJ, USA 2013, ISBN 978-0-471-69214-0 , стр. 167 .
- ^ Эшли Р. Кларк, Колин Найджел Эберхардт: Методы микроскопии для материаловедения . Woodhead Publishing, Abington Hall 2002, ISBN 978-1-85573-587-3 , стр. 255, 279-284 .
- ^ Л. А. Дональдсон: Анализ волокон с помощью микроскопии . В: Справочник по структуре текстильных волокон. Основы и производимые полимерные волокна. Том 1 в издательской серии Woodhead по текстилю . 2018 Elsevier, 2009, стр. 121-153 , DOI : 10,1533 / 9781845696504.1.121 ( выдержка ).
- ^ Панкадж Кумар: Органические солнечные элементы: физика устройства, обработка, деградация и предотвращение . CRC Press, 2016, ISBN 978-1-4987-2327-5 , стр. 23 ( Google Книги ).
- ↑ JH Huang, FC Chien, P. Chen, KC Ho, CW Chu: Мониторинг трехмерных наноструктур объемных полимерных солнечных элементов с гетеропереходом с использованием конфокальной визуализации времени жизни. В кн . : Аналитическая химия . Том 82, номер 5, март 2010 г., стр. 1669-1673, DOI: 10.1021 / ac901992c , PMID 20143827 .
- ↑ A. Ummadisingu, L. Steier, JY Seo, T. Matsui, A. Abate, W. Tress, M. Grätzel: Влияние освещения на формирование перовскитных пленок галогенидов металлов. В кн . : Природа . Том 545, номер 7653, 05 2017 г., стр. 208-212, DOI: 10.1038 / nature22072 , PMID 28445459 .
- ^ FWD Rost: Том II флуоресцентной микроскопии . Cambridge University Press, 1995, ISBN 978-0-521-41088-5 , стр. 40–47 ( онлайн в Google Книгах ).
- ↑ а б в г д Йорг Хаус: Оптическая микроскопия . Wiley-VCH, Weinheim 2014, ISBN 978-3-527-41127-6 , стр. 189-200 .
- ↑ Гай Кокс: Методы оптической визуализации в клеточной биологии . Второе издание: CRC Press, Taylor & Francis Group, Бока-Ратон, Флорида, США, 2012 г., ISBN 978-1-4398-4825-8 , стр. 63 ff .
- ↑ Гай Кокс: Методы оптической визуализации в клеточной биологии . Второе издание: CRC Press, Taylor & Francis Group, Бока-Ратон, Флорида, США, 2012 г., ISBN 978-1-4398-4825-8 , стр. 109 ff .
- ↑ Гай Кокс: Методы оптической визуализации в клеточной биологии . Второе издание: CRC Press, Taylor & Francis Group, Бока-Ратон, Флорида, США, 2012 г., ISBN 978-1-4398-4825-8 , стр. 223 ff .
- ↑ Харальд Борнфлет, Курт Зацлер, Роланд Эйлс, Кристоф Кремер: Высокоточные измерения расстояний и сегментация объектов с сохранением объема вблизи и ниже предела разрешения в трехмерной конфокальной флуоресцентной микроскопии . В: Журнал микроскопии . Лента 189 , нет. 2 , февраль 1998 г., стр. 118 , DOI : 10.1046 / j.1365-2818.1998.00276.x .
- ↑ Штеффен Дитцель, Роланд Эйлс, Курт Зетцлер, Харальд Борнфлет, Анна Яух, Кристоф Кремер, Томас Кремер: свидетельства против замкнутой структуры неактивной территории Х-хромосомы человека . В: Экспериментальные исследования клеток . Лента 240 , нет. 2 , май 1998 г., стр. 187 , DOI : 10.1006 / excr.1998.3934 , PMID 9596991 .
- ↑ Анонимный: Метод года 2008. В: Методы природы . 6, 2009 г., стр. 1, DOI: 10.1038 / nmeth.f.244 .
- ↑ Фолькер Вестфаль, Сильвио О. Риццоли, Марсель А. Лаутербах, Дирк Камин, Рейнхард Ян, Стефан В. Хелл : Оптическая наноскопия с видеоизображением в дальнем поле рассекает движение синаптических пузырьков . В кн . : Наука . Лента 320 , нет. 5873 , 11 апреля 2008 г., стр. 246-249 , DOI : 10.1126 / science.1154228 .
- ↑ Гай Кокс: Методы оптической визуализации в клеточной биологии . Второе издание: CRC Press, Taylor & Francis Group, Бока-Ратон, Флорида, США, 2012 г., ISBN 978-1-4398-4825-8 , стр. 245-247 .
- ↑ Гай Кокс: Методы оптической визуализации в клеточной биологии . Второе издание: CRC Press, Taylor & Francis Group, Бока-Ратон, Флорида, США, 2012 г., ISBN 978-1-4398-4825-8 , стр. 207 ff .
- ↑ Дуглас Б. Мерфи, Майкл В. Дэвидсон: Основы световой микроскопии и электронной визуализации . Второе издание. Wiley-Blackwell, Hoboken, NJ, USA 2013, ISBN 978-0-471-69214-0 , стр. 280 ff .
- ↑ a b Гай Кокс: Методы оптической визуализации в клеточной биологии . Второе издание: CRC Press, Taylor & Francis Group, Бока-Ратон, Флорида, США, 2012 г., ISBN 978-1-4398-4825-8 , стр. 213 ff .
- ↑ a b Гай Кокс: Методы оптической визуализации в клеточной биологии . Второе издание: CRC Press, Taylor & Francis Group, Бока-Ратон, Флорида, США, 2012 г., ISBN 978-1-4398-4825-8 , стр. 201 ff .
- ↑ б с д е е г ч я J K L Дитер Герлах: История микроскопии . Verlag Harri Deutsch, Франкфурт-на-Майне 2009, ISBN 978-3-8171-1781-9 , стр. 625-657 .
- ↑ а б в Оскар Хеймштадт: Флуоресцентный микроскоп . В: Журнал научной микроскопии . Лента 28 , 1911, стр. 330-337 ( онлайн ).
- ↑ а б в Фриц Бройтигам, Альфред Грабнер: Fluoreszenzmikoskopie . В: Фриц Бройтигам, Альфред Грабнер (ред.): Вклад в флуоресцентную микроскопию (= 1-й специальный том журнала «Микроскопия» ). Verlag Georg Fromme & Co., Вена, 1949, стр. 25-34 .
- ↑ Михаил Цветт: О флуоресцентном микроскопе Райхерта и некоторых наблюдениях, сделанных с его помощью о хлорофилле и цианофилле. В: Отчеты Немецкого ботанического общества . Том 29, 1911, стр. 744-746. ( онлайн - цитата из Герлах, 2009.)
- ^ Станислав фон Prowazek: Флуоресценция клеток. - Люминесцентный микроскоп Reicherts. В: Zoologischer Anzeiger . Том 42, 1913 г., стр. 374-380. ( онлайн - цитата из Герлах, 2009.)
- ↑ a b c d Макс Хайтингер: Флуоресцентная микроскопия - ваше приложение в гистологии и химии . Academic Publishing Company, Лейпциг, 1938 г.
- ^ Карл Хёфлер : Макс Хайтингер 1868-1946 . В: Хьюго Фройнд, Александр Берг (ред.): Прикладные естественные науки и технологии (= история микроскопии, жизни и деятельности великих исследователей . Том III ). Umschau Verlag, Франкфурт-на-Майне, 1966, стр. 187–194 .
- ^ Альберт Х. Кунс, Хью Дж. Крич, Р. Норман Джонс, Эрнст Берлинер: Демонстрация пневмококкового антигена в тканях с помощью флуоресцентных антител . В: J. Immunol . Лента 45 , нет. 3 , 1 ноября 1942 г., стр. 159-170 ( онлайн ).
- ↑ JL Riggs, RJ Seiwald, JH Burckhalter, CM Downs, TG Metcalf: Изотиоцианатные соединения как флуоресцентные маркирующие агенты для иммунной сыворотки. В: Американский журнал патологии . Том 34, номер 6, ноябрь-декабрь 1958 г., стр. 1081-1097. PMID 13583098 , PMC 1934794 (полный текст).
- ↑ Е.С. Пернер: Методы флуоресцентной микроскопии . В: Хьюго Фройнд (ред.): Основы оптики, инструменты и вспомогательные устройства для микроскопии в технике. Часть 1: Общие инструменты микроскопии в проходящем свете (= руководство по микроскопии в технологии . Том 1 , часть 1). Umschau Verlag, Франкфурт-на-Майне, 1957, стр. 357-431, здесь с. 371 .
- ↑ Хайнц Аппельт: Введение в методы микроскопического исследования . 4-е издание. Академическое издательство Geest & Portig, Лейпциг, 1959, стр. 283 .
- ↑ Брумберг Э.М., Крылова Т.Н.: О флуоресцентных микроскопических непрозрачных . В: Ж. общ. биол. 14, 1953, с. 461.
- ↑ a b Йохан Себастьян Плоэм, Фридрих Вальтер: Многоволновое эпи-освещение в флуоресцентной микроскопии . В: Leica Microsystems (Ред.): Научно-техническая информация CDR . Лента 5 , 2001, с. 1–16 ( онлайн в лаборатории Leica Science Lab).
- ^ HN Southworth: Введение в современную микроскопию . Wykeham Publications LTD, член Taylor & Francis Group, Лондон 1975, ISBN 0-85109-470-8 , стр. 84-85 .
- ↑ В. Баррелс: Техника микроскопа. Всеобъемлющее руководство по общей и прикладной микроскопии . Новое исправленное издание Fountain Press, Лондон 1977, ISBN 0-85242-511-2 , стр. 481-483 .
- ↑ Майкл Спенсер: Основы световой микроскопии (= IUPAB Biophysics Series . Volume 6 ). Издательство Кембриджского университета, Кембридж, Англия, 1982, ISBN 0-521-28967-X , стр. 40-45 .
- ↑ Дитер Герлах: Световой микроскоп. Введение в функции и применение в биологии и медицине . 2-е издание. Thieme Verlag, Штутгарт 1985, ISBN 3-13-530302-0 , стр. 210-224 .
- ↑ Герхард Гёке: Современные методы световой микроскопии: от светлого поля в проходящем свете до лазерного микроскопа . Franckh'sche Verlagshandlung, Штутгарт 1988, ISBN 3-440-05765-8 , стр. 211-212 .