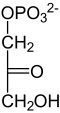
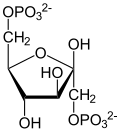
Глюконеогенез
| Родитель |
| Метаболизм глюкозы |
| Генная онтология |
|---|
| QuickGO |
Глюконеогенез ( latinisierte случая глюконеогенеза , А сложное слово от древнего греческого γλυκύς glykys «сладкого», νέος Neos «новый» и γένεσις генеза «поколение») является образование D - глюкозы органических предшественников неуглеводного, такими как пирувато , оксалоацетат и дигидроксиацетонфосфат . Метаболический путь можно найти во всех живых существах. У людей и позвоночных исходными веществами являются аминокислоты , полученные при расщеплении белков . Растения , грибы , большинство бактерий и некоторые беспозвоночные могут использовать цикл глиоксилата для производства глюкозы из ацетил-КоА и, следовательно, из жирных кислот .
Потребность в глюконеогенезе у человека
Суточная потребность взрослого человека в глюкозе составляет около 200 г в состоянии покоя, 75% которой используется мозгом, а значительная часть остального - эритроцитами . Количество гликогена, хранящегося в организме, составляет от 400 до 450 г. Примерно две трети этого количества хранится в мышцах и примерно одна треть - в печени. Количество глюкозы, доступное в крови, составляет около 5 ммоль / л, что соответствует примерно 900 мг / л или 90 мг / дл.
В эритроцитах людей и млекопитающих не имеют митохондрий , и поэтому полностью зависит от поставок глюкозы для получения энергии, который они сломать вниз с помощью гликолиза и последующего кислотного молочнокислого брожения . Мозг удовлетворяет свою огромную потребность в быстро доступной энергии в основном за счет расщепления глюкозы. Это основная причина, по которой синтез глюкозы начинается даже во время относительно коротких периодов голода, что происходит в основном в печени и коре почек и в меньшей степени в головном мозге, скелетных и сердечных мышцах. Из-за накопления глюкозы в процессе глюконеогенеза концентрация глюкозы никогда не опускается ниже 3,5 ммоль / л (около 600 мг / л, 60 мг / дл). В день может образовываться от 180 до 200 г глюкозы.
Ход глюконеогенеза
Сотовая локализация
Курс глюконеогенеза в эукариот распределяется более трех отсеков в клетке . Большинство находится в цитозоле . Один этап реакции происходит в митохондрии , другой - в гладком эндоплазматическом ретикулуме (SER от англ. Smooth endoplasmic reticulum ), поскольку необходимый для каждого фермента ( пируваткарбоксилаза и глюкозо-6-фосфатаза ) присутствует только здесь.
Этапы реакции
Исходные материалы для глюконеогенеза являются либо (1) пируват или оксалоацетат в качестве продуктов аминокислоты пробоя и ферментация молочной кислоты (из лактата ), (2) пирувато образуются анаэробно в мышцах ( Cori цикл ), (3) дигидроксиацетонфосфат как производные от глицерина от распада жиров или ( 4) Пропионат , который остается после последней стадии β-окисления при расщеплении жирных кислот с нечетным номером . Он превращается пропионил-КоА-карбоксилазой и рацемазой (метилмалонил-КоА-эпимеразой) в сукцинил-КоА , из которого образуется оксалоацетат в ходе цикла лимонной кислоты.
Структура глюкозы из L- лактата показана ниже:
 |
НАД + НАДН + Н + лактат дегидрогеназы  |
 |
HCO 3 - АТФ АДФ + Р я пируват карбоксилаза |
 |
GTP GDP + CO 2 PEPCK |
 |
|
| L- лактат | Пируват | Оксалоацетат | Фосфоенолпируват |
 |
+ H 2 O енолаза  |
 |
Фосфо глицерат мутазы 
|
 |
АТФ АДФ фосфо глицерат киназы |

|
| Фосфоенолпируват | D - 2-фосфоглицерат | D - 3-фосфоглицерат | D -1,3-бисфосфоглицерат |
 |
H 2 O P i фруктозо-1,6-бисфосфатаза |
 |
Глюкозо-6-фосфат изомераза |
 |
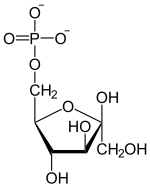
H 2 O P i глюкозо-6-фосфатаза |

|
| β- D - фруктозо-1,6-бисфосфат | β- D - фруктозо-6-фосфат | α- D - глюкозо-6-фосфат | α- D - глюкоза |
Глюконеогенез только частично соответствует обратной реакции от гликолиза . В гликолизе, однако, есть три реакции, в которых химическое равновесие почти исключительно на стороне продуктов реакции. Эти шаги, все катализируемые киназами , следующие:
- превращение глюкозы в глюкозо-6-фосфат,
- от фруктозо-6-фосфата до фруктозо-1,6-бисфосфата и
- реакция фосфоенолпирувата (PEP) на пируват.
Чтобы обратить эти реакции вспять, клетка должна быть способна создавать экстремальные концентрации. Следовательно, эти три стадии гликолиза де-факто необратимы и их обходят в обратном порядке при глюконеогенезе следующим образом:
- карбоксилирование пирувата до оксалоацетата с использованием АТФ ( пируваткарбоксилазы ) и последующее фосфорилирующее декарбоксилирование оксалоацетата до PEP с использованием GTP (фосфоенолпируваткарбоксилазы);
- фруктозо-1,6-бифосфатазы катализирует реакцию фруктоза-1,6-бисфосфат до фруктозо-6-фосфат;
- Глюкозо-6-фосфат превращается в глюкозу глюкозо-6-фосфатазой (при гликолизе гексокиназа или глюкокиназа (гексокиназа IV) катализирует обратную реакцию ).
Другие процессы превращения находятся в равновесии, поэтому они также играют роль в глюконеогенезе.
Еще одно важное отличие от гликолиза - это место реакции. Хотя это происходит исключительно в цитозоле , глюконеогенез распределяется по трем отсекам . Превращение пирувата в оксалоацетат происходит в просвете митохондрии . Однако оксалоацетат не может свободно проходить через внутреннюю мембрану митохондрии и сначала должен быть преобразован. Это можно сделать двумя способами. Либо оксалоацетат митохондрий превращается в PEP митохондриальной PEP карбоксикиназой. Затем PEP покидает митохондрии через специальную систему анионного челнока. В цитоплазме PEP превращается в глюкозу в результате глюконеогенеза.
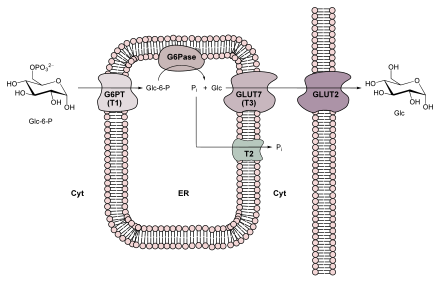
Если вы голодны, выбирают второй маршрут для транспорта. В печени , L - аланин дезаминируется до пирувата и , таким образом , служит в качестве источника оксалоацетата. Когда вы голодны, количество восстановителя в форме НАДН мало в цитозоле и велико в митохондриях. Однако NADH необходим в цитозоле для глюконеогенеза. Так называемая челночная система малат-аспартат используется для транспортировки НАДН и оксалоацетата из митохондрии в цитозоль . Оксалоацетат, образующийся в митохондриях, восстанавливается до L - малата митохондриальной малатдегидрогеназой и затем может перемещаться через внутреннюю мембрану. В дополнение к челноку малат-аспартат для транспорта также доступен митохондриальный дикарбоксилатный переносчик . В цитозоле цитозольная малатдегидрогеназа окисляет малат до оксалоацетата, в результате чего НАД + восстанавливается до НАДН и используется в глюконеогенезе.
Последняя стадия реакции глюконеогенеза происходит не в цитозоле, а в просвете эндоплазматического ретикулума ( ЭПР ). Транспорт в ER и гидролиз глюкозо-6-фосфата осуществляется глюкозо-специфическим мембранно-ферментным комплексом, состоящим из глюкозо-6-фосфаттранслоказы и глюкозо-6-фосфатазы (см. Также рисунок справа).
Пируват карбоксилаза
Пируваткарбоксилаза активна только со своей простетической группой: биотином . Биотин действует как мобильный переносчик активированного диоксида углерода . Биотин связан с ε-аминогруппой определенного остатка лизина через его карбоксильную группу . Это создает гибкую руку, которая позволяет группе биотина «качаться» от одного активного центра ко второму. Карбоксилирование происходит в два этапа:
Первая частичная реакция зависит от присутствия ацетил-КоА, без этого карбоксилирование биотина невозможно. Это регулирование является формой аллостерии , поскольку высокий уровень ацетил-КоА является признаком большей потребности в оксалоацетате в цикле лимонной кислоты. Ацетил-КоА - мощный и единственный эффектор фермента. Оксалоацетат может быть использован для глюкогенеза или включен в цикл лимонной кислоты . Катализируемая реакция пируваткарбоксилазы является примером анаплеротической реакции . Если есть избыток АТФ, оксалоацетат расходуется в глюконеогенезе, что означает, что он не обогащается. Вторая стадия реакции пируваткарбоксилазы не зависит от ацетил-КоА.
Сравнение глюконеогенеза и гликолиза
Энергетический баланс по сравнению с обращением гликолиза
Для биосинтеза одной молекулы глюкозы, начиная с пирувата, необходимы четыре молекулы АТФ и по две молекулы ГТФ и НАДН.
Баланс, показанный ниже, дает понять, что верхняя реакция будет иметь место предпочтительно, поскольку прямое обращение гликолиза представляет собой термодинамически неблагоприятную реакцию:
Это означает, что требуется шесть эквивалентов АТФ (2 ГТФ + 4 АТФ) для того, чтобы мог произойти глюконеогенез для образования одной молекулы глюкозы.
Глюконеогенез и гликолиз - взаимная регуляция
Глюконеогенез и гликолиз разделяют несколько ферментативных реакций, но представляют собой два полностью противоположных метаболических пути. Следовательно, необходимо регулирование. Проходит в двух местах:
- в реакциях пирувата на ПЭП и
- в превращении фруктозо-1,6-бисфосфата во фруктозо-6-фосфат.
Первая реакция: превращение ПЭП в пируват, происходящее при гликолизе, катализируется пируваткиназой . Активность этого фермента увеличивается на фруктозо-1,6-бисфосфат и ингибируется АТФ и аланина. Ферменты глюконеогенеза (пируваткарбоксилаза и PEP-карбоксикиназа) активируются ацетил-КоА и ингибируются АДФ. Поскольку АТФ превращается в АДФ посредством гидролиза , этот тип регулирования двух противоположных реакций можно назвать реципрокной регуляцией. Другой пример - реакция, указанная в пункте 2. Фосфофруктокиназа, участвующая в гликолизе, стимулируется фруктозо-2,6-бисфосфатом и аденозинмонофосфатом (АМФ), но также ингибируется цитратом . В свою очередь, происходит регулирование фруктозо-1,6-бисфосфатазы, участвующей в глюконеогенезе (активируемой цитратом и ингибируемой фруктозо-2,6-бисфосфатом и АМФ).
литература
- Джеффри Зубай: биохимия. 4-е издание. Mcgraw-Hill Professional, 1999, ISBN 3-89028-701-8 .
- Дональд Воет, Джудит Г. Воет: Биохимия . Wiley-VCH, 1994, ISBN 3-527-29249-7 .
- Джереми М. Берг, Джон Л. Тимочко, Люберт Страйер: Биохимия. 6-е издание. Spectrum Akademischer Verlag, Гейдельберг 2007, ISBN 978-3-8274-1800-5 .
- Х. Роберт Хортон, Лоуренс А. Моран, К. Грей Скримджер, Марк Д. Перри, Дж. Дэвид Рон, Карстен Биле (переводчик): Biochemie . 4-е обновленное издание. Исследования Пирсона, 2008, ISBN 978-3-8273-7312-0 .
- Реджинальд Гаррет, Чарльз М. Гришем: Биохимия . (Международное студенческое издание). 4-е издание. Услуги обучения Cengage, 2009, ISBN 978-0-495-11464-2 .
- Дэвид Л. Нельсон, Майкл М. Кокс, Альберт Л. Ленингер (первый): Lehninger Biochemie . 4-й, полностью переработанный u. опыт Издание. Springer, Берлин, 2009 г., ISBN 978-3-540-68637-8 .
веб ссылки
Индивидуальные доказательства
- ↑ Герд П. Пушель, Хартмут Кюн, Томас Кицманн, Вольфганг Хёне, Бруно Христос: Карманный учебник по биохимии . 1-е издание. Георг Тиме Верлаг, 2018, ISBN 9783132429031 , стр. 252.
- ^ BH Робинсон: Транспорт фосфоенолпирувата с помощью системы транспорта трикарбоксилата в митохондриях млекопитающих. В: FEBS Lett . 14 (5), 1971, стр. 309-312. PMID 11945784 .
- ↑ С. Джитрапакди, М. Сент-Морис и др.: Структура, механизм и регуляция пируваткарбоксилазы. В: Biochem J . 413 (3), 2008, стр. 369-387. PMID 18613815 ; DOI: 10.1042 / BJ20080709 .
- ^ Х. Роберт Хортон, Лоуренс А. Моран, К. Грей Скримджер, Марк Д. Перри, Дж. Дэвид Рон, Карстен Биле (переводчик): Biochemie. 4-е обновленное издание. Pearson Studium, 2008, ISBN 978-3-8273-7312-0 , стр. 483.
- ↑ Джереми М. Берг, Джон Л. Тимочко, Луберт Страйер: Биохимия. 6 издание. Spektrum Akademischer Verlag, Гейдельберг 2007, ISBN 978-3-8274-1800-5 , стр. 518.