Bauchspeicheldrüse
Die Bauchspeicheldrüse – in der medizinischen Fachsprache: das Pankreas (griech.: πάγκρεας, pánkreas, pán für „alles“, kréas für „Fleisch“) – ist ein quer im Oberbauch liegendes Drüsenorgan der Wirbeltiere. Die von ihr gebildeten Verdauungsenzyme werden in den Zwölffingerdarm abgegeben. Sie ist daher eine exokrine Drüse (exokrin „nach außen abgebend“; in diesem Falle in den Verdauungstrakt). Diese Enzyme spalten Eiweiße, Kohlenhydrate und Fette der Nahrung im Darm in eine von der Darmschleimhaut aufnehmbare Form. Darüber hinaus werden in der Bauchspeicheldrüse Hormone gebildet, die direkt in das Blut überführt werden. Damit ist sie gleichzeitig auch eine endokrine Drüse (endokrin „nach innen abgebend“). Dieser endokrine Anteil der Bauchspeicheldrüse sind die Langerhans-Inseln, die vor allem für die Regulation des Blutzuckerspiegels (über die Hormone Insulin und Glucagon) sowie von Verdauungsprozessen verantwortlich sind.
Eine Entzündung der Bauchspeicheldrüse (Pankreatitis) führt durch die freiwerdenden Verdauungsenzyme zu einer Selbstverdauung des Organs. Bei einer nachlassenden Bildung der Verdauungsenzyme (exokrine Pankreasinsuffizienz) kann die Nahrung nicht mehr ausreichend aufgeschlossen werden. Die häufigste Störung des endokrinen Anteils ist die Zuckerkrankheit (Diabetes mellitus).

Anatomie beim Menschen
Lage und Gliederung
Die Bauchspeicheldrüse des Menschen ist ein etwa 16–20 cm langes, 3–4 cm breites und 1–2 cm dickes keilförmiges Organ. Ihr Gewicht beträgt zwischen 40 und 120 g. Das Organ ist in Läppchen gegliedert, welche auch die Oberfläche charakteristisch strukturieren. [1]
Die Bauchspeicheldrüse liegt im Retroperitonealraum, also hinter dem Bauchfell, zwischen Magen, Zwölffingerdarm, Milz, Leber und den großen Blutgefäßen des Bauchraums (Aorta und untere Hohlvene). Sie ist kaum atemverschieblich, d. h. im Gegensatz zu anderen Organen der Bauchhöhle wie der Leber verändert sich ihre Position bei der Ein- und Ausatmung nur wenig.

Makroskopisch (mit bloßem Auge) unterscheidet man drei Abschnitte der Bauchspeicheldrüse: den Pankreaskopf (Caput pancreatis), den Pankreaskörper (Corpus pancreatis) und den Pankreasschwanz (Cauda pancreatis). Der Pankreaskopf wird vom Zwölffingerdarm umfasst und trägt einen nach unten gerichteten Hakenfortsatz (Processus uncinatus). An der Pankreaseinkerbung (Incisura pancreatis) geht der Kopf nach links in den Pankreaskörper über. An dieser Einkerbung verlaufen auch die Arteria mesenterica superior und die Vena mesenterica superior. Der Pankreaskörper quert horizontal verlaufend auf Höhe des ersten bis zweiten Lendenwirbels die Wirbelsäule. Dort wölbt sich das Organ leicht nach innen in den Netzbeutel, was als Netzhöcker (Tuber omentale) bezeichnet wird. Schließlich läuft der im Querschnitt dreieckige Pankreaskörper ohne deutliche Grenze in den Pankreasschwanz aus, der sich bis zum Gefäßpol der Milz erstreckt.[2]
Der etwa zwei Millimeter weite Ausführungsgang der Bauchspeicheldrüse (Ductus pancreaticus, Wirsung-Gang) mündet gemeinsam mit dem Hauptgallengang (Ductus choledochus) oder nahe diesem in den Zwölffingerdarm. Diese Mündung stellt eine warzenförmige Erhebung dar (Papilla duodeni major oder Vatersche Papille). Bei manchen Individuen ist ein zweiter, kleiner Ausführungsgang vorhanden, der Ductus pancreaticus accessorius (Santorini-Gang), der dann auf der kleinen Zwölffingerdarmwarze (Papilla duodeni minor) in den Zwölffingerdarm mündet.[2]
Feinbau

Das Pankreas ist gleichzeitig exokrine und endokrine Drüse. Als exokrine Drüse produziert sie Verdauungsenzyme, als endokrine Drüse Hormone (siehe auch Abschnitt Funktion).

Der exokrine Anteil besteht aus mehreren Tausend locker zusammengefügten Läppchen mit einem Durchmesser von etwa drei Millimetern. Ein solches Läppchen enthält mehrere, von sekretproduzierenden Zellen umgebene Drüsengänge (Azini). Die von diesen Drüsenzellen gebildeten Verdauungsenzyme werden ohne Verlust von Zellbestandteilen (merokrine Sekretion) in Form eines wässrigen (serösen) Sekrets freigesetzt und über die Azini weitergeleitet und teilweise auch gespeichert. Die Azini werden von einer Basalmembran umgeben, die durch ein feines Netz von retikulären Fasern gestützt wird. Etwa drei bis fünf Azini sind zu einem Komplex oder „Drüsenbäumchen“ verschaltet und münden über sogenannte Schaltstücke in einen gemeinsamen Gang. Die Zellen dieser Schaltstücke werden als zentroazinäre Zellen bezeichnet. Die Ausführungsgänge vereinen sich und werden letztendlich zu den Hauptausführungsgängen. Im exokrinen Anteil der Bauchspeicheldrüse liegen zwischen den Azini auch Zellen, die als Pankreassternzellen bezeichnet werden. Sie spielen vor allem bei Reparaturvorgängen eine Rolle.[3]
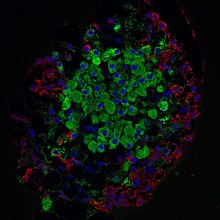
Fluoreszenzmikroskopie:
Grün – Betazellen
Rot – Alphazellen
Blau – Zellkerne
Der endokrine Anteil sind die Langerhans-Inseln (Insulae pancreaticae), die 1869 von Paul Langerhans entdeckt wurden. Es handelt sich um Anhäufungen von endokrinen Epithelzellen, die sich vorwiegend in Bauchspeicheldrüsenkörper und -schwanz befinden. Sie geben die von ihnen produzierten Hormone direkt in das Blut ab. Die Langerhans-Inseln machen ein bis zwei Prozent der Masse der Bauchspeicheldrüse aus. Abhängig vom produzierten Hormon unterscheidet man:[4]
- α-Zellen produzieren Glucagon (etwa 30 % der Inselzellen)
- β-Zellen produzieren Insulin und Amylin (etwa 60 % der Inselzellen)
- δ-Zellen produzieren Somatostatin (etwa 5 % der Inselzellen)
- PP-Zellen produzieren pankreatisches Polypeptid (weniger als 5 % der Inselzellen)
- ε-Zellen produzieren Ghrelin
Mittels immunhistochemischer Methoden kann die Lokalisation der Zelltypen innerhalb einer Langerhans-Insel festgestellt werden, die beim Menschen kein bestimmtes Muster erkennen lässt.[4]
Die Bauchspeicheldrüse als Ganzes wird von einer dünnen Kapsel aus Bindegewebe umgeben, die Septen (Scheidewände) nach innen sendet. Diese Septen trennen die einzelnen Drüsenläppchen voneinander. Außerdem wird das Organ von einem dichten Kapillarnetz durchzogen, das eine gute Blutversorgung sicherstellt und damit die Sekretionstätigkeit erst ermöglicht.[3]
Blutversorgung und Lymphabfluss

Die Versorgung der Bauchspeicheldrüse erfolgt über drei größere Gefäße: Die obere Bauchspeicheldrüsen-Zwölffingerdarmarterie (Arteria pancreaticoduodenalis superior), die große Bauchspeicheldrüsenarterie (Arteria pancreatica magna) und die untere Bauchspeicheldrüsen-Zwölffingerdarmarterie (Arteria pancreaticoduodenalis inferior) verzweigen sich in weitere kleinere Arterien, die zum Teil miteinander in Verbindung treten (anastomosieren).[5]
Das venöse Blut aus Körper und Schwanz der Bauchspeicheldrüse wird von kleinen Bauchspeicheldrüsenvenen (Venae pancreaticae) über die Milzvene (Vena splenica) in die Pfortader (Vena portae) geleitet. Das Blut aus dem Kopf der Bauchspeicheldrüse gelangt über die Bauchspeicheldrüsen-Zwölffingerdarm-Vene (Vena pancreaticoduodenalis) in die obere Gekrösevene (Vena mesenterica superior) und dann ebenfalls in die Pfortader.[6]
Die Lymphgefäße der Bauchspeicheldrüse ziehen in die Nodi lymphoidei (Nll.) pancreatici sowie die Nll. pancreaticoduodenales superiores et inferiores. Diese liegen dicht an der Bauchspeicheldrüse und leiten die Lymphe in den Truncus intestinalis weiter.[7]
Innervation
Die Bauchspeicheldrüse wird, wie fast alle inneren Organe, durch beide Anteile des vegetativen Nervensystems (Sympathikus und Parasympathikus) versorgt. Die parasympathische Versorgung erfolgt durch den Nervus vagus. Über den M3-Rezeptor werden α- und β-Zellen stimuliert.[8] Sympathische Fasern erreichen über den Nervus splanchnicus major das Ganglion coeliacum, wo sie auf das zweite sympathische Neuron umgeschaltet werden, welches dann in die Bauchspeicheldrüse zieht.[9] Über α2-Adrenozeptoren wird die Sekretion der β- und δ-Zellen gesenkt und die der α-Zellen gesteigert. Über β2-Adrenozeptoren wird die Sekretion der β- und δ-Zellen gesteigert.[10]
Anatomie bei Tieren
Zellen, die Bauchspeicheldrüsenhormone und solche, die Verdauungsenzyme produzieren, sind bei einer Vielzahl von Wirbellosen nachgewiesen. Als eigenständiges Organ treten sie aber erst bei den Wirbeltieren auf. Bei der Schwarzbäuchigen Taufliege werden beispielsweise Insulin-ähnliche Peptide noch im Gehirn, Glucagon-ähnliche in den Corpora cardiaca (einem Neurohämalorgan) gebildet. Doch auch bei den Wirbeltieren gibt es strukturelle Differenzen, die durch unterschiedliche Lebensweise und Nahrung sowie Stoffwechselbesonderheiten bedingt sind.[11]
Bei den Manteltieren und Lanzettfischchen ist noch keine Bauchspeicheldrüse ausgebildet. Hier gibt es lediglich spezialisierte Zellen im Darmepithel, welche die entsprechenden Hormone bilden. Bei Rundmäulern sind endo- und exokriner Anteil getrennt: Während die Verdauungsenzyme herstellenden Zellen in die Darmschleimhaut eingestreut sind, bei Schleimaalen auch in die Leber, bilden die hormonproduzierenden Zellen ein separates Inselorgan an der Mündung des Gallengangs in den Darm.[12] Das Inselorgan der Schleimaale und Neunaugen besteht aus β- und wenigen δ-Zellen, α-Zellen sind dagegen in der Darmschleimhaut lokalisiert.[13] Knochenfische besitzen eine exokrine Bauchspeicheldrüse, während das endokrine Gewebe oft in davon unabhängigen Strukturen zusammengelagert ist. Diese auch als Brockmann-Körper bezeichneten Inselorgane entstehen aus der dorsalen Pankreas-Anlage und liegen im angrenzenden Mesenterium. Bei einigen Arten ist ein einzelner großer Brockmann-Körper (z. B. Grundeln), bei manchen sind mehrere Brockmann-Körper, bei anderen zusätzliches zerstreutes Inselzellgewebe ausgebildet. PP-Zellen sind bei den Knochenfischen im Regelfall noch nicht im Inselorgan lokalisiert. Bei einigen Fischarten ist das exokrine Pankreasgewebe in der Leber lokalisiert (Hepatopankreas). Knorpelfische besitzen eine endokrin-exokrine Bauchspeicheldrüse, bei den meisten Vertretern mit allen vier Hauptzelltypen (α, β, δ, PP), bei den Seekatzen bleiben die δ-Zellen jedoch im Darm angesiedelt.[12][14] Trotz des Vorhandenseins eines Inselorgans bleiben bei den Knorpelfischen weiterhin viele α-, δ- und PP-Zellen auch im Darm lokalisiert.[11]
Bei Amphibien, Reptilien, Vögeln und Säugetieren zeigt die Bauchspeicheldrüse prinzipiell denselben Aufbau.[12]
Schwanzlurche haben entweder diffus verteiltes oder in Inseln zusammengelagertes endokrines Gewebe, bei einigen Arten fehlen α-Zellen.[14] Das Inselorgan der Froschlurche besitzt alle vier Hauptzelltypen und ähnelt dem der Säuger, allerdings gibt es Unterschiede in den Zellanteilen: α-, β- und PP-Zellen sind etwa in gleicher Menge vorhanden, hinzu kommen einige δ-Zellen. Bei Krallenfröschen scheinen erstmals auch Ghrelin produzierende ε-Zellen aufzutreten. Auch bei Reptilien gibt es beträchtliche Unterschiede in der Zellzusammensetzung. Bei Krokodilen machen β-Zellen etwa die Hälfte der Inselorganzellen aus, während bei Echsen vier- bis fünfmal mehr Glucagon-produzierende Zellen als Insulin-produzierende auftreten. Bei der Zierschildkröte bestehen die Langerhans-Inseln nur aus α- und β-Zellen, während PP- und δ-Zellen in den exokrinen Anteil eingestreut sind. ε-Zellen sind bei Reptilien bislang nur bei wenigen Arten wie der Rotwangen-Schmuckschildkröte nachgewiesen.[11] Bei einigen Schlangen bilden die Inselzellen eine Scheide um die Ausführungsgänge des exokrinen Anteils,[14] PP-Zellen sind im Inselorgan bislang nicht nachgewiesen.[11] Bei Vögeln ist die Bauchspeicheldrüse aus vielen kleinen Läppchen aufgebaut, die zwischen den beiden Schenkeln des Zwölffingerdarms liegen.[15] Bei Vögeln gibt es neben gemischten auch Inseln, in denen nahezu ausschließlich α- beziehungsweise β-Zellen auftreten. Die Zahl der α-Zellen scheint bei Vögeln generell gegenüber der der anderen Zelltypen zu überwiegen. Ghrelin wurde beim Haushuhn nachgewiesen, bei anderen Spezies ist dies nicht untersucht.[11]

Bei den Säugetieren ist der Aufbau der Bauchspeicheldrüse prinzipiell ähnlich, in den Langerhans-Inseln sind alle fünf Zelltypen ausgebildet. In der Veterinäranatomie gliedert man die Bauchspeicheldrüse makroskopisch in einen Körper (Corpus pancreatis), einen rechten, dem Zwölffingerdarm anliegenden Lappen (Lobus pancreatis dexter, „Duodenalschenkel“) und einen der Eingeweidefläche des Magens anliegenden und bis zur Milz reichenden linken Lappen (Lobus pancreatis sinister, „Milzschenkel“). Bei Pferden und Schweinen umschließt der Pankreaskörper ringförmig die Pfortader (Anulus pancreatis).[16] Beim Nilflughund machen die Langerhans-Inseln fast neun Prozent der Organmasse aus, was mehr als doppelt so viel ist wie bei anderen Säugetieren.[11]
Aufgrund seiner Herkunft aus einer paarigen und einer unpaarigen Organanlage (siehe Abschnitt Entwicklung) besitzt das Pankreas je nach Spezies einen bis drei Ausführungsgänge. Der „zusätzliche Ausführungsgang“ ist bei Schweinen und Rindern der einzige, während Pferde und Hunde stets beide, einige Vögel (z. B. Entenvögel) alle drei ursprünglich angelegten Ausführungsgänge besitzen.[16]
Entwicklung

Beim Embryo entwickelt sich die Bauchspeicheldrüse aus dem inneren Keimblatt (Entoderm). Es entstehen zunächst zwei Epithelknospen im Bereich des Zwölffingerdarms, wobei sich die vordere in der bauchseitigen Darmaufhängung des Zwölffingerdarms (Mesoduodenum ventrale) nahe dem Gallengang, die hintere im rückenseitigen Mesenterium (Mesoduodenum dorsale) bildet. Die Hauptsprosse dieser Knospen werden durch Bildung eines Hohlraums (Kanalisierung) zu den Ausführungsgängen, ihre Verzweigungen zum eigentlichen Drüsengewebe.[17]
Die rückenseitige (dorsale) Pankreasanlage ist die größere und bildet den Hauptteil der späteren Bauchspeicheldrüse. Ihr Ausführungsgang ist der zusätzliche Bauchspeicheldrüsengang (Ductus pancreaticus accessorius). Die kleinere bauchseitige (ventrale) Pankreasanlage ist zunächst paarig. Bei Säugetieren vereinigen sich während der Embryonalentwicklung beide ventralen Sprosse und bilden den Bauchspeicheldrüsengang (Ductus pancreaticus). Bei Vögeln bleiben beide Sprosse der ventralen Anlage dagegen zeitlebens getrennt.[18] Aus der ventralen Pankreasanlage entsteht der Processus uncinatus („Hakenfortsatz“) und der untere Anteil des Kopfes der Bauchspeicheldrüse.[17]
Mit der embryonalen Drehung des Magens um seine Längsachse gelangt die ventrale Anlage über rechts in eine rückenseitige Position. Der ursprüngliche Bauchfellüberzug verschmilzt mit dem der linken Leibeswand. Damit gelangt das zunächst innerhalb der Leibeshöhle gelegene Pankreas sekundär in eine Lage außerhalb des Bauchfells – in den sogenannten Retroperitonealraum. Mit dieser Drehung kommt es auch zur Vereinigung der beiden Hohlraumsysteme und damit beider Anlagen. Dies findet beim Menschen etwa in der 6. bis 7. Schwangerschaftswoche statt.[17] Die zweite Magendrehung bringt die Bauchspeicheldrüse in die Querlage.[18]
Die ursprünglich zwei Hauptausführungsgänge beider Anlagen bleiben nur bei einigen Säugetieren (z. B. Pferde, Hunde) erhalten. Beim Menschen sowie Schafen und Katzen verschließt sich (obliteriert) der direkt in das Darmrohr mündende (proximale) Abschnitt des Ausführungsgangs der dorsalen Anlage, so dass der Ductus pancreaticus zum gemeinsamen Ausführungsgang beider Anlagen wird. Bei Schweinen und Rindern bleibt dagegen nur der Ductus pancreaticus accessorius – also der der rückenseitigen Anlage – erhalten.[16][18]
Die Langerhans-Inseln – also der endokrine Anteil der Bauchspeicheldrüse – entstehen ebenfalls aus Epithelzapfen, die von den Sprossen des exokrinen Anteils ausgehen. Diese „Inselzapfen“ verlieren aber die Verbindung zum Gangsystem und werden durch gefäßreiches Bindegewebe vom exokrinen Anteil abgegrenzt. Für den ersten Schritt der Differenzierung der Vorläuferzellen für die späteren Inselzellen ist eine Aktivierung des Transkriptionsfaktors Neurogenin3 notwendig. Die weitere Differenzierung wird durch den Transkriptionsfaktor Rfx6 (Transcriptional regulatory factor X6) gesteuert. Darüber hinaus sind eine Reihe weiterer Transkriptionsfaktoren (NeuroD1, Pax4, Nkx2.2, Nkx6.1, Arx, MafA, Pax6, Isl1 und andere) an der Zelldifferenzierung und Organogenese der Bauchspeicheldrüse beteiligt.[19]
Evolution
Vergleichende Studien legen nahe, dass sowohl endokriner als auch exokriner Anteil der Bauchspeicheldrüse phylogenetisch endodermal-epithelialen Ursprungs sind, obwohl diese Frage noch nicht abschließend geklärt ist. So lassen sich bei Lanzettfischchen Zellen innerhalb des Mitteldarmepithels nachweisen, die ein Insulin-Vorläufermolekül (Protoproinsulin) bilden und zusammen mit anderen Enzymen in das Darmlumen abgeben. Nach Spaltung im Lumen wird es aus dem Darm in das Blut aufgenommen und entfaltet eine Insulin-ähnliche Wirkung. Darüber hinaus lassen sich bei einigen niederen Wirbeltieren „gemischte“ Zellen nachweisen, die sowohl endo- als auch exokrine Funktionen wahrnehmen.[20]
Vermutlich ist sogar die Insulin-produzierende β-Zelle Ausgangspunkt der phylogenetischen Entstehung des Organs Bauchspeicheldrüse. Das Inselorgan der Rundmäuler besteht nahezu vollständig aus β-Zellen, bei Seekatzen treten α-Zellen dazu, bei Haien dann PP-Zellen – es kommt also zu einer schrittweisen Erweiterung der Organfunktion. Auch die Expression der an der Entstehung der Bauchspeicheldrüse beteiligten Transkriptionsfaktoren scheint diese Theorie der gemeinsamen phylogenetischen Herkunft zu bestätigen.[21]
Funktion
Funktion als exokrine Drüse
Als exokrine Drüse ist die Bauchspeicheldrüse eine rein seröse Drüse und die wichtigste Verdauungsdrüse. Sie produziert beim Menschen täglich bis zu 2 l Sekret,[3] bei Pferden bis zu 35 l. Die Bildung des Verdauungssekrets (auch als Pankreassaft bezeichnet) wird durch Geruch und Geschmack der Nahrung und den Kauvorgang über den Nervus vagus stimuliert. Auch die Dehnung der Magenwand (ebenfalls über den Nervus vagus vermittelt) sowie die Hormone Sekretin und Cholecystokinin steigern Bildung und Abgabe des Pankreassafts.[22]
Das Bauchspeicheldrüsensekret enthält die Vorstufen eiweißspaltender Enzyme (Trypsinogen, Chymotrypsinogen, Procarboxypeptidasen, Proelastase), das stärkespaltende Enzym α-Amylase, Ribo- und Desoxyribonukleasen und zur Fettspaltung dienende Enzyme (Lipasen). Die eiweißspaltenden Enzyme liegen bei der Produktion in der Drüse in einer inaktiven Form vor, um eine Selbstverdauung des Organes zu verhindern. Das Trypsinogen wird erst durch gezielte Abspaltung mittels des Enzyms Enteropeptidase des Bürstensaums der Zwölffingerdarmschleimhaut in Trypsin umgewandelt und damit wirksam. Trypsin wiederum aktiviert die übrigen eiweißspaltenden Enzyme. Die Lipase wird erst durch das Protein Colipase aktiv. Letztere kommt ebenfalls als Vorstufe aus der Bauchspeicheldrüse und wird erst durch Trypsin aktiviert.[3] Hinsichtlich der Enzymzusammensetzung des Pankreassaftes gibt es ernährungsbedingte tierartliche Unterschiede. So bildet die Bauchspeicheldrüse bei Tieren mit geringem Stärkeanteil in der Nahrung, beispielsweise reinen Fleischfressern wie Katzen oder Pflanzenfressern wie Pferde und Wiederkäuer, kaum stärkespaltende Amylase. Bei Monogastriern ändert sich je nach Zusammensetzung der Nahrung nach wenigen Tagen auch das Enzymmuster des Pankreassaftes.[23]
Außer den Enzymen bilden die Epithelzellen der Bauchspeicheldrüsengänge reichlich Hydrogenkarbonat-Ionen (HCO3−), welche den pH-Wert des Pankreassaftes auf 8 erhöhen. Das alkalische Pankreassekret neutralisiert den durch den Magensaft angesäuerten Darminhalt und schafft damit ein optimales Milieu für die Verdauungsenzyme.[3]

Funktion als endokrine Drüse
Neben dieser exokrinen Drüsenfunktion werden vom endokrinen Drüsenanteil, den Langerhans-Inseln, Hormone direkt in das Blut abgegeben. In den α-Zellen wird Glucagon, in den β-Zellen Insulin, in den δ-Zellen Somatostatin, den PP-Zellen das Pankreatische Polypeptid und den ε-Zellen das Ghrelin synthetisiert.
Der Reiz für die Insulinausschüttung ist der Anstieg des Blutzuckers. Weitere Stimulation gibt es über den Parasympathikus und einige Darmhormone (Gastrin, Sekretin, GIP, Cholecystokinin und GLP-1). Durch das Insulin wird der Blutzucker wieder auf ein physiologisches Niveau gesenkt, indem Traubenzucker (Glucose) in Leber, Skelettmuskulatur und Fettgewebe aufgenommen wird. Zudem werden die Glucosespeicherung gefördert und die Glucoseneubildung gehemmt. Bei starkem Blutzucker-Abfall wird aus den α-Zellen Glucagon ausgeschüttet, welches zur Freisetzung von Traubenzucker aus der Leber und damit zu einem Anstieg des Blutzuckers führt.[24]
Somatostatin dient der Hemmung des exokrinen Anteils und der α-Zellen. In hoher Konzentration hemmt es auch die β-Zellen. Die Funktion des pankreatischen Polypeptids ist noch nicht ausreichend geklärt, es hemmt vermutlich den Appetit.[25]
Neben den klassischen fünf Hormonen wird von den Inselzellen ein Vielzahl weiterer Peptide gebildet, wie beispielsweise Cholecystokinin, Calcitonin Gene-Related Peptide, Insulinähnliche Wachstumsfaktoren, Peptid YY, Cocaine and amphetamine regulated transcript und Thyreoliberin, bei Fröschen auch Sekretin.[11]
Erkrankungen
Erkrankungen des exokrinen Anteils

Eine akute Bauchspeicheldrüsenentzündung (Pankreatitis) verursacht starke Schmerzen im Oberbauch („Gummibauch“), Übelkeit, Erbrechen, Verstopfung und Fieber. Die häufigste Ursache für eine akute Pankreatitis beim Menschen sind Gallensteine, für eine chronische ist es der Alkoholmissbrauch. Auch eine traumatisch bedingte Pankreasruptur kann eine Pankreatitis auslösen. Bei einer akuten Pankreatitis oder Pankreasruptur kommt es zur Selbstverdauung des Organs durch freiwerdende Enzyme und dadurch zu einer starken Entzündungsreaktion.[26]
Die ungenügende Bildung von Bauchspeicheldrüsenenzymen bezeichnet man als exokrine Pankreasinsuffizienz. Sie kann durch Verlust von Bauchspeicheldrüsengewebe bei chronischer Pankreatitis oder Bauchspeicheldrüsenkrebs (s. u.) erworben, aber auch durch genetisch bedingte Erkrankungen wie Mukoviszidose angeboren sein. Die exokrine Pankreasinsuffizienz führt zu Verdauungsproblemen mit großvolumigem Fettstuhl und wird durch Verabreichung von Pankreatin mit den Mahlzeiten behandelt.[27]
Pankreaszysten und -pseudozysten, blasenförmige Bildungen in der Bauchspeicheldrüse, können als Entwicklungsstörung, durch Trauma, Entzündung oder Tumoren entstehen. Pankreaszysten verursachen häufig keine Beschwerden. Pseudozysten haben keine Epithelauskleidung und entstehen meist nach einer Pankreatitis durch Gewebseinschmelzung. Sie können mit Entzündungszeichen wie Fieber einhergehen und neigen zu Abszessbildung und anderen Komplikationen.[28]
Pankreastumoren betreffen in 98 % der Fälle den exokrinen Anteil. In der Mehrheit sind es bösartige Adenokarzinome (duktale Adenokarzinome), die wegen ihrer hohen Sterblichkeitsrate gefürchtet sind.[29]
Einige Saugwürmer parasitieren im Gangsystem der Bauchspeicheldrüse. Der Pankreasegel (Eurytrema pancreaticum) tritt vor allem bei Paarhufern in Ostasien und Südamerika auf, kann aber auch den Menschen befallen. Der Waschbären-Pankreasegel (Eurytrema procyonis) kommt in den Vereinigten Staaten von Amerika vor und parasitiert bei Waschbären, selten auch bei Katzen.[30] Lyperosomum intermedium tritt nur in den US-amerikanischen Südstaaten Florida und Georgia auf und befällt Reisratten.[31]
Erkrankungen des endokrinen Anteils
Die häufigste Erkrankung des endokrinen Anteils ist die Zuckerkrankheit (pankreopriver Diabetes mellitus). Beim Diabetes mellitus liegen ein absoluter oder relativer Insulinmangel oder eine abgeschwächte Wirksamkeit des Insulins vor. Die Zuckerkrankheit ist eine weltweit verbreitete Massenerkrankung mit erheblicher volkswirtschaftlicher Bedeutung. Etwa 380 Millionen Menschen (8,3 % der Bevölkerung) leiden an dieser Krankheit,[32] allerdings sind nur etwa fünf bis zehn Prozent der Diabetes-Erkrankungen durch eine Unterfunktion der Langerhans-Inseln bedingt. Auch bei Haushunden und -katzen ist Diabetes mellitus eine der häufigsten endokrinen Erkrankungen.[33]
Bei der erblich bedingten Nesidioblastose ist das Inselzellgewebe vermehrt und die Insulinausschüttung erhöht, was bereits bei Säuglingen zu schwerer Unterzuckerung führt.[34]
Endokrine Tumoren machen nur etwa zwei Prozent der Bauchspeicheldrüsentumoren aus. Hier überwiegen Tumoren der Insulin-produzierenden β-Zellen (Insulinom) und Tumoren, die Gastrin produzieren (Zollinger-Ellison-Syndrom). Eine Häufung endokriner Bauchspeicheldrüsentumoren kommt beim Wermer-Syndrom vor.
Fehlbildungen
Während der Entwicklung des Organs kann es zu verschiedenen Fehlbildungen kommen.
Wird die Bauchspeicheldrüse nicht oder nur unvollständig ausgebildet, spricht man von einer Pankreasagenesie. Während die totale Pankreasagenesie mit schweren Verdauungsstörungen und Zuckerkrankheit beim Neugeborenen einhergeht, bleibt die partielle meist symptomlos, da das vorhandene Gewebe eine ausreichende Synthesekapazität hat.[35]
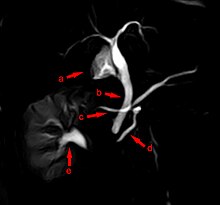
Das Pancreas divisum („geteilte Bauchspeicheldrüse“) beruht auf einer ausbleibenden Verwachsung der beiden Organanlagen. Hier besteht eine Neigung zu einer Verstopfung im Ausführungsgangbereich, da der Abfluss des Pankreassaftes der größeren rückenseitigen Anlage über den kleineren Gang (Ductus pancreaticus accessorius) erfolgt. Beim seltenen Pancreas bifidum („zweigespaltene Bauchspeicheldrüse“) ist der Hauptausführungsgang im Bereich des Schwanzes der Bauchspeicheldrüse wie ein Fischschwanz aufgespalten.[36]
Als Pancreas anulare („ringförmige Bauchspeicheldrüse“) wird eine seltene ringförmige Verwachsung um den Zwölffingerdarm bezeichnet, durch die es zu einer Duodenalstenose (Zwölffingerdarmeinengung) kommen kann. In der Literatur wird als Ursache eine nicht obliterierte (verödete) linke Knospe der ventralen Anlage[37] bzw. eine generell abnormale Entwicklung einer zweigeteilten ventralen Pankreasanlage angegeben.[38] Diese Anlage wächst um das Duodenum herum und verschmilzt mit der dorsalen Anlage. Therapiemöglichkeit ist eine Duodenojejunostomie, eine operative Verbindung des Zwölffingerdarms mit dem Jejunum (Leerdarm), oder eine kurze Überbrückung der eingeengten Stelle innerhalb des Zwölffingerdarms (Duodenum-Duodenum-Anastomose).[35]
Ektopes Gewebe des Pankreas (versprengtes Pankreasgewebe) kann u. a. im Magen, im Dünndarm (vor allem im Meckelschen Divertikel) oder in der Leber vorkommen.[35]
Untersuchungsmethoden
Die Vorgeschichte und der körperliche Untersuchungsbefund ergeben bereits Hinweise auf das Vorliegen einer Pankreaserkrankung.
Zur Erkennung einer Pankreatitis hat sich die laborchemische Bestimmung der Pankreaslipase im Blut bewährt. Alternativ kann die Pankreas-Amylase im Serum bestimmt werden. Sie ist jedoch nicht so spezifisch und sensibel. In der Tiermedizin wird vor allem der PLI-Test angewendet.[39] Zum Nachweis einer exokrinen Pankreasinsuffizienz werden in der Humanmedizin der Sekretin-Pankreozymin-Test[40] oder die Bestimmung der Konzentration der Pankreas-Elastase[41] im Stuhl angewendet, in der Tiermedizin vor allem der TLI-Test.[39]

Zur Einschätzung der Funktion des endokrinen Anteils werden vor allem Blut- und Urinzucker, HbA1c, C-Peptid, Fructosamin und die verbliebene Eigensekretionsrate bestimmt. Autoimmunerkrankungen der Bauchspeicheldrüse können darüber hinaus durch die Bestimmung von Autoantikörpern diagnostiziert werden.[42]
Zur Erkennung von Tumoren der Bauchspeicheldrüse werden bildgebende Verfahren wie Sonografie, Computertomographie, Magnetresonanztomographie sowie ein kombiniertes endoskopisch-radiologisches Verfahren, die sogenannte Endoskopisch retrograde Cholangiopankreatikographie, genutzt.[40] Darüber hinaus kann mittels Bauchhöhleneröffnung (Laparotomie) und -spiegelung (Laparoskopie) das Organ direkt beurteilt werden. Die Flexible Transgastrische Peritoneoskopie ist ein noch im Experimentalstadium befindliches Untersuchungsverfahren. Auch Pankreaspseudozysten, Pankreassteine oder Pankreasverkalkungen können am besten mit den genannten bildgebenden Verfahren erkannt werden. Als brauchbarer Tumormarker hat sich CA 19-9 bewährt.[43]
Pankreastransplantation

Die kombinierte Pankreas- und Nierentransplantation ist die bisher beste Therapie für sorgfältig ausgewählte Patienten mit insulinpflichtigem Typ-I-Diabetes und dialysepflichtigem oder bevorstehendem Nierenversagen.[44] Die Organvermittlung geschieht dabei zentral über Eurotransplant. Dort werden die Daten aller Patienten gespeichert und verfügbare Organe innerhalb Europas nach festgelegten Kriterien vermittelt. Seit der ersten Pankreastransplantation im Jahre 1966 sind weltweit bisher über 7000 Bauchspeicheldrüsen transplantiert worden. Die meisten Operationen, etwa zwei Drittel, fanden in den USA gefolgt von Europa statt. Nur wenige Transplantationen werden in allen übrigen Teilen der Welt durchgeführt. Von den aktuell jährlich etwa 1000 weltweit vorgenommenen Operationen werden im Eurotransplant-Verbund etwa 100 Pankreastransplantationen durchgeführt (Benelux-Länder, Deutschland und Österreich).[45] Die Transplantation von Inselzellen ist derzeit immer noch als experimentelle Therapiemethode anzusehen.
Verwendung

Bauchspeicheldrüsen von Schweinen werden bei der Schlachtung gewonnen und technisch aufbereitet. Als Pankreatin wird dieses Enzymgemisch zur Behandlung der exokrinen Bauchspeicheldrüsenunterfunktion eingesetzt. Pankreatin muss zusammen mit der Mahlzeit aufgenommen werden.[46] Darüber hinaus wird aus Bauchspeicheldrüsen von Rindern und Schweinen auch Insulin für die Insulintherapie gewonnen. Die ersten Insulinpräparate aus Rinderbauchspeicheldrüsen kamen bereits 1923 auf den Markt. Durch die Möglichkeit der Herstellung von rekombinantem Insulin spielt aus dem Organ gewonnenes Insulin in der Diabetesbehandlung beim Menschen allerdings keine Rolle mehr.[47]
Vor allem in Asien wird die Bauchspeicheldrüse von Schweinen auch als Lebensmittel verwendet.[48]
Forschungsgeschichte
Das Pankreas wurde vermutlich erstmals von Herophilos von Chalkedon – auch als „Vater der Anatomie“ betitelt – etwa 300 v. Chr. beschrieben, obwohl er es nicht als solches bezeichnete und viele seiner Schriften nicht mehr existieren. Der Begriff „Pankreas“ existierte bereits zuvor, bereits Hippokrates verwendet das Wort, allerdings war er wohl für Lymphknoten üblich. Es ist unklar, ob es sich bei den von Hippokrates erwähnten „Drüsen im Netz“ um die Bauchspeicheldrüse oder die Mesenteriallymphknoten handelt.[49] Etwa zur gleichen Zeit wie Herophilos soll auch Eudemos von Alexandria eine Drüse, die ein speichelähnliches Sekret in den Dünndarm abgibt, erwähnt haben.[50] Galenos bezieht sich auf Herophilos’ Schriften und die Bauchspeicheldrüse, hielt sie aber für ein Kissen der sie umgebenden Gefäße. Aufgrund der hohen Reputation Galenos’ galt diese Auffassung bis in das 17. Jahrhundert als unumstößliche Tatsache.[51]
Die erste eindeutige Abgrenzung der Bauchspeicheldrüse von den Lymphknoten der Bauchhöhle und die Zuordnung des Begriffes Pankreas zu diesem Organ geht auf den Arzt und Anatomen Rufus von Ephesos zurück, der Ende des ersten Jahrhunderts die erste anatomische Nomenklatur erarbeitete. Dennoch gab es in der Mitte des 2. Jahrtausends erneut begriffliche Unschärfen. So bezeichnete Frederik Ruysch (1638–1731) die von Gaspare Aselli Anfang des 17. Jahrhunderts beschriebenen Mesenteriallymphknoten als „Pancreas Aselli“ und Johann Konrad Brunner die von ihm 1686 erstmals beschriebenen Brunner-Drüsen als „Pancreas secundarium“ („zweite Bauchspeicheldrüse“).[50] Das Organ fand im Mittelalter kaum Beachtung. Jean François Fernel hielt die Bauchspeicheldrüse für den Sitz der Melancholie, Hypochondrie und als Hort für wiederkehrendes Fieber.[52]

Jacopo Berengario da Carpi (1470–1550), der das erste gedruckte Anatomie-Lehrbuch herausgab, beschrieb die Bauchspeicheldrüse als sekretorische Drüse, ohne aber ihren Ausführungsgang zu erwähnen. Die älteste erhaltene Zeichnung der Bauchspeicheldrüse stammt von Bartolomeo Eustachi, dessen anatomische Tafeln aber erst 1714 von Giovanni Maria Lancisi publiziert wurden.[52] In den detailreichen Zeichnungen Leonardo da Vincis ist das Organ nicht dargestellt, vermutlich wurde es bei den Sektionen zuvor mit dem Gekröse entfernt.[53] Andreas Vesalius, der eine Renaissance der Anatomie einleitete, fertigte präzise anatomische Zeichnungen an und beschrieb erstmals die präzise Topografie des Organs. Er hielt die Bauchspeicheldrüse allerdings lediglich für ein Kissen des Magens.[54]
1642 entdeckte Johann Georg Wirsung den Ausführungsgang der Bauchspeicheldrüse,[55] konnte aber seine Funktion nicht deuten.[56] Wirsung fertigte einen Kupferstich der Bauchspeicheldrüse und des Ganges an und schickte Drucke an zahlreiche Anatomen, mit der Bitte um Hilfe bei der Interpretation seiner Funktion. Diese gelangte über Umwege auch an Thomas Bartholin, der in einem Brief an seinen Schwager Ole Worm den Gang als Ausführungsgang eines Pankreassekretes interpretierte[57] und 10 Jahre nach Wirsung eine noch detailreichere Zeichnung von Bauchspeicheldrüse und ihrem Gang anfertigte.[58] Obwohl die zahlreichen Briefe Wirsungs die Erstautorenschaft seiner Entdeckung untermauern, war es nach eigener Aussage, der seines Sohnes und der Ansicht einiger Medizinhistoriker vielleicht auch Wirsungs Schüler Moritz Hofmann, der den Gang erstmals bei einem Truthahn fand, obwohl er diese Entdeckung niemals publizierte.[59] Die Entdeckung des zusätzlichen Ausführungsgangs (Ductus pancreaticus accessorius) wird Giovanni Domenico Santorini zugeschrieben, allerdings wurde er bereits 1656 von Thomas Wharton beschrieben. Santorini erkannte aber als Erster, dass dieser zusätzliche Gang keine Fehlbildung, sondern eine „normale“ anatomische Struktur ist.[60] Die ontogenetische Basis, nämlich die Embryologie der Bauchspeicheldrüse, wurde 1812 von Johann Friedrich Meckel d. J. beschrieben. Meckel klärte auch die Entstehung des zweigeteilten Pankreas (Pancreas divisum) auf. 1879 entdeckte Albert von Kölliker die beiden Pankreasanlagen.[61] 1711 (erst 1720 publiziert) beschrieb Abraham Vater dann präzise die Anatomie der gemeinsamen Mündung von Gallen- und Bauchspeicheldrüsengang auf der heute nach ihm benannten Papilla Vateri.[62] Bereits 1654 entdeckte Francis Glisson den kleinen Schließmuskel an der Mündungsstelle von Gallen- und Pankreasgang.[63] Ruggero Oddi untersuchte 1887 dessen Existenz vergleichend-anatomisch und deutete ihn auch funktionell präziser, weshalb dieser Schließmuskel heute auch nach Oddi benannt wird (Musculus sphincter Oddi).[64]

Mit der Entdeckung der Pankreasausführungsgänge sowie auch der Ausführungsgänge der Speicheldrüsen Mitte des 17. Jahrhunderts war der Weg zur funktionellen Deutung des exokrinen Anteils geebnet. Nachdem Thomas Bartholin bereits 1651 ein von der Bauchspeicheldrüsen in den Darm abgegebenes Sekret vermutete, legte Reinier de Graaf 1664 die erste Pankreasfistel bei einem Hund und war so in der Lage, erstmals das Sekret aufzufangen.[65] Die von De Graaf gefundenen Ähnlichkeiten der Speicheldrüsen- und Pankreasgänge inspirierten 1796 Samuel Thomas von Soemmerring zur Prägung der noch heute üblichen deutschen Bezeichnung „Bauchspeicheldrüse“.[66] 1669 verarbeitete Marcello Malpighi diese Erkenntnisse in seinem Buch und schloss, dass das Sekret den Nahrungsbrei im Darm chemisch verändert – die Spaltung der Nahrungsbestandteile durch Pankreasenzyme war postuliert.[67]
Ende des 17. Jahrhundert führte Johann Konrad Brunner bei Hunden Operationen mit Teilentfernung der Bauchspeicheldrüse und Abbinden der Ausführungsgänge durch. Er schloss aus seinen Experimenten allerdings, dass das Organ scheinbar keine essentielle Funktion bei der Verdauung hat.[68] Leopold Gmelin und Friedrich Tiedemann erkannten 1826, dass der Pankreassaft den Nahrungsbrei in eine vom Darm aufnehmbare Form verändert. Allerdings vermuteten sie, dass Speichel die Proteine und Pankreassaft die Stärke spaltet. Wenig später erkannte Johann Eberle die stärkespaltende und Fette emulgierende Eigenschaft des Pankreassaftes. 1838, vier Jahre später, wies Jan Evangelista Purkyně nach, dass Fette nicht nur emulgiert, sondern gespalten werden, wenn sie mit Galle und Pankreassaft versetzt werden.[69] Diese Arbeiten waren Ausgangspunkt der umfangreichen Forschung von Claude Bernard, dem „Vater der Pankreas-Physiologie“.[70] 1846 entdeckte er die Pankreaslipase und erkannte, dass Pankreassaft Stärke, Fette und Eiweiße in kleinere Moleküle spalten kann.[71] Die proteinspaltende Komponente Trypsin wurde erstmals 1862 von Alexander Danilewski isoliert und 1876 von Wilhelm Kühne in einem verbesserten Verfahren nahezu in Reinform extrahiert.[72] Iwan Pawlow und seine Schüler führten Ende des 19. Jahrhunderts zahlreiche Experimente zur Steuerung der Bildung des Pankreassaftes, insbesondere durch den Nervus vagus durch. Pawlows Schüler Nikolai Schepowalnikow entdeckte 1899, dass Trypsin erst durch den Inhalt des Zwölffingerdarms aktiviert wird und damit die Enteropeptidase.[73] William Bayliss und sein Schwager Ernest Starling fanden bei ihren Pankreas-Experimenten 1902 das erste Hormon überhaupt, das die Bauchspeicheldrüse anregende Sekretin.[74] 1928/1929 entdeckten Andrew Conway Ivy und Eric Oldberg das zweite auf die Bauchspeicheldrüsensekretion wirkende Enterohormon, das Cholecystokinin, während die übrigen erst in den 1970er Jahren nachgewiesen wurden.[75]

Mit der Verbesserung der Lichtmikroskope und der mikroskopischen Techniken im 19. Jahrhundert waren auch die technischen Voraussetzungen zur Erforschung des Feinbaus gegeben. Die erste histologische Beschreibung des Feinbaus des exokrinen Teils legte Moyse in seiner Dissertation 1852 vor, in der auch erstmals die Acini beschrieb.[76] 1869 entdeckte der deutsche Pathologe Paul Langerhans die später nach ihm als Langerhans-Inseln benannten endokrinen Zellverbände in der Bauchspeicheldrüse, konnte ihre Funktion aber nicht deuten. 1880 erkannte Étienne Lancereaux, dass die seit dem Altertum bekannte Zuckerkrankheit definitiv mit Veränderungen der Bauchspeicheldrüse in Beziehung steht.[77] 1889 lösten Oskar Minkowski und Josef von Mering durch die Entfernung der Bauchspeicheldrüse bei Hunden eine Zuckerkrankheit aus,[78] doch erst der Russe Leonid Sobolew erkannte 1900 die direkte Beziehung zu den Langerhans-Inseln,[79] eine Beobachtung die 1909 durch William George MacCallum experimentell bestätigt wurde.[80] Georg Ludwig Zülzer unternahm 1904 bis 1908 zahlreiche Versuche zur Behandlung von Diabetes mellitus mittels Pankreasextrakten. Obwohl er eine Verbesserung der Symptome der Zuckerkrankheit erzielte, brach er aufgrund der starken Nebenwirkungen (vermutlich infolge ungenügender Aufreinigung) seine Versuche ab.[81] Michael Lane konnte anhand unterschiedlicher Fixierungen 1907 erstmals zwei Zelltypen (α- und β-Zellen) unterscheiden, δ-Zellen wurden von William Bloom 1931 entdeckt.[82] György Gömöri entwickelte zwischen 1938 und 1950 die Färbeverfahren zur Zelldifferenzierung entscheidend weiter. Sie verloren erst mit dem Aufkommen immunhistochemischer Färbemethoden ab 1976 an Bedeutung.[83]
Frederick Banting und Charles Best gelten als die Entdecker des Insulins. Sie isolierten es 1921 aus Bauchspeicheldrüsen von Hunden und setzten es 1922 erfolgreich zur Behandlung eines zuckerkranken Jungen ein.[84] Der Rumäne Nicolae Paulescu hatte zwar bereits 1916 ein insulinwirksames Extrakt aus Pankreasgewebe hergestellt und sich das Verfahren 1922 patentieren lassen, es jedoch nur bei Hunden eingesetzt.[85] 1923 entdeckten Charles P. Kimball und John R. Murlin bei Extraktionsversuchen ein weiteres Hormon, das Glucagon.[86] Das Vasoaktive intestinale Polypeptid wurde erstmals 1966 von Jerry D. Gardner und James J. Cerda aus einem Pankreastumor isoliert,[87] Somatostatin in der Bauchspeicheldrüse erst 1977 aus Inselzelltumoren.[88]
Literatur
- Hans-Gunther Beger u. a.: The Pancreas: An Integrated Textbook of Basic Science, Medicine, and Surgery. 2. Auflage. John Wiley & Sons, New York City 2009, ISBN 978-1-4443-0013-0.
- Markus W. Büchler u. a.: Pankreaserkrankungen. Akute Pankreatitis, Chronische Pankreatitis, Tumore des Pankreas. 2. Auflage. Karger, Basel 2004, ISBN 3-8055-7460-6.
- Detlev Drenckhahn (Hrsg.): Zellen- und Gewebelehre, Entwicklungslehre, Skelett- und Muskelsystem, Atemsystem, Verdauungssystem, Harn- und Genitalsystem. 16. Auflage. Urban & Fischer, München 2003, ISBN 3-437-42340-1.
- John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4.
- Franz-Viktor Salomon: Anatomie für die Tiermedizin. 2. Auflage. Enke, Stuttgart 2008, ISBN 978-3-8304-1075-1, S. 321–323.
Weblinks
Einzelnachweise
- ↑ Detlev Drenckhahn (Hrsg.): Anatomie, Band 1. 17. Auflage. Urban&Fischer, München 2008, ISBN 978-3-437-42342-0, S. 723.
- ↑ a b Walther Graumann, Dieter Sasse: CompactLehrbuch Anatomie, Band 3. 1. Auflage. Schattauer, Stuttgart 2004, ISBN 978-3-7945-2063-3, S. 120–122.
- ↑ a b c d e Renate Lüllmann-Rauch: Histologie. 1. Auflage. Georg Thieme, Stuttgart 2009, ISBN 978-3-13-129243-8, S. 408–413.
- ↑ a b Over Cabrera: The unique cytoarchitecture of human pancreatic islets has implications for islet cell function. In: Proceedings of the National Academy of Sciences (PNAS). 103, 2006, ISSN 0027-8424, S. 2334–2339 (PDF; 800 KB).
- ↑ Helga Fritsch und Wolfgang Kühnel: Taschenatlas der Anatomie: Innere Organe. 10. Auflage. Georg Thieme, Stuttgart 2009, ISBN 978-3-13-492110-6, S. 44–45.
- ↑ Gerhard Aumüller u.a.: Duale Reihe Anatomie. 2. Auflage. Georg Thieme, Stuttgart 2010, ISBN 978-3-13-152862-9, S. 675.
- ↑ Michael Schünke u.a.: Prometheus – Lernatlas der Anatomie: Innere Organe. 3. Auflage. Georg Thieme, Stuttgart 2009, ISBN 978-3-13-139533-7, S. 273.
- ↑ E. J. Verspohl, R. Tacke, E. Mutschler, G. Lambrecht: Muscarinic receptor subtypes in rat pancreatic islets: binding and functional studies. In: European Journal of Pharmacology. 178, Nr. 3, März 1990, ISSN 0014-2999, S. 303–311, PMID 2187704.
- ↑ Vay Liang W. Go: The Pancreas – Biology, Pathophysiology and Disease. Ravers Press. Second Edition, ISBN 0-88167-986-0
- ↑ F. C. Brunicardi, D. Elahi, D. K. Andersen: Splanchnic neural regulation of somatostatin secretion in the isolated perfused human pancreas. In: Annals of Surgery. 219, Nr. 3, März 1994, ISSN 0003-4932, S. 258–266, PMID 7908511, PMC 1243133 (freier Volltext).
- ↑ a b c d e f g R. S. Heller: The comparative anatomy of islets. In: Advances in experimental medicine and biology. 654, 2010, ISSN 0065-2598, S. 21–37, doi:10.1007/978-90-481-3271-3_2, PMID 20217492 (Review).
- ↑ a b c J. M. W. Slack: Developmental biology of the pancreas. In: Development 121, 1995, S. 1569–1580. (Volltext).
- ↑ David J. McKenzie et al.: Fish Physiology: Primitive Fishes: Primitive Fishes. (= Fish Physiology. Band 26) Academic Press 2011, ISBN 978-0-08-054952-1, S. 385.
- ↑ a b c P. J. Bentley: Comparative Vertebrate Endocrinology. Cambridge University Press 1998, ISBN 978-0-521-62998-0, S. 47.
- ↑ Franz-Viktor Salomon und Maria-Elisabeth Krautwald-Junghanns: Bauchspeicheldrüse. In: Anatomie für die Tiermedizin. 2. Auflage. Enke, Stuttgart 2008, ISBN 978-3-8304-1075-1, S. 779.
- ↑ a b c Franz-Viktor Salomon: Bauchspeicheldrüse, Pancreas. In: Anatomie für die Tiermedizin. 2. Auflage. Enke, Stuttgart 2008, ISBN 978-3-8304-1075-1, S. 321–323.
- ↑ a b c Norbert Ulfig: Kurzlehrbuch Embryologie. Georg Thieme, Stuttgart 2009, ISBN 978-3-13-139582-5, S. 109.
- ↑ a b c Bertram Schnorr und Monika Kressin: Embryologie der Haustiere. 6. Auflage. Georg Thieme, Stuttgart 2011, ISBN 978-3-8304-1147-5, S. 181–182.
- ↑ S. B. Smith et al.: Rfx6 directs islet formation and insulin production in mice and humans. In: Nature. 463, Nr. 7282, Februar 2010, ISSN 1476-4687, S. 775–780, doi:10.1038/nature08748, PMID 20148032, PMC 2896718 (freier Volltext).
- ↑ E. Sh. Gerlovin: Evolutionary morphology and classification of pancreatic acinar-islets cells. In: T. Adesanya et al. (Eds.): The Evolution of Pancreatic Islets. Elsevier, 1976, ISBN 978-1-4832-8072-1, S. 113–120.
- ↑ O. D. Madsen: Pancreas phylogeny and ontogeny in relation to a 'pancreatic stem cell'. In: Comptes rendus biologies. 330, Nr. 6–7, 2007, ISSN 1631-0691, S. 534–537, doi:10.1016/j.crvi.2007.03.006, PMID 17631449, PMC 1988839 (freier Volltext) (Review).
- ↑ Wolfgang von Engelhardt: Physiologie der Haustiere. Georg Thieme, 2009, ISBN 978-3-8304-1078-2, S. 410.
- ↑ Wolfgang von Engelhardt: Physiologie der Haustiere. Georg Thieme, 2009, ISBN 978-3-8304-1078-2, S. 415.
- ↑ Detlef Doenecke: Karlsons Biochemie und Pathobiochemie. Georg Thieme, 2005, ISBN 978-3-13-357815-8, S. 536–539.
- ↑ Bernhard Kleine, Winfried Rossmanith: Hormone und Hormonsystem – Lehrbuch der Endokrinologie. 3. Auflage. Springer Spektrum, Berlin/Heidelberg 2014, ISBN 978-3-642-37091-5, S. 117, 120.
- ↑ Wolfgang Huber und Roland M. Schmid: Akute Pankreatitis: Evidenzbasierte Diagnostik und Therapie (PDF; 291 kB). In: Deutsches Ärzteblatt. 104, Nr. 25, 22. Juni 2007, S. A-1832–A-1841. Abgerufen am 17. Dezember 2014.
- ↑ Johannes-Martin Hahn: Checkliste Innere Medizin. Georg Thieme, 2010, ISBN 978-3-13-107246-7, S. 367–369.
- ↑ Edouard Battegay: Siegenthalers Differenzialdiagnose: Innere Krankheiten – vom Symptom zur Diagnose. 20. Auflage. Georg Thieme, 2012, ISBN 978-3-13-152520-8, S. 315.
- ↑ Informationen zum Pankreastumor, Zentrum für Krebsregisterdaten am Robert Koch-Institut. Abgerufen am 17. Dezember 2014.
- ↑ Georg von Samson-Himmelstjerna et al.: Lehrbuch der Parasitologie für die Tiermedizin. 3. Auflage, Georg Thieme, 2012, ISBN 978-3-8304-1205-2, S. 175.
- ↑ J. F. Denton, J. M. Kinsella: Lyperosomum intermedium sp. N. (Digenea: Dicrocoeliidae) from the rice rat, Oryzomys palustris, from southeastern salt marshes. In: The Journal of parasitology. 58, Nr. 2, April 1972, ISSN 0022-3395, S. 226–228, PMID 5022855.
- ↑ IDF Diabetes Atlas 6th edition, International Diabetes Federation, 2014. Abgerufen am 17. Dezember 2014.
- ↑ Reto Neiger: Differenzialdiagnosen Innere Medizin bei Hund und Katze. Enke, 2009, ISBN 978-3-8304-1064-5, S. 340.
- ↑ A. Raffel et al.: Hyperinsulinemic hypoglycemia due to adult nesidioblastosis in insulin-dependent diabetes. In: World Journal of Gastroenterology: WJG. 12, Nr. 44, November 2006, ISSN 1007-9327, S. 7221–7224, PMID 17131493, PMC 4087792 (freier Volltext).
- ↑ a b c Helmut Messmann: Klinische Gastroenterologie: Das Buch für Fort- und Weiterbildung plus DVD mit über 1000 Befunden. Georg Thieme, 2011, ISBN 978-3-13-165991-0, S. 709.
- ↑ Helmut Messmann: Klinische Gastroenterologie: Das Buch für Fort- und Weiterbildung plus DVD mit über 1000 Befunden. Georg Thieme, 2011, ISBN 978-3-13-165991-0, S. 710.
- ↑ Detlev Drenckhahn (Hrsg.): Benninghoff: Anatomie. Makroskopische Anatomie, Histologie, Embryologie, Zellbiologie (Band 1). 16. Auflage. Urban & Fischer, München 2003, ISBN 3-437-42340-1.
- ↑ Keith L. Moore: Embryologie – Lehrbuch und Atlas der Entwicklungsgeschichte des Menschen. 3. Auflage. Schattauer, Stuttgart 1990, ISBN 3-7945-1356-8.
- ↑ a b Jörg M. Steiner (Hrsg.): Small Animal Gastroenterology. Schlütersche, Hannover 2008, ISBN 978-3-89993-027-6.
- ↑ a b Paul Georg Lankisch und Iris Schmidt: Pankreasfunktionstests. In: Deutsches Ärzteblatt 96, 1996 (Volltext). Abgerufen am 17. Dezember 2014.
- ↑ C. Löser, A. Möllgaard, U. R. Fölsch: Faecal elastase 1: a novel, highly sensitive, and specific tubeless pancreatic function test. In: Gut. 39, Nr. 4, Oktober 1996, ISSN 0017-5749, S. 580–586, PMID 8944569, PMC 1383273 (freier Volltext).
- ↑ Markus Vieten: Laborwerte verstehen leicht gemacht: Alle wichtigen Werte von A–Z – Labordiagnostik der häufigsten Erkrankungen. Georg Thieme, 2009, ISBN 978-3-8304-6284-2.
- ↑ K. S. Goonetilleke, A. K. Siriwardena: Systematic review of carbohydrate antigen (CA 19-9) as a biochemical marker in the diagnosis of pancreatic cancer. In: European journal of surgical oncology: the journal of the European Society of Surgical Oncology and the British Association of Surgical Oncology. 33, Nr. 3, 2007, ISSN 0748-7983, S. 266–270, doi:10.1016/j.ejso.2006.10.004, PMID 17097848 (Review).
- ↑ T. R. Srinivas und Daniel A. Shoskes: Kidney and Pancreas Transplantation: A Practical Guide. Springer Science & Business Media, 2010, ISBN 978-1-60761-642-9.
- ↑ Überblick vom Transplantationszentrum im Klinikum rechts der Isar, München. Abgerufen am 17. Dezember 2014.
- ↑ P. Layer, J. Keller, P. G. Lankisch: Pancreatic enzyme replacement therapy. In: Current gastroenterology reports. 3, Nr 2, 2001, ISSN 1522-8037, S. 101–108, PMID 11276376 (Review).
- ↑ Andreas Liebl, Eric Martin: Diabetes mellitus Typ 2: mit 13 Tabellen. Govi, Eschborn, 2005, ISBN 978-3-7741-1042-7, S. 76.
- ↑ PatriCa BB: Chinese Tonic Soup with Pork Pancreas and Radishes auf mywoklife.com, 23. Oktober 2011. Zuletzt abgerufen am 16. Dezember 2014.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 3.
- ↑ a b John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 4.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 6.
- ↑ a b John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 9.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer 2002, ISBN 978-0-306-46742-4, S. 8.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 12.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 16.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 22.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 20.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 28–29.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 17.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 32.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 34.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 38.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 40.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 43.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 52.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 55.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 58.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 68.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 75.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 77.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer 2002, ISBN 978-0-306-46742-4, S. 83.
- ↑ J. Reynolds Green: The Soluble Ferments and Fermentation. Cambridge University Press, 2014, ISBN 978-1-107-67395-3, S. 195–196.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 88.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 89/90.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 93.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 59–60.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 105/106..
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 107.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 111.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 112.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 113.
- ↑ S. J. Cooperstein: The Islets of Langerhans: Biochemistry, Physiology, and Pathology. Elsevier, 2012, ISBN 978-0-323-14733-0, S. 5.
- ↑ S. J. Cooperstein: The Islets of Langerhans: Biochemistry, Physiology, and Pathology. Elsevier, 2012, ISBN 978-0-323-14733-0, S. 8–9.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 117.
- ↑ Vivienne Baillie Gerritsen: Protein of the 20th century. In: Protein Spotlight. 9. April 2001. Abgerufen am 17. Dezember 2014.
- ↑ C. P. Kimball, John R. Murlin: Aqueous extracts of pancreas. III. Some precipitation reactions of insulin. In: J. Biol. Chem. 58, 1923, S. 337–346.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 151.
- ↑ John Malone Howard und Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 978-0-306-46742-4, S. 152.