Трипсины
| Трипсин-1 | ||
|---|---|---|

| ||
| Тетрамер трипсина-1, человеческий согласно PDB 2RA3 | ||
| Свойства человеческого белка | ||
| Масса / длина первичной конструкции | 224 аминокислоты | |
| Кофактор | Ca 2+ | |
| Изоформы | одноцепочечный / двухцепной | |
| Идентификатор | ||
| Имена генов | PRSS1 ; TRY1 | |
| Внешние идентификаторы | ||
| Информация о наркотиках | ||
| Код УВД |
B06 AA07 D03 BA01 M09 AB52 |
|
| Классификация ферментов | ||
| EC, категория | 3.4.21.4 , сериновая протеаза | |
| МЕРОПЫ | S01.127 | |
| Тип ответа | гидролиз | |
| Субстрат | Аргинин, лизиновые связи в пептидах | |
| Продукты | Продукты деления | |
| Вхождение | ||
| Родительский таксон | Эукариоты | |
Человеческий трипсин представляет собой смесь трех пищеварительных ферментов, которые расщепляют белки в тонком кишечнике и относятся к пептидазам : трипсин-1 ( катионный трипсин, две трети), трипсин-2 ( анионный трипсин, примерно одна треть) и трипсин-3 ( мезотрипсин , несколько процентов). Многие подобные ферменты у млекопитающих, насекомых, рыб и грибов также носят название трипсин.
Недостаток трипсина-1 у человека приводит к недоеданию из-за дефицита белка . Причиной может быть мутация в гене TRY1 . Еще одно последствие такой мутации - наследственный панкреатит , при котором собственный трипсин-1 организма не может расщепляться, а поджелудочная железа его переваривает. Мутация в гене трипсина-2 может способствовать развитию хронического панкреатита.
биосинтез
Протеазы трипсин, химотрипсин и карбоксипептидазы секретируются поджелудочной железой в качестве неактивных предшественников зимогена . Кишечный фермент энтеропептидаза , связанный с кишечным эпителием , контролирует превращение трипсиногена-предшественника в трипсин. Трипсин активируется сам ( положительная обратная связь ) и превращает химотрипсиноген, проэластазу, а также прокарбоксипептидазу и другие неактивные ферменты в их активные формы (химотрипсин, эластаза и карбоксипептидаза).
Биологическая функция
Трипсин - одна из эндопептидаз , расщепляющих белки в определенных точках. Трипсин представляет собой сериновую протеазу . Трипсин избирательно расщепляет пептидные связи в соответствии с областью кишечника в соответствии с основными аминокислотами лизином , аргинином, а также в соответствии с модифицированным цистеином . Протеиназы не специализируются на определенных белках, а на определенных аминокислотных последовательностях (структурных особенностях) внутри белков; это важно для процесса пищеварения , поскольку в противном случае в тонком кишечнике потребовался бы определенный фермент для каждого белка, который образуется.
Эндопептидазы - важные вещества в химико-аналитическом секвенировании белков . Расщепленные ( денатурированные ) белки легко гидролизуются и связывают с собой молекулы воды.
Пепсин, выделяемый стенкой желудка, имеет аналогичную функцию и эффект .
Трипсин имеет оптимальное значение pH от 8 до 8,5. Распространено заблуждение, что трипсин имеет оптимальный уровень pH для тонкого кишечника. Однако значение pH в тонком кишечнике находится в диапазоне от кислого до слабощелочного.
история
Фермент при воспалительных процессах
Эффект трипсина в форме терапии личинками был замечен ранее Амбруазом Паре , Домиником-Жаном Ларре и Уильямом Стивенсоном Бэром (1872–1931). Затем был произведен экстракт личинок, который, по словам А. Лэвена, не дал никакого эффекта.
В 1857 году трипсин как таковой был открыт Люсьеном Корвизаром (1824–1882) и назван в 1867 году Вильгельмом Кюне . С 1955 года его применяют при воспалении ротоглотки , носа и верхних дыхательных путей .
В 1954 году Ирвинг Иннерфилд попытался вылечить диабетическое воспаление тканей и язвы на ногах с помощью внутримышечной инъекции трипсина .
Пищеварительный фермент
Протеолитический свойство трипсина наблюдалась в 1836 году Johannes Евангелиста Пуркинье и Seligmann Саймона Pappenheim (1775-1840) , а в 1856 году Claude Bernard . Люсьен Корвисарт начал несколько экспериментов с панкреатическим секретом собак и овец в 1857 году , чтобы более точно описать эффект.
В 1862 году Александру Якуловичу Данилевскому удалось впервые выделить трипсин , протерев его песком и диатомитовой землей, а затем погрузив в коллодий . И в 1875 году Рудольф Heidenhain (1834-1897) признал , что это было в клетках в поджелудочной железе . Он получил свое название от Вильгельма Кюне в 1876 году .
В 1899 году Иван Павлов (1849–1936) обнаружил, что выделения из тонкой кишки активируют трипсиноген. Он назвал фермент энтерокиназой.
В 1902 году Эрнест Генри Старлинг и Уильям Мэддок Бейлисс доказали, что гормон секретин отвечает за секрецию поджелудочной железы. Эмиль Абдерхалден (1877–1950), В. Хемтикес и Франкель показали, что трипсин и пепсин являются двумя разными ферментами. 1912–1916 гг. в каждом случае независимо друг от друга.
В 1931 году Джон Ховард Нортроп представил кристаллическую структуру трипсина .
В 1941 году МакКлин и Хейл обнаружили, что, помимо прочего, трипсин обладает способностью предотвращать развитие бактериальной инфекции в ткани путем инактивации бактериальной гиалуронидазы . Он успешно используется против местного воспаления в сочетании с антибиотиками. Есть записи об этом от Грейера и Гесса с 1954 года.
Противораковая терапия
В 1906 трипсин был использован Джон Борода в новообразованиях и записал свои результаты в работе «Фермент Лечение рака» в 1911 году. В то же время внутриопухолевые инъекции, выполненные Фердинандом Блюменталем , Уильямом Алланом Пьюзи и П. Т. Халдом, также привели к размягчению опухолей . Британские врачи производили промышленные препараты и лечили ими других пациентов. Однако здесь не было никакого эффекта, поскольку ферменты теряли свою активность при хранении при комнатной температуре , что еще не было известно в то время, и поэтому от этого терапевтического подхода отказались.
использовать
В лабораториях по культивированию клеток трипсин используется для отделения прикрепленных клеток со дна культуральных чашек или для выделения клеток. Пока клетки не обрабатываются трипсином слишком долго, они не будут повреждены, и будут разрушены только внеклеточные белки.
В протеомике трипсин является наиболее часто используемой протеазой для создания пептидов для масс-спектрометрического анализа , например Б. при пищеварении в геле .
Для хромосомного анализа в виде кариограммы хромосомы обрабатывают трипсином с использованием техники GTG-бэндинга , а затем окрашивают по Гимзе.
С фармацевтической точки зрения трипсин сейчас используется только в комбинированных препаратах. Примеры: Alphintern, Phlogenzym и Wobenzym N.
Реакция обнаружения
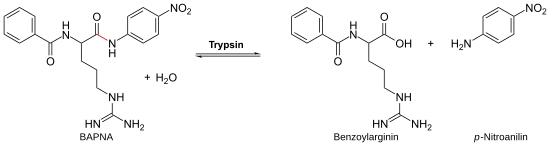
Активность трипсина может быть продемонстрирована N- бензоил- D , L- аргинин- п- нитроанилидом (BAPNA). BAPNA расщепляется трипсином по аргинину, и образуется п- нитроанилин . Результирующее увеличение концентрации п- нитроанилина можно наблюдать спектроскопически при длине волны 405 нм .
Индивидуальные доказательства
- ↑ OMIM: Трипсин-1
- ↑ Тибор Сипос, Джозеф Р. Меркель: Влияние ионов кальция на активность, термостабильность и структуру трипсина . В кн . : Биохимия . Лента 9 , вып. 14 , 1970, стр. 2766-2775 , DOI : 10.1021 / bi00816a003 .
- ↑ Лоуренс А. Моран: О значении оптимума pH для активности ферментов. В: Sandwalk. 9 декабря 2014, доступ к 23 ноября 2016 .
- ↑ Дж. Фоллингборг: Внутрипросветный pH желудочно-кишечного тракта человека . В: Датский медицинский бюллетень . Лента 46 , нет. 3 , 1999, ISSN 0907-8916 , с. 183-196 , PMID 10421978 .
- ↑ L. Ovesen, F. Bendtsen, U. Tage-Jensen, NT Pedersen, BR Gram, SJ Rune: Внутрипросветный pH в желудке, двенадцатиперстной кишке и проксимальном отделе тощей кишки у здоровых субъектов и пациентов с внешнесекреторной недостаточностью поджелудочной железы . В кн . : Гастроэнтерология . Лента 90 , нет. 4 , 1986, стр. 958-962 , PMID 3949122 .
- ↑ a b c d e f g h i j Вольф-Дитер Мюллер-Янке , Кристоф Фридрих , Ульрих Мейер: История медицины . 2-е, переработанное и дополненное издание. Wissenschaftliche Verlagsgesellschaft mbH, Штутгарт 2005, ISBN 978-3-8047-2113-5 , стр. 110 .
- ^ Полосы GTG (G-диапазоны по трипсину с использованием Гимзы). Институт генетики человека при Университетской больнице Йены , по состоянию на 14 марта 2011 г.
веб ссылки
- Дженнифер МакДауэл / Interpro: Протеин месяца: трипсин и химотрипсин. (англ.)