Реакция Виттига
Реакция Виттига - это органическая химическая реакция, которая служит для создания связей C = C и названа в честь ее первооткрывателя Георга Виттига . Его можно использовать для олефинирования карбонильных соединений ( альдегидов или кетонов ) с фосфорилидами до алкенов путем замещения карбонильного кислорода :
Как реакция образования олефина, она имеет большое значение в лабораториях и в промышленности. Реакция Виттига является широко применяемым методом синтеза олефинов и допускает использование широкого диапазона функциональных групп . Обычно только очень кислотные функциональные группы, такие как карбоновые кислоты или 1,3-дикарбонильные соединения, оказываются нарушающими реакцию Виттига .
генеральный
В реакции Виттига известны как меж-, так и внутримолекулярные варианты. Реакция является региоселективной , то есть вновь образованная двойная связь углерод-углерод обнаруживается на месте ранее существовавших двойных связей углерод-кислород. Альдегиды и кетоны рассматриваются как карбонильные компоненты, причем альдегиды являются более реакционноспособными и стерически менее затрудненными кетонами, способными избирательно олефинировать по сравнению со стерически затрудненными кетонами. Эфиры карбоновых кислот почти инертны в реакции Виттига.
Недостатком является, в принципе, слабая ( E , Z ) селективность, которую, однако, можно контролировать с помощью подходящих условий реакции. Благодаря высокой толерантности к функциональным группам, реакция Виттига также может привести к появлению большого количества функциональных групп в самом реактиве Виттига.
Реакция Виттига используется в синтезе олефиновых природных веществ, таких как витамины A и D, каротиноиды ( β-каротин, см. Ниже), сквален, ненасыщенные феромоны , гормоны насекомых, душистые вещества и простагландины .
сказка
открытие
В своих экспериментах по кватернизации основных элементов группы Виттиг получил цвиттерион, который проявлял замечательные свойства.
В присутствии карбонильных соединений они гладко реагировали с карбонильным углеродом с образованием двойной углерод-углеродной связи и оксида трифенилфосфина .
Виттиг опубликовал эту новую реакцию, открытую в 1947 году в Тюбингенском университете , под заголовком « О трифенил-фосфин-метилене как олефинобразующих реагентах» и в дальнейшем назвал эту реакцию карбонил-олефинированием . Позднее вошло в употребление название реакция Виттига. Сегодня соль трифенилалкилфосфония обычно используется в качестве соли Виттига для этой реакции, а оксид трифенилфосфина получается как побочный продукт .
Реакция Виттига быстро оказалась очень универсальной и универсальной. Георг Виттиг был удостоен Нобелевской премии по химии в 1979 году .
Первые промышленные применения
BASF с энтузиазмом воспринял новый метод. Это позволило объединить уже существующий синтетический строительный блок [производное (2 E , 4 E ) -3-метил-5- (2,6,6-триметилциклогекс-1-ен-1-ил) пентана] с легко доступным (2 E , 4 E , 6 E ) -2,7-диметилокта-2,4,6-триендиал для связывания с β- каротином . Патент был подан (BASF) всего через три года после публикации Виттига.

Изготовление илидов
Тризамещенные фосфорные алкилы / арилы могут быть кватернизованы в реакции S N 2. Например, трифенилфосфин ( 1 ) реагирует с этилбромидом ( 2 ) с образованием соли фосфония через этилтрифенилфосфонийбромид ( 3 ) с образованием илида ( 4 ) и илена:

Трифенилфосфин ( 1 ) и этилбромид ( 2 ) нагревают в бензоле в автоклаве до 130 ° C в течение 20 часов. Соль фосфония выпадает в кристаллическую форму при охлаждении (выход 90%).
Фосфины - хорошие нуклеофилы, но плохие основания. По этой причине отщепление E2, конкурирующее с реакцией S N 2, почти полностью подавляется. Таким образом, большинство первичных и вторичных алкилгалогенидов можно превратить в их фосфониевые соли с хорошими выходами.
В отличие от в основном изолированных галогенидов фосфония, илиды, полученные из них депротонированием по атому α-C, обычно далее напрямую превращаются.
Бромид этилтрифенилфосфония ( 3 ) депротонируют гидридом натрия в инертном газе в ДМСО .
Образуется внешне нейтральное соединение фосфора, которое называется илидом ( 4 ) или фосфораном. Эти бетаины также могут быть сформулированы как Ylene . Другие реагенты общего депротонирования являются фениллитиями или н - бутиллития .
Современный и простой метод депротонирования иона фосфония в условиях отсутствия лития - это использование трет- бутанолата калия в ТГФ или, в случае пространственно затрудненных карбонильных групп, в толуоле . Соль Виттига может быть смешана в сухом виде с основанием в эквимолярных пропорциях и смешана с растворителем, который является более простой в использовании альтернативой растворимому илиду . Илиды фосфора могут быть также получены добавлением карбена к фосфинам.
Механизмы реакции Виттига
Механизм реакции Виттига можно рассматривать в целом или со стереохимической точки зрения.
Реакция Виттига, генерал
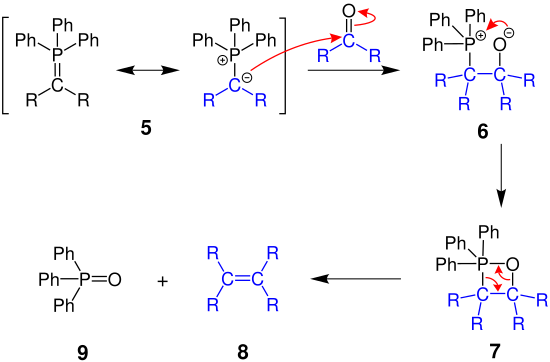
Следующий механизм объясняет общую реакцию Виттига, в которой фосфорилиды реагируют с карбонильными соединениями с образованием алкенов.
Отрицательно заряженный атом углерода фосфорилида 5 атакует карбонильное соединение исходного материала, и образуется фосфор бетаин 6 , который далее реагирует с образованием оксафосфетана 7 , четырехчленного кольца. Наконец, он распадается на алкен 8 и оксид трифенилфосфина 9 из-за сильной двойной связи фосфор-кислород.
Реакция Виттига, стереохимические аспекты
В целом механизм еще точно не выяснен или он протекает по-разному в зависимости от заместителя. По большей части реакция проходит в несколько стадий; отдельные соединения могут быть изолированы. В случае реакционноспособных илиден / карбонильных соединений атака карбаниона и образование оксафосфетана происходит согласованно в соответствии с правилами Вудворда-Хоффмана . Также есть свидетельства того, что в присутствии очень больших заместителей (высокие стерические затруднения) реакция за счет уровней свободных радикалов (SET s ingle e Lectron t ransfer) расширяется.
Когда образуется бетаин, определяют, имеет ли алкен конфигурацию ( E ) или ( Z ). Однако первый шаг частично обратим.
- В случае обратимого добавления в этих случаях образуется термодинамически более стабильный продукт присоединения (термодинамический контроль реакции).
- В случае необратимого добавления продукт образуется быстрее (более низкая энергия активации; контроль кинетической реакции).
Вскоре после открытия было признано, что реакция Виттига обычно довольно диастереоселективна. В зависимости от реакционной способности используемых илидных / карбонильных компонентов диастереоселективность может быть конкретно изменена путем выбора заместителей (как для илида, так и для карбонильного соединения) и условий реакции, отношения выходов изомеров. Поскольку обычно дается реакционная способность карбонила, на диастереоселективность пытаются влиять, регулируя реакционную способность илида. Общее правило:
| Реакционная способность карбонильного соединения | ||||
|---|---|---|---|---|
| высоко | Средняя | низкий | ||
| Реактивность в илида | ||||
| высоко | ( Z ) | ( Z ) | ( E , Z ) | |
| Средняя | ( Z ) | ( E , Z ) | ( E , Z ) | |
| низкий | ( E ) | ( E ) | ( E ) | |
Возможности изменения реакционной способности оксафосфетана
Дестабилизация может происходить за счет замены заместителей на фосфоре донорами π / σ. Затем ( Z ) -олефины обычно образуются с высокими выходами .
Стабилизация может быть достигнута заменой заместителей фосфора на акцепторы π / σ. Затем ( E ) -олефины обычно образуются с высокими выходами .
Многоступенчатый (меньше реактивных компонентов)
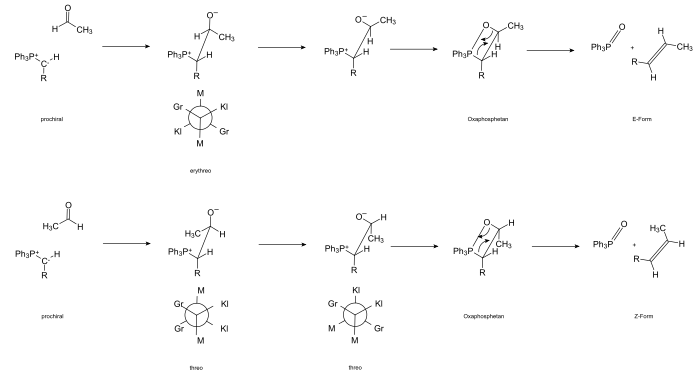
Реакция инициируется атакой карбаниона на положительно поляризованный карбонильный атом углерода и образованием бетаина. Карбонильное соединение в большинстве случаев является прохиральным; ЧАС. Когда образуется бетаин, образуется новый хиральный центр, который, в зависимости от атакующей стороны, имеет конфигурацию (pro R или pro S ) ( R ) или ( S ).
Карбанион Илида также прохиральный. Итак, есть промежуточное образование соединения, которое содержит два соседних хиральных атома углерода. В зависимости от того, как расположены заместители, существуют две различные формы, которые можно проследить до углеводов треозы и эритрозы . В целях наименования заместители отсортированы по размеру. Если в результате получается конформация (посредством вращения вокруг оси СС), в которой большой, средний и малый заместители расположены друг напротив друга, то говорят об эритроформе , альтернативно, о форме трео . Прохождение через промежуточный бетаин может быть доказано путем выделения стабильных представителей.
Бетаин реагирует через конформер, который делает возможным термическое [2 + 2] циклоприсоединение с образованием циклического оксафосфетана. Существование четырехкольцевого промежуточного соединения может быть продемонстрировано 31 P-ЯМР-спектроскопией. Оксафосфетан, образующийся при -80 ° C, стабилен при этих температурах. Разлагается при нагревании до 0 ° C.
Ретро - [2 + 2] циклоприсоединение приводит к образованию оксида трифенилфосфином и ( Е ) -алкен.
Согласованный (больше реактивных компонентов)
В случае нестабилизированных илидов реакция протекает быстро. Из-за кулоновского притяжения реагенты подходят друг к другу ортогонально (положительно поляризованные атомы присоединяются к каждому отрицательно заряженному). В то же время «большие» метильные группы расположены как можно дальше друг от друга по стерическим причинам. Связь образуется за счет кручения переходного комплекса и согласованного [2 s +2 a ] циклоприсоединения (дисротационного замыкания кольца). Промежуточная стадия приема бетаина практически пропускается.
В конечном итоге Z- оксафосфетан образуется через «скрученное» четыре кольца .
Побочные реакции
Нестабилизированные илиды неустойчивы к кислороду и воде. Гидролиз превращает илид в оксид фосфина и углеводород.
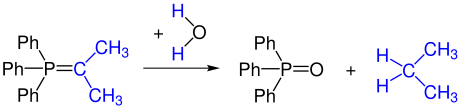
Часть илида можно повторно окислить с образованием карбонильного соединения путем частичной реакции с кислородом (или путем добавления окислителей). Это карбонильное соединение реагирует с другим илидом с образованием алкена.

Эти побочные реакции обычно нежелательны и снижают выход, поэтому работают в среде инертного газа и без влаги. Однако некоторые из этих реакций также используются в препаративных целях.
Энантиоселективные реакции Виттига
Используя хиральные фосфорные лиганды, Трост и Курран достигли энантиомерного избытка ( э.и. ) 30-40% во внутримолекулярной реакции Виттига . Смотреть там.
Реакции типа Виттига
С другими карбонильными и гетерокарбонильными соединениями
Илиды фосфора также реагируют аналогичным образом с другими карбонильными соединениями, кроме альдегидов или кетонов, например с кетенами , изоцианатами , различными ангидридами и иминами .

Илиды мышьяка
Таким образом, гомолог фосфора образует четвертичные соли арсония, которые также могут быть депротонированы основаниями в α-положении. Эти илиды мышьяка ведут себя как илиды азота при карбонилолефинизации.
Примеры
Универсальность реакции Виттига показана на следующем рисунке на нескольких примерах:
Пределы реакции Виттига
Недостатком реакции Виттига является ее ограничение альдегидами и кетонами (исключения см. Выше). Производные карбоновых кислот более или менее инертны по отношению к илидам. Реакция Виттига также требует основных условий, которые могут инициировать побочные реакции, такие как отщепление или рацемизация. Альтернативные олефинирующие реагенты находятся, например, в соединениях титаноцена (см. Реакцию Теббе ).
Альтернативы реакции Виттига
Петерсон олефинирование , то олефинирование Джулия, и реакция Tebbe . Кроме того, метатезис .
варианты
- Реакция Хорнера-Уодсворта-Эммонса
- Вариант реакции Виттига Шлоссера
- Такай олефинирование
литература
- Томас Лауэ, Андреас Плагенс: название и ключевое слово реакций в органической химии. 5-е издание. Vieweg + Teubner-Verlag, 2006, ISBN 3-8351-0091-2 .
- Марсель Хоффманн: Развитие каталитических реакций Виттига. Берлин, Mensch - & - Buch-Verlag, 2014, ISBN 978-3-86387-476-6 .
Индивидуальные доказательства
- ↑ Г. Виттиг, Г. Гейсслер: К реакции пентафенилфосфора и некоторых производных . В: Liebigs Ann. Хим. Группа 580 , нет. 1 , 1953, с. 44-57 , DOI : 10.1002 / jlac.19535800107 .
- ↑ Г. Виттиг, У. Шёллькопф: О трифенил-фосфин-метилене как олефинобразующих реагентах . В: Химические отчеты . лента 87 , нет. 9 , 1954, стр. 1318-1330 , DOI : 10.1002 / cber.19540870919 .
- ↑ Г. Виттиг, Х. Поммер: DBP 954247 , 1956.
- ↑ Г. Виттиг, Х. Поммер: В: Chem. Abstr. 53, 1959, с. 2279.
- ↑ а б Хайнц Г. Беккер и др. (Ред.): Органикум . Базовая органико-химическая практика . Wiley-VCH, Weinheim 2004, ISBN 3-527-31148-3 .
- ↑ L. Fitjer, U. Quabeck: In Chem. Commun. 15, 1985, стр. 855-864.
- ↑ Д. Шпицнер, К. Остеррайх : Анионно индуцированные домино-реакции - синтез терпена типа норпачуленола . В: Европейский журнал органической химии . лента 2001 , нет. 10 , 2001, с. 1883-1886 , DOI : 10.1002 / 1099-0690 (200105) 2001: 10 <+1883 :: АИД-EJOC1883> 3.0.CO; 2-М .
- ↑ М. Шлоссер, Б. Шауб: In Chimia 36, 1982, стр. 396-397.
- ↑ Джерри Марч: Продвинутая органическая химия . McGraw-Hill, Kogakusha 1977, ISBN 0-07-040247-7 .
- ↑ KPC Вольхардт , NE Schore: Органическая химия. 4-е издание. Wiley-VCH, Weinheim 2005, ISBN 3-527-31380-X , стр. 891.
- ↑ Роберт Б. Вудворд, Роальд Хоффманн: Сохранение орбитальной симметрии . Verlag Chemie, Weinheim 1970, ISBN 3-527-25323-8 , стр. 1-178.
- ↑ Kaim, W .: Одноэлектронный перенос: Прощай, механизмы пары электронов? В кн . : Нач. Хим. Техн. Лаборатория. 32, 1984, стр. 436-439.
- ↑ Питер Сайкс: реакционные механизмы органической химии. 7-е издание. Verlag Chemie, 1979, ISBN 3-527-21047-4 .
- ↑ M. Schlosser, KF Christmann In: Liebigs Ann. Chem., 708, 1967, с. 1.
- ↑ Томас Лауэ, Андреас Плагенс: Название и модное слово реакции органической химии. 5-е издание. Vieweg + Teubner-Verlag, 2006, ISBN 3-8351-0091-2 .
- ↑ Б. Е. Марьянов, А. Б. Рейц, М. С. Мать, Р. Р. Уиттл, Р. А. Олофсон: Стереохимия и механизм реакции Виттига. Промежуточные продукты диастереомерных реакций и анализ протекания реакции . В: J. Am. Chem. Soc. лента 108 , нет. 24 , 1986, стр. 7664-7678 , DOI : 10.1021 / ja00284a034 .
- ↑ Э. Ведейс включают: Разделы стереохимии. Том 21, 1994, ISBN 0-471-52120-5 .
- ^ A. Streitwieser, CH Heathcock: органическая химия. Verlag-Chemie, 1980, ISBN 3-527-25810-8 .
- ^ Нгуен Чонг Ань: Правила Вудворда-Хоффмана и их применение . Verlag Chemie, 1970, ISBN 3-527-25430-7 .
- ↑ Х.-Дж. Bestmann, R. Armsen, H. Wagner, Chem.Ber . 102, 1969, стр. 2259-2269.
- ↑ BM Trost, DP Curran: Энантионаправленное аннулирование циклопентенона. Синтез полезного строительного блока для конденсированных циклопентаноидных природных продуктов . В: J. Am. Chem. Soc. лента 102 , нет. 17 , 1980, стр. 5699-5700 , DOI : 10.1021 / ja00537a059 .
- ↑ Asknes and Frøyen, Acta Chem. Scand. , 22, 1968, с. 2347.
- ↑ Frøyen: Acta Chem. Scand., Ser. B . 28, 1974, с. 568.
- ↑ Chopard, Hudson, Searle: Tetrahedron Lett. , 1965, с. 2357.
- ↑ Flitsch, Peters: Tetrahedron Lett. , 1969, с. 1161.
- ↑ Гара, Масси-Вестропп и Рейнольдс: Tetrahedron Lett. , 1969, с. 4171.
- ↑ Bestmann, Seng: Tetrahedron . 21, 1965, с. 1373.
- ^ А. Ф. Holleman , Е. Wiberg , Н. Wiberg : Учебник неорганической химии . 81–90. Издание. Вальтер де Грюйтер, Берлин, 1976, ISBN 3-11-005962-2 .