Цепная реакция (химия)
Химическая цепная реакция представляет собой реакцию , в которой событие начала вызывает реакцию чье промежуточный продукт (часто радикалы) в целом или частично служит в качестве отправной точки для одного или более последующих реакций и которая закончилась с помощью реакции обрыва.
сказка
Со времени исследований Макса Планка было известно , что свет состоит из дискретных квантов . Возбуждение одной химической реакции с помощью светового кванта можно было бы объяснить это, но не исключительную чувствительность к свету некоторых реакций, в которых квантовый выход был в порядка 10 4 до 10 6 .
Макс Боденштейн , который в 1899 г. уже завершил свою хабилитацию по газовым реакциям в химической кинетике , в 1913 г. предположил, что это происходит из-за цепной реакции. Это означает, что когда две молекулы вступают в реакцию, может возникнуть не только конечный продукт реакции, но и нестабильные молекулы, которые могут продолжить цепочку.
Датский химик Йенс Антон Кристиансен и голландский физик Хендрик Энтони Крамерс указали в 1923 году, что цепные реакции также могут быть вызваны столкновением двух молекул. Они также исследовали возможность разветвления цепной реакции с возможностью взрыва.
Во время исследований горения фосфора в 1926 году Юли Борисович Харитон и З. Валта обнаружили, что реакция неожиданно замедляется при содержании кислорода выше определенной концентрации. Продолжение этих экспериментов Николаем Николаевичем Семеновым привело к открытию пределов взрыва и подтверждению идей Крамерса и Кристиансена.
Семёнов и Хиншелвуд также исследовали кислородно-водородную реакцию, за что в 1956 г. они были удостоены Нобелевской премии по химии «за исследования механизмов химических реакций» .
Цепные реакции имеют большое техническое и экономическое значение при радикальной и катионной полимеризации. Радикалы хлора имеют большое значение для окружающей среды. В качестве инициаторов цепей они расщепляют около 100 000 молекул озона в цепной реакции и тем самым способствуют разрушению озонового слоя .
Неразветвленная цепная реакция
Если в радикальных цепных реакциях образуется только один радикал на один радикал, говорят о неразветвленных цепных реакциях.
Примером этого является реакция газообразного хлора , в которой водород и хлор реагируют с образованием хлористого водорода в соответствии со следующим уравнением:
Реакция протекает при воздействии или термической активации с участием радикалов водорода и хлора в качестве носителей цепи.
Простое кинетическое описание системы достигается с помощью принципа квазистационарности Боденштейна . Квазистационарный принцип основан на предположении, что концентрация образующихся промежуточных продуктов постоянна во времени, то есть скорость образования равна скорости дальнейшей реакции.
Для общей последующей реакции
с константами скорости реакции и следующими скоростями реакции:
Применяя квазистационарный принцип Боденштейна, предполагается, что концентрация B остается неизменной.
- .
Это приводит к:
и
- .
Цепные реакции с полимерными продуктами
Цепная реакция, имеющая большое экономическое значение, - это радикальная полимеризация олефинов . Так называемый радикальный стартер, такой как пероксид дибензоила, используется для запуска цепи, то есть соединение, которое легко термически или фотолитически расщепляется на радикалы. Он присоединяется к олефину и, таким образом, образует первичный радикал, к которому присоединяются другие олефины с образованием углерод-углеродной связи. Реакция прекращается либо диспропорционированием (самоингибирование), либо добавлением акцепторов радикалов (внешнее ингибирование). Среднюю длину цепи (среднюю степень полимеризации ) можно контролировать через соотношение начальных концентраций радикального инициатора и мономера.
Разветвленные цепные реакции
Если в радикальных цепных реакциях образуется несколько радикалов на один радикал, говорят о разветвленных цепных реакциях.
Реакция гремучая является примером разветвленной цепной реакции , в которой водород и кислород реагируют с образованием воды в соответствии со следующим уравнением:
Реакция протекает с участием водорода, кислорода и гидроксильных радикалов в качестве переносчиков цепи.
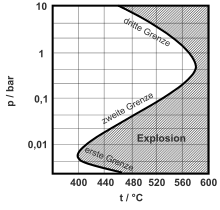
В зависимости от давления, температуры и состава смеси, взрыв произойдет, если реакции разветвления цепи более вероятны, чем реакции обрыва цепи. Если давление слишком низкое или если концентрация кислорода слишком высока, реакции обрыва более вероятны, чем разветвления цепи, и система находится в области ниже нижнего предела взрываемости . При более высоком давлении и правильном соотношении компонентов нижний предел взрываемости превышается, и смесь взрывается. Даже более высокое давление или дальнейшее увеличение концентрации водорода означает, что снова преобладают реакции обрыва цепи, например, в результате рекомбинации, и общая скорость реакции снижается.
Смотри тоже
литература
- WJ Moore, DO Hummel, G. Trafara, K. Holland-Moritz: Физическая химия , 1236 страниц, издательство Gruyter (1986), ISBN 3-11-010979-4
- J. Bülle, A. Hüttermann: Базовые знания в области органической химии , Verlag Wiley-VCH, ISBN 3-527-30847-4 ( ограниченный предварительный просмотр в поиске книг Google), стр. 33.
Индивидуальные доказательства
- ↑ Вступление о цепной реакции . В: Сборник химической терминологии ИЮПАК («Золотая книга») . DOI : 10.1351 / goldbook.C00960 .
- ^ Справочник по сточным водам и технологиям рециркуляции для металлообрабатывающей промышленности , Людвиг Хартингер.
- ↑ М. Боденштейн: О кинетике взрыва газообразного хлора. Z. Phys. Chem. 85 (1913) 329.
- ↑ J. A. Christiansen, HA Kramers: Z. Phys. Chem.104 (1923) 451.
- ↑ Магистр современной физики: научный вклад Х.А. Крамерса , Д. тер Хаар.
- ↑ Николай Николаевич Семенов: Некоторые проблемы цепных реакций и теории горения (PDF; 133 kB), Нобелевская премия 1956 г.
- ^ Сирил Норман Хиншелвуд: Химическая кинетика в последние несколько десятилетий (PDF; 54 kB), лекция Нобелевской премии 1956 г.
- ↑ Хлор в мире: или хорошо, плохо? , Дэвид П. Гилки и Холли А. Уильямс.
- ^ Полистирол Германом Гаузеполем, Д. Брауном, Роландом Геллертом.











![{\ displaystyle {\ frac {\ mathrm {d} [\ mathrm {A}]} {\ mathrm {d} t}} = - k_ {1} [\ mathrm {A}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/50e3aaf5b967cf21c0ab1666383a475ad7544626)
![{\ displaystyle {\ frac {\ mathrm {d} [\ mathrm {B}]} {\ mathrm {d} t}} = k_ {1} [\ mathrm {A}] -k_ {2} [\ mathrm { B}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0ba39fe5cc400b9e2bcb3ac6a2995c62d9c139d8)
![{\ displaystyle {\ frac {\ mathrm {d} [\ mathrm {C}]} {\ mathrm {d} t}} = k_ {2} [\ mathrm {B}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f375670c8eacfbdb53f8bfc8d7f9569b88bc4e06)
![{\ displaystyle {\ frac {\ mathrm {d} [\ mathrm {B}]} {\ mathrm {d} t}} = 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b385dc648bbcbe00b8b9317f05f78d69ed63a9dd)
![{\ displaystyle {\ frac {\ mathrm {d} [\ mathrm {B}]} {\ mathrm {d} t}} = 0 = k_ {1} [\ mathrm {A}] -k_ {2} [\ mathrm {B}] \ Rightarrow \; [\ mathrm {B}] = {\ frac {k_ {1}} {k_ {2}}} [\ mathrm {A}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05d34a40fbf6262c42f39643ad8b4aa3a864ceba)
![{\ displaystyle {\ frac {\ mathrm {d} [\ mathrm {C}]} {\ mathrm {d} t}} = k_ {1} [\ mathrm {A}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/229b92c3170bf7c912a1458c96ec23e354dc6d00)
![{\ displaystyle [\ mathrm {C}] = [\ mathrm {A}] _ {0} \ left (1- \ mathrm {e} ^ {- k_ {1} t} \ right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c2b7c1322906da6604ba54303c98cddde17576a8)