Нитрофенолы
| Нитрофенолы | ||||||||
| Фамилия | 2-нитрофенол | 3-нитрофенол | 4-нитрофенол | |||||
| Другие названия |
о- нитрофенол, 1-гидрокси-2-нитробензол |
м- нитрофенол, 1-гидрокси-3-нитробензол |
п -нитрофенол, 1-гидрокси-4-нитробензол |
|||||
| Структурная формула |
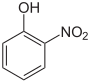
|

|
|
|||||
| Количество CAS | 88-75-5 | 554-84-7 | 100-02-7 | |||||
| PubChem | 6947 | 11137 | 980 | |||||
| Молекулярная формула | C 6 H 5 НЕТ 3 | |||||||
| Молярная масса | 139,11 г моль -1 | |||||||
| Физическое состояние | твердо | |||||||
| Краткое описание |
желтоватые иглы или призмы |
бесцветные кристаллы |
бесцветные хрустальные иглы |
|||||
| Температура плавления | 44 ° С | 97 ° С | 113-115 ° С | |||||
| точка кипения | 214 ° С | 194 ° C (93 мбар) | Разложить. | |||||
| значение pK s | 7.21 | 8,38 | 7,16 | |||||
| растворимость | 2,1 г / л (20 ° С) | 13,5 г / л (25 ° С) | 14,8 г / л (25 ° С) | |||||
| Слабо растворим в воде, растворим в этаноле, эфире и хлороформе. | ||||||||
|
Маркировка GHS |
|
|
|
|||||
| H- и P-фразы | 302-312-332-410 | 302-319 | 301-312-332-373 | |||||
| нет фраз EUH | нет фраз EUH | нет фраз EUH | ||||||
|
273-280-302 + 352 304 + 340-305 + 351 + 338-312 |
305 + 351 + 338 |
261-301 + 310-330 302 + 352-304 + 340-312 |
||||||
В химии нитрофенолы образуют группу веществ, производных как фенола, так и нитробензола . Структура состоит из бензольного кольца с присоединенными гидроксилом (-ОН) и нитрогруппой (-NO 2 ) в качестве заместителей . Их различное расположение приводит к трем структурным изомерам с эмпирической формулой C 6 H 5 NO 3 . Чаще всего они доступны при нитровании фенола (концентрированной) азотной кислотой . Помимо прочего, они выделяются желтым цветом.
презентация
2- и 4-нитрофенол образуются в смеси при нитровании фенола разбавленной азотной кислотой. -I эффект и эффект + М гидроксильной группы фенола имеют орто-пара-направляя действие на второй замену. Разделение удается путем перегонки с водяным паром , в результате чего проходит только о- нитрофенол. Новые методы разделения основаны на том факте, что в н- пентане растворим только о- нитрофенол .
Оба изомера могут быть дополнительно нитрованы до 2,4-динитрофенола и пикриновой кислоты .
Получение 3-нитрофенола осуществляется в две стадии, сначала путем галогенирования (например, Cl. 2 / AlCl 3 ) нитробензола (мета-направляющая группа); Затем атом галогена заменяется на ОН при нуклеофильном ароматическом замещении :
Другой способ заключается в диазотирования из 3-нитроанилина и последующего кипячения соли диазония.
характеристики
Нитрофенолы представляют собой твердые кристаллические вещества; они мало растворимы в воде, растворимы в этаноле, эфире и хлороформе. 4-Нитрофенол имеет слабый запах фенола.
значения pK s
Слабо кислотный характер фенола происходит из - за мезомерное стабилизации в феноляте иона. Нитрогруппы обладают электроноакцепторным эффектом; фенольная связь ОН становится все более поляризованной. 2- и 4-нитрофенол имеют более низкую pK по сравнению с значением s для 3-нитрофенола ; поэтому их кислотность выше. В орто- и пара-форме фенолят-ион может сдвигать двойную связь к электроноакцепторной нитрогруппе ( -M эффект ). Второй О может образовывать там отрицательный центр тяжести. Это невозможно с мета-формой.
Точки плавления
Температуры плавления явно различаются. 2-нитрофенол , имеющий самую низкую температуру плавления, так как есть внутри -molecular водородной связи может быть сформирована. Напротив, два других изомера образуют межмолекулярные водородные связи. При использовании 2-нитрофенола для разрушения этих мостиков энергия не требуется. Из-за своей симметрии 4-нитрофенол имеет самую высокую температуру плавления.
Растворимость в воде
Нитрофенолы плохо растворимы в воде, но значения в этой группе различаются. Значительно меньшая растворимость 2-нитрофенола в воде также хорошо объясняется внутримолекулярной водородной связью. В результате молекула явно менее полярна снаружи. Напротив, растворимости 3- и 4-нитрофенола примерно одинаковы и, по сравнению, значительно лучше. Вот теперь образуют скорее между фенольного гидроксила и воды между -molecular водородных связей.
доказательство
Для получения качественного и аналитического доказательства, бромирование с бромидом калия и бромом с 2-нитрофенолом дает производное 4,6-дибр, который имеет температуру плавления 117 ° С В случае 4-нитрофенола образуется 2,6-дибромпроизводное с температурой плавления 142 ° C. 3-Нитрофенол также дважды бромируют с помощью KBr / Br 2 ; продукт плавится при 91 ° C.
использовать
Нитрофенолы встречаются в химической, фармацевтической и оборонной промышленности в качестве промежуточных продуктов при производстве красок, кожи, резины, пестицидов, фунгицидов, пестицидов и боеприпасов.
Инструкции по технике безопасности
Нитрофенолы токсичны при вдыхании, проглатывании и попадании на кожу. Может возникнуть раздражение глаз и пищеварительного тракта, заражение крови, повреждение печени, головокружение, тошнота, головная боль и раздражение дыхательных путей. Они могут иметь канцерогенное и сенсибилизирующее действие. В сочетании с алкоголем эффект усиливается. При попадании на кожу немедленно смойте большим количеством воды. Они оказывают токсическое действие на нервную систему живых существ.
Серьезной проблемой является удаление нитрофенолов и родственных соединений из грунтовых вод. Такое загрязнение иногда можно обнаружить на бывших заводах по производству взрывчатых веществ или красок и на военных объектах. Новой разработкой для полного удаления нитрофенолов из грунтовых вод является катализатор, который состоит из железа с тетраамидо- макроциклическим лигандом (Fe-TAML) и позволяет токсинам окисляться перекисью водорода . Других токсичных веществ нет. Катализатор был разработан в Университете Карнеги-Меллона.
Смотри тоже
литература
- Аллинджер , Кава , де Йонг , Джонсон , Лебель , Стивенс : органическая химия. Вальтер де Грюйтер, Берлин 1980, ISBN 3-11-004594-X , стр. 375-376, 916.
- Streitwieser, Heathcock: органическая химия. VCH, Weinheim 1980, ISBN 3-527-25810-8 , стр. 1056, 1179, 1189-1191.
- Ханс Бейер , Вольфганг Вальтер : Учебник органической химии. 19-е издание, S. Hirzel Verlag, Штутгарт 1981, ISBN 3-7776-0356-2 , стр. 467-468.
- Моррисон, Бойд: Учебник органической химии. 3-е издание, VCH, Weinheim 1986, ISBN 3-527-26067-6 , стр. 1074-1076, 1121-1122.
веб ссылки
Индивидуальные доказательства
- ↑ б с д й вход на 2-нитрофеноле в базе данных GESTIS субстанции в МРСЕ , доступ к 12 марта 2017 года. (Требуется JavaScript)
- ↑ б с д е запись на 3-нитрофеноле в базе данных GESTIS вещества в IFA , доступ к 12 марта 2017 года. (Требуется JavaScript)
- ↑ б с д е запись на 4-нитрофеноле в базе данных GESTIS вещества в IFA , доступ к 12 марта 2017 года. (Требуется JavaScript)
- ↑ Справочник CRC по таблицам для идентификации органических соединений , третье издание, 1984 г., ISBN 0-8493-0303-6 .
- ↑ Спецификация теста: Нитрование фенола до 2-нитрофенола и 4-нитрофенола (PDF) из сборника интегрированной органико-химической стажировки в Университете Регенсбурга, по состоянию на 30 октября 2011 г.
- ↑ A. Khazaei, MA Zolfigol, AR Moosavi-Zare, A. Zare: Эффективный метод нитрования фенолов NaNO 2 в присутствии хлорида имидазолия 3-метил-1-сульфоновой кислоты . В: Scientia Iranica . Лента 17 , нет. 1 , 2010, с. 31–36 ( PDF - полный текст).
- ↑ Хайнц Г.О. Беккер (Ред.): Органикум . 19-е издание. Иоганн Амброзиус Барт, Deutscher Verlag der Wissenschaften, Лейпциг / Берлин / Гейдельберг 1993, ISBN 3-335-00343-8 , стр. 331 .
- ↑ Ф. Уайлд: Характеристика органических соединений . Архивы CUP, Кембридж, 1947, стр. 84 ( ограниченный предварительный просмотр в поиске Google Книг).
- ↑ Ф. Уайлд: Характеристика органических соединений . Архивы CUP, Кембридж, 1947, стр. 86 ( ограниченный предварительный просмотр в поиске Google Книг).
- ↑ Хайнц Г.О. Беккер (Ред.): Органикум . 19-е издание. Иоганн Амброзиус Барт, Deutscher Verlag der Wissenschaften, Лейпциг / Берлин / Гейдельберг 1993, ISBN 3-335-00343-8 , стр. 653 .
- ↑ Катализатор разрушает нитрофенол. ( Памятка от 1 декабря 2016 г. в Интернет-архиве ) В: Welt online . 30 августа 2005 г.
- ↑ Сумен Кунду, Арани Чанда, Джаспер В.К. Томпсон, Джордж Диабес, Сушил К. Хетан, Александр Д. Рябов, Терренс Дж. Коллинз: Быстрая деградация устойчивых к окислению нитрофенолов активатором TAML и H 2 O 2 . В: Наука и технологии катализа . Лента 5 , вып. 3 , 2015, с. 1775-1782 , DOI : 10.1039 / C4CY01426J .










