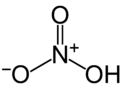
азотная кислота
| Структурная формула | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Общий | ||||||||||||||||
| Фамилия | азотная кислота | |||||||||||||||
| Другие названия |
|
|||||||||||||||
| Молекулярная формула | ЛОР 3 | |||||||||||||||
| Краткое описание |
в чистом виде бесцветная жидкость, частично разложенная под действием света или тепла до оксидов азота от желтого до красного цвета |
|||||||||||||||
| Внешние идентификаторы / базы данных | ||||||||||||||||
| ||||||||||||||||
| характеристики | ||||||||||||||||
| Молярная масса | 63.01 г моль -1 | |||||||||||||||
| Физическое состояние |
жидкость |
|||||||||||||||
| плотность |
1,51 г см −3 (20 ° С) |
|||||||||||||||
| Температура плавления |
−42 ° С |
|||||||||||||||
| точка кипения |
86 ° С |
|||||||||||||||
| Давление газа |
56 гПа (20 ° C) |
|||||||||||||||
| p K S значение |
−1,37 |
|||||||||||||||
| растворимость |
Смешивается с водой во всех пропорциях, бурная реакция с этанолом |
|||||||||||||||
| Инструкции по технике безопасности | ||||||||||||||||
| ||||||||||||||||
| MAK |
|
|||||||||||||||
| Токсикологические данные | ||||||||||||||||
| Насколько это возможно и обычно, используются единицы СИ . Если не указано иное, приведенные данные относятся к стандартным условиям . | ||||||||||||||||
Азотная кислота (HNO 3 ), также известная как септические жидкости , является наиболее известными и наиболее стабильным кислородом кислоты из азота . Кислота производится в промышленных масштабах с 1908 года с использованием процесса Оствальда каталитическим окислением аммиака. Аммиак ранее производился из атмосферного азота и водорода с использованием процесса Габера-Боша .
Эти соли азотной кислоты называются нитратами . Название азотная кислота происходит от общепринятых названий некоторых солей щелочных и щелочноземельных металлов кислоты, которые заканчиваются названием азотная, например Например: нитрат натрия ( нитрат Чили), нитрат калия ( нитрат калия), нитрат аммония (нитрат аммония ), нитрат кальция ( нитрат извести или нитрат каменщика), нитрат бария ( нитрат барита). До 1908 года азотную кислоту получали из различных типов азотной кислоты путем добавления сильной, малолетучей кислоты (серной кислоты). Название солей нитратов азотной кислоты очень часто используется для обозначения некоторых органических соединений азотной кислоты, а именно сложных эфиров азотной кислоты. Итак, з. Например, метиловый эфир азотной кислоты называется метилнитратом (см. Также нитраты ), хотя условия связывания в сложных эфирах полностью отличаются от таковых в солях. Ситуацию усложняет и увеличивает путаницу тот факт, что некоторые особые эфиры азотной кислоты не называются ни сложными эфирами, ни нитратами в разговорной речи. Б. Нитроглицерин (правильное название: глицериновый эфир трис-азотной кислоты) или нитроцеллюлоза или нитрат целлюлозы .
Как сильная неорганическая кислота, азотная кислота в значительной степени диссоциирует в водном растворе и является одной из минеральных кислот . Чистая кислота бесцветна и имеет резкий резкий запах. Среди прочего, он используется для производства удобрений, красителей и взрывчатых веществ.
история
В письме Deventione veritatis XII века упоминается, что еще в IX веке арабский алхимик Гебер использовал сырую азотную кислоту («Aqua disolutiva») путем сухого нагревания селитры ( лат. Sal petrae = каменная соль; KNO 3). ), Киприан купорос (CuSO 4 · 5 H 2 O) и квасцов (Кал (SO 4 ) 2 · 12 Н 2 О) , как говорят, были получены. Говорят, что в 13 веке Альберт Великий использовал азотную кислоту для разделения золота и серебра (разделение воды, aqua fortis ). Однако многие сочинения были приписаны Альберту Магнусу только для того, чтобы придать им больший вес, вероятно, в том числе и об использовании азотной кислоты. Позже селитру нагревали с железным купоросом (FeSO 4 · 7 H 2 O), который давал более высокие выходы при более низких температурах.
В середине 17 века Дж. Р. Глаубер получил чистый spiritus nitri путем преобразования и дистилляции азотной кислоты с серной кислотой , лабораторный процесс, который до сих пор используется для производства азотной кислоты, которую в средние века также называли aqua fortis или aqua valens и в англоязычном мире назывался сильной водой . В середине 18 века А.Л. Лавуазье признал химические элементы азот и кислород как компоненты азотной кислоты . Точный состав был определен Генри Кавендишем , которому также удалось синтезировать его из азота воздуха с помощью электрического разряда .
Эффективное производство не началось до начала 19 века, когда дешевая серная кислота и чилийская селитра были доступны в достаточных количествах. Сжигание воздуха в электрической дуге также превратилось в крупномасштабный процесс (процесс Биркеланда-Эйда после Кристиана Биркеланда и Сэма Эйда ), но он был конкурентоспособным только в странах с дешевой электроэнергией . Каталитическое окисление аммиака над платиной было открыто CF Kuhlmann (1838). До изобретения синтеза аммиака по Haber и Bosch , однако, аммиак оставался слишком дорогим по сравнению с нитратом Чили. В начале 20 века Вильгельм Оствальд развил производство азотной кислоты от аммиака до промышленной зрелости. Дешевое окисление аммиака теперь заменило все другие крупномасштабные процессы.
Производство

Азотная кислота технически производится с 1908 года по технологии Оствальда . Это каталитическое окисление из аммиака . Аммиак-воздух смесь пропускает быстро (1/1000 сек времени контакта) через горячие платины - родий сети ( катализатор ). При 800 ° C образуется монооксид азота , который при охлаждении реагирует с избытком кислорода с образованием диоксида азота, а затем в колоннах с водой с образованием около 60% азотной кислоты. 60% азотная кислота может быть сконцентрирована перегонкой до 68%, что соответствует азеотропу с максимальной температурой кипения (122 ° C). Более высокие концентрации могут быть достигнуты ректификацией (дегидратацией) серной кислотой (H 2 SO 4 ) или водным раствором нитрата магния (Mg (NO 3 ) 2 ) или обработкой тетроксида азота (N 2 O 4 ) стехиометрически необходимым количеством кислород (или воздух) и вода.
В лабораторных условиях азотная кислота может быть произведена путем реакции концентрированной серной кислоты с нитратами . До 1908 года азотная кислота была получена этим способом с использованием нитрата натрия ( нитрата Чили ).
Часто встречающееся загрязнение кислоты галогенами или галогенидами водорода можно удалить путем добавления нитрата серебра и последующей отгонки. Безводную азотную кислоту получают, исходя из высококонцентрированной кислоты, путем перегонки, пропускания через инертный газ или перегонки над пентоксидом фосфора или олеумом .
характеристики
Азотная кислота в чистом виде бесцветна. Однако концентрированная азотная кислота легко разлагается (особенно под воздействием света) и часто имеет желтоватый или красноватый оттенок из-за растворенного в ней диоксида азота (NO 2 ).
Чистая азотная кислота, содержащая свободный диоксид азота, называется дымящей азотной кислотой. Он содержит более 90% HNO 3 , обладает сильным окислительным действием и может воспламенить некоторые легковоспламеняющиеся вещества; поэтому азотная кислота от 70% считается окислительной . Азотная кислота, которая окрашивается в желтый цвет из-за растворенного диоксида азота, может быть обесцвечена небольшим количеством мочевины или, что лучше, нитрата мочевины .
Азотная кислота является одновременно сильным окислителем и сильной кислотой . Неметаллические элементы, такие как углерод , йод , фосфор и сера , окисляются концентрированной азотной кислотой до их оксидов или оксокислот с образованием диоксида азота , например
Кроме того, многие соединения окисляются азотной кислотой. Соляная кислота окисляется до хлора и диоксида хлора .
Нитраты , соли азотной кислоты, образуются при взаимодействии металлов или их оксидов , гидроксидов или карбонатов с азотной кислотой. Большинство нитратов растворимы в воде, а азотная кислота в основном используется для производства растворимых нитратов металлов.
Азотная кислота реагирует с большинством металлов с образованием водорастворимых нитратов. Исключение составляют драгоценные металлы, золото , платина и иридий . Кроме того, алюминий , титан , цирконий , гафний , ниобий , тантал и вольфрам выдерживают пассивацию азотной кислотой . Кроме того, в результате пассивации железо устойчиво к холоду, а хром также устойчив к горячей азотной кислоте. На металле образуется плотно прилегающий непроницаемый оксидный слой. Так как золото и серебро можно было разделить таким образом, это раньше называлось разделением воды . Смеси азотной кислоты с соляной кислотой ( царская водка ) или селеновой кислотой также реагируют с золотом и платиной.
Азотная кислота цвета белки , которые содержат ароматические аминокислоты , такие как L - фенилаланин или L - тирозин - желтый с нитрование на бензольное кольцо . Эта ксантопротеиновая реакция может быть использована для обнаружения ароматических аминокислот и белков.
| Вес% HNO 3 | 0 | 10 | 20-е | 30-е | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|
|
Плотность (г / см 3 ) |
1,00 | 1.05 | 1,12 | 1.18 | 1,25 | 1,31 | 1,37 | 1,42 | 1,46 | 1,48 | 1,513 |
|
Вязкость (мПа · с) |
1,00 | 1.04 | 1.14 | 1,32 | 1,55 | 1,82 | 2,02 | 2,02 | 1,84 | 1,47 | 0,88 |
| Т.пл. (° C) | 0 | −7 | −17 | −36 | −30 | −20 | −22 | −41 | −39 | −60 | -42 |
| Bp (° C) | 100,0 | 101,2 | 103,4 | 107,0 | 112,0 | 116,4 | 120,4 | 121,6 | 116,6 | 102,0 | 86,0 |
| p (HNO 3 ) (мбар) | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,3 | 1.2 | 3.9 | 14.0 | 36,0 | 60,0 |
| p (H 2 O) (мбар) | 23,3 | 22,6 | 20,2 | 17,6 | 14,4 | 10,5 | 6.5 | 3.5 | 1.2 | 0,3 | 0,0 |
| HNO 3 (моль / л) | 1,7 | 3,6 | 5,6 | 7.9 | 10,4 | 13,0 | 15,8 | 18,5 | 21 год | 24.01 |
использовать
Азотная кислота - одно из важнейших сырьевых материалов в химической промышленности. Она служит:
- для производства нитратов и удобрений ,
- как разделяющая вода для разделения ( квартования ) золота и серебра (серебро реагирует с образованием растворимого нитрата серебра ),
- в смесях с соляной кислотой в качестве царской водки для растворения золота, а также для золочения и обнаружения золота,
- для травления и обжига металлов (графическая и гальваническая техника),
- для нитрования органических веществ при производстве красителей , лекарств , дезинфицирующих средств и взрывчатых веществ, таких как нитроглицерин или пушечный хлопок ,
- для производства целлулоида , нитролаков и цапоновых лаков ,
- для замены жиров (растворимость в воде) в целях очистки,
- для полировки металлов,
- в ракетном топливе в качестве окислителей ( WFNA и RFNA ).
доказательство
Как и нитраты, азотная кислота может быть обнаружена в лаборатории с помощью кольцевого теста и реагента Люнге .
Инструкции по технике безопасности
Азотная кислота оказывает разъедающее действие на кожу, дыхательные пути и слизистые оболочки. Вдыхание паров может вызвать токсический отек легких . Эта опасность возникает особенно при нагревании или при использовании концентрированной кислоты. В высоких концентрациях он является сильным окислителем и обладает огнестойким действием. Азотная кислота реагирует с большинством металлов с образованием токсичного диоксида азота . При работе с азотной кислотой необходимо использовать защитные очки или маску для лица, подходящие защитные перчатки и закрытую рабочую куртку. Если существует риск выделения паров азотной кислоты или оксидов азота в помещении, необходимо надеть дыхательный аппарат. По этой причине азотная кислота не подходит для бытовых чистящих средств. Работа в лаборатории всегда выполняется в вытяжном шкафу. Для бутылок с концентрированной азотной кислотой рекомендуется использовать тефлоновую крышку.
Смотри тоже
- Азотистая кислота (HNO 2 )
веб ссылки
- Актуальная для школы информация об азотной кислоте на сайте www.seilnacht.com, преподавание естественных наук .
Индивидуальные доказательства
- ↑ Введение по азотной кислоте. В: Römpp Online . Георг Тиме Верлаг, по состоянию на 12 ноября 2014 г.
- ↑ б с д е е г ч запись на азотной кислоте в базе данных GESTIS вещества в IFA , доступ к 8 января 2021 года. (Требуется JavaScript)
- ↑ CCI ETH: таблица pK s
- ↑ Технический паспорт 100% -ной азотной кислоты (PDF) от Merck , по состоянию на 23 января 2018 г.
- ↑ Вступление в азотной кислоте ...% в классификации и маркировки Перечня в Европейское химическое агентство (ECHA), доступ к 24 января 2017. Производители или дистрибьюторы могут расширить гармонизированной системы классификации и маркировки .
- ↑ Комитет по опасным веществам (АГС) из в Федеральный институт по охране труда и здоровья (BAuA) : Технические правила для опасных веществ (TRGS) 900 ( PDF ), доступ к 10 июня 2014 года.
- ↑ Швейцарский фонд страхования от несчастных случаев (Сува): предельные значения - текущие значения MAK и BAT (поиск 7697-37-2 или азотная кислота ), по состоянию на 2 ноября 2015 г.
- ↑ Паспорт безопасности Bernd Kraft, по состоянию на 29 мая 2019 г. PDF , по состоянию на 20 января 2020 г.
- ↑ Томас Гляйнзер: Бернская «Фармакопея» Анны фон Дисбах в версии Эрлахера Даниэля фон Вердтса (1658 г.), Часть II: Глоссарий. (Медицинская диссертация в Вюрцбурге), сейчас находится в Königshausen & Neumann, Würzburg 1989 (= Вюрцбургское медико-историческое исследование. Том 46), стр. 38.
- ↑ Г. Брауэр (ред.), Справочник по препаративной неорганической химии , 2-е изд., Т. 1, Academic Press, 1963, стр. 491-492.
- ↑ Эрвин Ридель , Кристоф Джаниак : Неорганическая химия. 8-е издание. де Грюйтер , 2011 г., ISBN 3-11-022566-2 , стр. 458.
- ↑ M. Thiemann, E. Scheibler, KW Wiegand: Азотная кислота, азотная кислота и оксиды азота в Ullmanns Enzyklopädie der Technischen Chemie , Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2005, doi : 10.1002 / 14356007.a17_ .
- ↑ Томас Зайльнахт: преподавание естественных наук , азотная кислота и Томас Зайльнахт: DVD-ROM по химии , Seilnacht Verlag & Atelier, Берн 2017.








