Амины
Когда амины являются органическими соединениями, которые, в конечном счете, являются производными аммиака (NH 3 ), и в которых один, два или все три атома водорода аммиака замещены алкильными или арильными группами , или в более или менее различных гетероциклических кольцевых системах, собраться вместе. Поскольку амины могут также содержать более одного атома азота, количество возможных аминов настолько велико, а их структуры настолько различны, что структуры и свойства не могут быть представлены в одной статье. Циклические амины упоминаются лишь вскользь; поэтому ссылка делается на статью Heterocyclen .
Систематика нециклических аминов
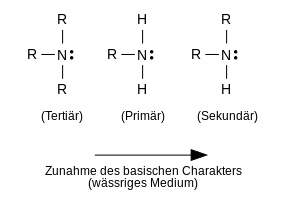
В общем, можно различать три основных типа нециклических аминов. По количеству атомов водорода , которые были заменены на органические алкильные или арильные группы в аммиаке, говорят о первичных, вторичных и третичных аминах. В зависимости от типа групп, связанных с атомом N, эти три типа также можно более точно называть алифатическими, ароматическими или смешанными алифатико-ароматическими аминами. Если атом C, связанный с атомом N, является частью двойной связи CC, такой как, например, Б. В этенамине ситуация осложняется, поскольку такие соединения образуют таутомерные формы .
Амины также могут содержать два атома N (аминогруппы), связанные с разными атомами углерода; затем говорят о диаминах , которые тоже могут быть разных типов. Если - как в случае алифатического вторичного амина - есть две алкильные группы, связанные с атомом N, обе алкильные группы также могут быть замкнуты с образованием кольца. Затем говорят о циклических вторичных аминах, таких как. Б. пиперидин . Замыкание кольца также может иметь место в случае диаминов, например Б. пиперазин . Такие циклические амины без двойных связей CC в кольцевой системе принадлежат к очень большой и очень изменчивой группе гетероциклических аминов, но ведут себя как нормальные нециклические амины.
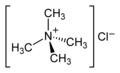
Все амины можно превратить в соединения четвертичного аммония путем алкилирования . Следовательно, четвертичные аммониевые соединения не являются аминами, а принадлежат к другому, отдельному классу соединений, которые являются производными соответствующих аминов. Таким образом, четвертичное аммониевое соединение, показанное в таблице в конце, не является амином, а является солью четвертичного аммония простейшего типа.
| Амины и соли аммония | |||||
|---|---|---|---|---|---|
| Типы | Функциональная группа | пример | |||
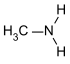
| первичные амины | R-NH 2 | первичная аминогруппа | R-NH 2 | Метиламин |
|
| вторичные амины | RNH-R | вторичная аминогруппа | R-NH-R | Диметиламин |

|
| третичные амины | № 3 | третичная аминогруппа | R-NR 2 | Триметиламин |

|
| без аминов, но соединения четвертичного аммония |
NR 4 + (X - ) | четвертичная аммониевая группа | R-NR 3 + |
Тетраметиламмоний хлорид |
|
| Для получения дополнительных примеров см. Категория: Амин и Категория: Соединение четвертичного аммония. | |||||
характеристики
Химические свойства
Алифатические амины
Как и аммиак, все алифатические амины являются более или менее сильными основаниями, потому что протон может быть присоединен к неподеленной паре электронов на атоме N. Мерой силы основания амина является константа основания амина или кислотная константа связанного катиона аммония, выраженная величиной основания или величиной катиона аммония. Эти значения предоставляют информацию о положении следующего равновесия для протонирования первичного амина водой и, таким образом, информацию о силе основания амина или кислотной силе связанного катиона аммония:
Поскольку катионы аммония, полученные при протонировании, обычно более растворимы в воде, чем исходные амины, экстракция водной соляной кислотой является самым простым методом отделения аминов от других неосновных органических веществ. Тип замещения и степень замещения могут сильно влиять на основность аминов. В алифатических аминах алкильные группы в качестве заместителей увеличивают электронную плотность на атоме азота из-за их «электронодонорного» эффекта ( индуктивный эффект , + I-эффект ). Следовательно, можно ожидать, что неподеленная пара электронов на атоме N будет протонироваться все более и более легко, когда количество алкильных групп на атоме N (степень замещения) увеличивается. Однако это применимо только в том случае, если нет других разрушительных эффектов, таких как Б. Гидратация аминов и катионов аммония, образованных молекулами воды, становится эффективной. Если нарушений нет, то говорят о так называемой кислотности газовой фазы . В таких безводных условиях основность алифатических аминов, как и ожидалось, возрастает с увеличением замещения. Это означает, что алифатические амины также являются более сильными основаниями, чем аммиак, в следующем порядке:
Аммиак <первичный <вторичный <третичный.
В присутствии воды гидратация аммиака и аминов и катионов аммония высвобождает тепло гидратации, большая часть которого связана с первичными аминами и меньше всего - с третичными аминами. Очевидно, что с увеличением степени замещения гидратация затрудняется стерически. Эти эффекты приводят к изменению последовательности основности в водных растворах:
В водном растворе алифатические амины имеют следующий порядок основности:
третичное <первичное <вторичное.
Описанные градации и значительно ниже основность третичных аминов в водных растворах также отражены в и значении аммиака и три простейших алкиламинов .
- Аммиак: 9,25; = 4,75;
- Метиламин : 10,6; = 3,4; (все первичные алифатические амины имеют аналогичные значения).
- Диметиламин : 10,8; = 3,2;
- Триметиламин : 9,8; = 4,2;
Ароматические амины
Хотя основность алифатических аминов выше, чем у аммиака из-за + I-эффекта алкильных групп, основность ароматических аминов значительно ниже, чем основность аммиака. Вот почему значение простейшего ароматического аминоанилина составляет 9,37, что значительно выше, чем у аммиака с 4,75. Делокализация неподеленной пары электронов на атоме азота в ароматической системе фенильного кольца стабилизирует депротонированную форму, а ароматические амины значительно менее основны, чем аммиак или алифатические амины (формально эффект -M). Другие электроноакцепторные заместители в ароматической кольцевой системе анилина, такие как. B. Нитрогруппа в нитроанилинах может еще больше резко снизить основность.
Гетероциклические амины
Свойства циклических аминов сильно различаются в зависимости от типа кольцевых систем, которые могут состоять из нескольких по-разному связанных кольцевых систем самых разных типов и не могут быть описаны в общих чертах. Так что веди себя з. B. Циклические амины с неароматическими кольцевыми системами без двойных связей, такие как. B. пиперидин , такой как нормальные вторичные алифатические амины. Напротив, циклический амин с кольцевой системой и тремя сопряженными двойными связями, пиридин , не ведет себя как обычный третичный алифатический амин. Амины этого типа также являются основаниями, но обладают очень разными свойствами и образуют новый класс собственных соединений: ароматические, гетероциклические амины.
Физические и физиологические свойства
Алифатические амины, такие как монометиламин , диметиламин и триметиламин, а также этиламин являются газообразными при комнатной температуре. Многие другие гомологичные соединения являются жидкими, а некоторые даже более гомологичные амины, такие как, например, Б. Дециламин твердый при комнатной температуре.
Самый простой ароматический амин анилин - жидкий. Многие замещенные анилины и другие ароматические амины с несколькими ароматическими кольцевыми системами, такие как. Б. Нафтиламины твердые.
Благодаря своей полярности и основности амины более растворимы в воде, чем углеводороды с тем же числом атомов углерода. Растворимость алифатических аминов в воде уменьшается с увеличением длины алкильных цепей. Ароматические амины не растворяются в воде. Жидкие первичные и вторичные алифатические и ароматические амины, являются водородными связями , связанными . Подобно спиртам , это приводит к более высоким температурам кипения по сравнению с аналогичными углеводородами.
Газообразные алифатические амины раздражают слизистые оболочки глаз и дыхательные пути. При смачивании кожи жидкими алкиламинами также возникают химические ожоги. Отравление при вдыхании более высоких концентраций может вызвать повышение артериального давления и кратковременные судороги. Ароматические амины не вызывают раздражения из-за их более низкой основности и более низкой летучести, но они значительно более токсичны, чем алифатические амины, например Б. анилин .
Газообразные алифатические амины имеют похожий, но также «рыбный, гнилостный» запах на аммиак. Более высокие гомологи и ароматические или гетероциклические амины также имеют запах, который люди воспринимают как неприятный, например, фекалии ( индол , скатол ) или разлагающегося мяса ( кадаверин , путресцин ), мочи или старой рыбы ( метил , этил и триметиламин ). Такие соединения могут возникать в качестве промежуточных или конечных продуктов в анаэробной деградации биологического материала, в частности белков , или через декарбоксилирование из аминокислот . Для характерного запаха спермы является спермин линейным полиамин - - с двумя первичными и двумя вторичными аминогруппами, ответственными.
С другой стороны, многие лекарственные средства также принадлежат к группе аминов, особенно часто к подгруппе гетероциклических аминов, таких как. B. атропин , амфетамин , хинин , кодеин и кофеин , а также такие наркотики. Б. метамфетамин , кокаин , никотин .
Производство, создание
Идея о том, что амины путем алкилирования аммиака з. Б. легко может быть представлен алкилгалогенидами - это заблуждение не только потому, что аммиак газообразный. Алкилирование аммиака привело бы к смесям всех стадий алкилирования, поскольку первоначально образовавшиеся первичные амины даже предпочтительно дополнительно алкилируют до вторичных аминов, от них до третичных аминов и, наконец, до солей четвертичного аммония.
Первичные амины
Для целевого получения первичных аминов доступны следующие важные методы:
- Синтез Габриэль часто используется. В этой реакции фталимид сначала реагирует с соответствующим алкилгалогенидом, а затем полученный алкилфталимид обрабатывается раствором гидроксида натрия путем гидролиза или, лучше, с гидразином путем гидразинолиза, чтобы высвободить первичный амин.
- В качестве альтернативы, алкилгалогениды могут взаимодействовать с азидом натрия с образованием алкилазидов , которые затем восстанавливаются до первичных аминов с помощью алюмогидрида лития .
- При удлинении цепи алкилгалогенид реагирует с цианидом натрия с образованием нитрила , который затем восстанавливается до первичного амина.
- Хофман метод карбоксамида деградации также производит первичные амины, хотя углеродная цепь сокращается на один атом углерода.
- Другим способом синтеза первичных аминов с укорочением цепи является реакция Курциуса , в которой амин получают путем расщепления ацилгидразида.
Вторичные амины
- Вторичные амины могут быть получены из первичных аминов путем реакции первичного амина R'-NH2 с альдегидом R-CH = O с образованием имина (R-CH = N-R «), который затем снижается до вторичного амина путем гидрирования двойная связь становится.
Третичные амины
Реакция Лейкарта-Валлаха подходит для получения третичных аминов .
Ароматические амины
Ароматические амины получают нитрованием и последующим восстановлением (например, анилин , толуидин ).
Технические процедуры
- Технические процессы производства аминов - это реакции аммиака со спиртами (→ см. Аминирование спиртов ). Б. алкиламины, такие как метил и этиламин, которые затем необходимо разделить. Альдегиды или кетоны также могут реагировать с аммиаком с z. Б. Возникают изопропиламины. Тонкие химические вещества и, в частности, четвертичные аммониевые соли образуются в результате дальнейшего алкилирования хлоралканами.
- Восстановление нитрилов обеспечивает z. Б. жирные амины
- Реакция эпоксидов с аминами или аммиаком проводится в промышленных масштабах . При этом образуются этаноламины , изопропаноламины и т. Д.
- Нитрование алканов и последующее восстановление до алкиламина и гидроаминирование олефинов имеют небольшое промышленное значение. Однако они оба работают в промышленных масштабах.
Биологические процессы
- В биологических процессах, амины могут возникнуть в результате деградации и гнилостных процессов через декарбоксилирование из аминокислот .
Связанный с аминокислотами пептид в белке (например, из рыбы ) биохимически расщепляется до аминов и углекислого газа после смерти животных . Амины отвечают за характерный запах рыбы, который иногда воспринимается как неприятный. Рыбу часто подают с долькой лимона. Как и все кислоты, лимонная кислота также протонирует амины с образованием цитратов (солей лимонной кислоты) и, таким образом, может уменьшить запах амина.
Вхождение
- Амины встречаются в природе в растениях, животных и людях и затем называются биогенными аминами, которые могут быть образованы из аминокислот декарбоксилированием. Биогенные амины имеют большое значение в качестве тканевых гормонов , таких как B. гистамин и серотонин , которые образуются из аминокислот гистидина и триптофана . Эти две аминокислоты относятся к основным аминокислотам, которые, помимо обязательной α-аминогруппы, характеризуются дополнительными аминогруппами. В гистидине кольцо имидазола гетероциклического амина является дополнительной основной группой, в триптофане индол гетероциклического амина является дополнительной основной группой.
- Катехоламины , которые включают первичные алифатические амины дофамин и норэпинефрин , могут быть описаны как вещества- нейротрансмиттеры . Оба соединения также содержат дополнительную ароматическую кольцевую систему. Адреналин очень похож на норадреналин, но также метилирован по атому азота и, следовательно, является вторичным алифатическим амином.
- Кроме того, можно найти гетероциклические амины, такие как пурин и пиримидин, в качестве так называемых нуклеиновых оснований в основных структурных компонентах нуклеозидов в ДНК.
- Аминокислоты, строительные блоки пептидов , не являются ни аминами, ни карбоновыми кислотами. Хотя они содержат функциональные группы двух классов соединений, они не проявляют своих типичных свойств.
Химическая реакция
Амины реагируют с азотистой кислотой с образованием различных продуктов в зависимости от типа используемого амина.
- Первичные алифатические и ароматические амины реагируют с образованием солей диазония , которые можно использовать различными способами в качестве исходных материалов для дальнейших синтезов.
- Вторичные амины реагируют с так называемыми нитрозирующими агентами ( азотистая кислота , оксиды азота , нитриты ), особенно в кислой среде, например, в желудке человека, с образованием нитрозаминов . Поскольку вторичные амины присутствуют в пище, а нитрозамины обладают канцерогенным действием, эта реакция заслуживает внимания.
Также третичные алифатические амины могут медленно реагировать на нитрозамины с отщеплением алкильной группы; ароматические третичные амины реагируют с электрофильными нитрозирующими агентами в ароматической кольцевой системе с образованием ароматических нитрозосоединений .
- Как соединения, богатые электронами, ароматические амины являются реактивными реагентами для электрофильных ароматических замещений .
- Амины являются реагентами в многочисленных реакциях нуклеофильного замещения, например, при образовании карбоксамидов , карбоксимидов или лактамов и иминов . Поэтому амины могут быть использованы в качестве защитных групп из карбонильных соединений или в качестве хиральных вспомогательных веществ .
- В элиминациях , объемные вторичные или третичные амины используются в качестве акцепторов протонов, которые являются основными , но не нуклеофильными.
- Амины, в основном диамины или триамины, также используются в качестве лигандов в сложной химии .
использовать
- Ароматические амины используются для изготовления азокрасителей .
- Амины - это строительные блоки для агрохимикатов и фармацевтических препаратов, а также для поверхностно-активных веществ , покрытий и смазок.
- В области литейной технологии амины используются в качестве катализаторов для ускорения процесса отверждения связующих в формовочном песке во время изготовления стержней с использованием процесса холодного ящика.
- Амины и диамины также служат катализаторами образования и сшивания полиуретанов . Их буферный эффект используется, когда они используются в качестве ингибиторов коррозии в водных системах.
- Еще одна важная область применения аминов - очистка газа на нефтеперерабатывающих заводах и электростанциях.
Обнаружение аминов
- Для обнаружения азота в органическом соединении может быть проведено переваривание исследуемого вещества натрием . В нейтрализованном расщепляющем растворе азот может быть обнаружен как цианид с образцом Лассена как берлинский синий или, если вещество также содержит серу, как тиоцианат с хлоридом железа (III) . Однако это свидетельство не относится к аминам, а лишь указывает на то, что анализируемое вещество содержало азот.
- Амины часто можно узнать по их характерному резкому или неприятному запаху (от аммиачного до рыбного). Но для доказательства этого недостаточно.
- Для определения степени замещения амина, т.е. наличия первичного, вторичного или третичного амина, проводят разделение по Хинсбергу . Амин превращается в амид п- толуолсульфоновой кислоты:
Третичные амины и соли четвертичного аммония не образуют сульфонамидов,
вторичные амины образуют сульфонамиды, которые не растворяются в щелочах,
первичные амины образуют сульфонамиды, растворимые в щелочах.
- Однозначная идентификация неизвестного амина осуществляется либо с помощью масс-спектрометрии, либо с помощью подходящего производного , характерная температура плавления которого определяется:
- Первичные и вторичные амины: сульфонамид, уже полученный при разделении Хинсберга, подходит в качестве производного (см. Выше).
- Третичные амины: здесь рекомендуется осаждение пикратов .
Первичные, вторичные и третичные амины можно разделить хроматографически без дериватизации с помощью ВЭЖХ . Обнаружение и количественное определение происходит с помощью масс-селективного детектора (ВЭЖХ / МС). Для однозначного определения аминов с одинаковой молярной массой (например, диэтиламина и бутиламина ) рекомендуется использовать стандартные вещества для калибровки.
Смотри тоже
литература
- Ханс Бейер , Вольфганг Вальтер: Учебник органической химии. 22-е издание. 1991, ISBN 3-7776-0485-2 .
- Сообщество авторов : Органикум. 22-е издание. Wiley-VCH, Weinheim, 2004, ISBN 3-527-31148-3 .
- Карл Швистер: Карманный справочник химии. Hanser Fachbuchverlag, 2004.
Замечания
веб ссылки
- Овощные амины .
- Объяснение основного характера аминов на TutorVista.com (англ.).
- Таблицы со значениями pK b различных аминов.
Индивидуальные доказательства
- ↑ Джонатан Клейден, Стюарт Уоррен, Ник Гривс, Питер Уотерс: Органическая химия . Oxford University Press, Нью-Йорк 2001, ISBN 0-19-850346-6 , стр. 199-200 .
- ↑ Луи Фредерик Физер , Мэри Физер: Учебник органической химии. 3-е издание, Verlag Chemie, 1957, с. 254.
- ↑ Запись о нитрозаминах. В: Römpp Online . Георг Тиме Верлаг, по состоянию на 13 июня 2014 г.