аминокислоты
Аминокислоты ( AS ), редко также аминокарбоновые кислоты , устаревшие названия амидокислоты , представляют собой химические соединения с аминогруппой, содержащей азот (N), и группой карбоновой кислоты, содержащей углерод (C) и кислород (O) . Аминокислоты есть во всем живом . Они являются строительными блоками белков (белков) и высвобождаются при расщеплении белков ( протеолиз ). Организм не может сам производить незаменимые аминокислоты , поэтому их нужно принимать с пищей.
Класс аминокислот включает органические соединения, которые содержат по меньшей мере одну аминогруппу (-NH 2 или замещенный -NR 2 ) и одну карбоксильную группу (-COOH) в качестве функциональных групп , то есть имеют структурные особенности аминов и карбоновых кислот . Химически они могут быть дифференцированы в соответствии с положением их аминогруппы по отношению к карбоксильной группе - если аминогруппа на α -атоме C находится непосредственно рядом с концевой карбоксильной группой, это называется α-положением и относится к в виде α-аминокислот .
Выбранные α-аминокислоты являются естественными строительными блоками белков. Они связаны друг с другом в цепи карбоксильной группой одной аминокислоты, образуя пептидную связь с аминогруппой следующей . Аминокислоты, связанные таким образом с образованием полимера, различаются по своим боковым цепям и вместе определяют форму, в которой полипептид затем разворачивается в водной среде с образованием нативного белка . Это Биосинтез белков происходит во всех клетках на рибосомах в соответствии с генетической информацией , которая присутствует в виде мРНК .
Последовательность оснований мРНК кодирует аминокислотную последовательность в триплетах , каждый триплет оснований представляет собой кодон , обозначающий конкретную протеиногенную аминокислоту . Аминокислоты, указанные в качестве строительных блоков для образования белков в определенном порядке, образуют белки. В организме человека существует 21 различная протеиногенная аминокислота, в дополнение к стандартным 20 ( каноническим ) аминокислотам также селеноцистеин . После трансляции боковые цепи некоторых аминокислот, встроенных в белок, все еще могут быть изменены .
Спектр аминокислот выходит далеко за рамки этих двадцати протеиногенных . На сегодняшний день известно более 400 не протеиногенных природных аминокислот, которые обладают биологическими функциями. Сравнительно редкие D- аминокислоты представляют собой особую группу, причем разнообразие аминокислот, получаемых синтетическим путем, и теоретически возможных аминокислот значительно больше.
Некоторые аминокислоты играют особую роль в качестве нейротрансмиттеров , как и различные продукты распада аминокислот; Биогенные амины не только действуют как посредники в нервной системе, но также проявляют различные физиологические эффекты в организме в качестве гормонов и тканевых медиаторов .
Простейшую аминокислоту, глицин , можно было обнаружить не только на Земле , но и на кометах , метеоритах и в газовых облаках в межзвездном пространстве .
история
Первая аминокислота была выделена из сока спаржи ( Asparagus officinalis ) в парижской лаборатории Луи-Николя Воклена и его ученика Пьера Жана Робике в 1805 году и затем получила название аспарагин . Как последняя из обычных аминокислот, строящих белок, треонин был обнаружен в фибрине в 1931 году, а его структура была выяснена Уильямом Роузом в 1935 году . В ходе экспериментов с различными кормами для животных Роуз обнаружил, что 19 аминокислот, которые были обнаружены до сих пор, недостаточны в качестве добавки. Он также определил важность других аминокислот и определил минимальную суточную дозу, необходимую для оптимального роста .
В период между 1805 и 1935 годами многие известные в то время химики и фармацевты впервые участвовали в выделении аминокислот и уточнении их структуры. Эмилю Фишеру , которому также принадлежит проекция Фишера , удалось окончательно выяснить структуру серина (1901), лизина (1902), валина (1906) и цистеина (1908). Даже Альбрехт Коссель ( гистидин 1896 г. из Störsperma), Ричард Вильштеттер ( пролин 1900 г. путем синтеза) и Фредерик Хопкинс ( триптофан 1901 г. из казеина ) позже стали лауреатами Нобелевской премии. Немецкий химик Эрнст Шульце впервые выделил три аминокислоты - глутамин из свеклы в 1877 году , фенилаланин в 1881 году и аргинин из люпина в 1886 году - и принял участие в структурном выяснении других аминокислот. Генрих Риттхаузен ранее получил кристаллическую глутаминовую кислоту из зернового белка , глютена , в 1866 году . В 1872 году Вильгельм Дитмар выяснил структуру глутамина и глутаминовой кислоты, солями которых являются глутаматы .

Уже в 1810 году, Волластон обнаружил в серосодержащий цистине в качестве «кистозного оксида» в камнях в мочевом пузыре , но он не был до 1884 , что Евгений Baumann обнаружил мономерный цистеин . В 1819 Браконно отделяют на глицин от клея и Жозеф Луи Пруст отделяет на лейцин из зерна. Ойген фон Горуп-Безанес выделил валин из панкреатического сока в 1856 году . Еще в 1846 году Юстус фон Либих впервые смог отделить тирозин от казеина , структура которого Людвиг фон Барт разъяснил в 1869 году . В гидролизате казеина Эдмунд Дрексел открыл лизин в 1889 году, а позже Джон Ховард Мюллер открыл сернистый метионин в качестве 19-й аминокислоты в 1922 году , структурная формула которого была дана Джорджем Баргером и Филипом Койном в 1928 году. В 1903 году Феликс Эрлих был 18-м человеком, который обнаружил изолейцин в патоке , структурном изомере лейцина.
Фридрих Велер , чьи синтезы открыли область биохимии в 1820-х годах , не открыл никаких аминокислот, но в этом участвовали трое его учеников, в дополнение к вышеупомянутым Горуп-Безанес и Шульце, Георг Штеделер ( серин 1863 года из шелка-сырца) . 18 из 20 обнаруженных аминокислот были выделены из растительного или животного материала, только две аминокислоты аланин (1850 Adolph Strecker ) и пролин (Willstätter) были получены путем органического синтеза. В то время как анализ состава материала до молекулярной формулы было легко выполнить с помощью методов того времени, структурная формула многих аминокислот часто могла быть окончательно прояснена только с помощью частичных этапов синтеза, которые иногда удавались только спустя годы. Структура аспарагина и аспарагиновой не очищены Кольбе до 1862, 57 лет после первого описания.
Аминокислоты обязаны своим родовым названием двум функциональным группам, их индивидуальные названия иногда обусловлены легким внешним видом (например, аргинин , лейцин ), сладким вкусом (например, глицин ) или материалом, в котором они были обнаружены (например, аспарагин , цистеин , серин , тирозин ), характеристики химической структуры (например, пролин , валин , изолейцин ) или того и другого (например, глутамин , глутаминовая кислота ), а иногда также исходные материалы для их синтеза (например, аланин ).
То, что белки состоят из цепочек аминокислот, связанных пептидными связями, было впервые предложено в 1902 году на встрече немецких естествоиспытателей и врачей в Карлсбаде одновременно и независимо от Эмиля Фишера и Франца Хофмайстера (теория Хофмайстера-Фишера).
состав
| Карбаминовая кислота |
Аминокислоты состоят как минимум из двух атомов углерода. Нестабильная карбаминовая кислота имеет только один атом углерода и поэтому является не аминокислотой, а амидом угольной кислоты. Аминокислоты можно разделить на классы в зависимости от атома углерода, на котором расположена аминогруппа относительно карбоксильной группы. Если в молекуле представлено несколько аминогрупп, атом углерода, аминогруппа которого наиболее близка к карбоксиуглероду, определяет, к какому классу аминокислот он относится.
| Общая структура аминокислот (R: боковая цепь) |
| α-аминокислота |
| β-аминокислота |
| γ-аминокислота |
- α-Аминокислоты: аминогруппа α-аминокислот расположена на втором атоме углерода, включая карбоксильный атом углерода. Отсчет всегда начинается с карбоксильного углерода. Поэтому название IUPAC - 2-аминокарбоновые кислоты. Простейшим представителем α-аминокислот является протеиногенная аминокислота глицин . Все протеиногенные аминокислоты являются α-аминокислотами.
- Термин «аминокислоты» часто относится к определенной группе α-аминокислот, которая в основном состоит из L - α-аминокислот : протеиногенных аминокислот . Это строительные блоки всех белков всего живого на Земле и, помимо нуклеиновых кислот, основные строительные блоки жизни .
- β-аминокислоты: аминогруппа β-аминокислот расположена на третьем атоме углерода (включая атом углерода карбокси). Название IUPAC - 3-аминокарбоновые кислоты. Самый простой представитель - β-аланин .
- γ-аминокислоты: аминогруппа γ-аминокислот находится на четвертом атоме углерода (включая атом углерода карбокси). Название IUPAC - 4-аминокарбоновые кислоты. Самый простой представитель - гамма-аминомасляная кислота (ГАМК).
Обозначение дальнейших классов аминокислот происходит по той же схеме.
Аминокислоты класса отличается своей боковой цепью R . Если боковая цепь R отличается от других заместителей, расположенных на атоме углерода с аминогруппой, здесь имеется стереоцентр и два энантиомера соответствующей аминокислоты . Если сама боковая цепь R содержит дополнительные стереоцентры, также образуются диастереомеры, и количество возможных стереоизомеров увеличивается соответственно количеству дополнительных стереоцентров. Существует четыре стереоизомера аминокислот с двумя по- разному замещенными стереоцентрами .
Аминоацильная группа
 Аминоацильная группа образована из аминокислоты глицина . R здесь означает радикал, с которым связана аминоацильная группа; например, транспортная РНК ( тРНК ) загружается в аминоацил-тРНК . |
 Аминоацильная группа образована из аминокислоты L - глутамина . R здесь означает радикал, с которым связана аминоацильная группа; например, транспортная РНК ( тРНК ) загружается в аминоацил-тРНК . |
Аминоацильная группа относится к одновалентной группе, которая образуется из аминокислоты путем удаления гидроксильной группы (-OH) из карбоксильной группы (-COOH), то есть одновалентного радикала. Таким образом, α-аминоацильная группа образуется из α-аминокислоты; например, из аминокислоты тирозина образуется тирозильная группа в виде особой α-аминоацильной группы.
Протеиногенные аминокислоты
Аминокислоты называют также протеиногенную , которые используются в живых организмах , как строительные блоки белков в ходе перевода в соответствии с генетической информацией. При биосинтезе белков, который происходит на рибосомах клетки, выбранные аминокислоты связаны пептидными связями в определенной последовательности с образованием полипептидной цепи белка в ходе биосинтеза белка . Аминокислотная последовательность в рибосом , образованного пептида предопределено генетической информации , содержащейся в последовательности оснований в нуклеиновой кислоте , с аминокислотой быть закодированы с помощью базовой триплет в соответствии с генетическим кодом .
 L- пролин (протеиногенная аминокислота) |
 D- пролин (непротеиногенная аминокислота) |
Протеиногенные аминокислоты всегда являются α-аминокислотами. За исключением самого маленького, глицина , они хиральны и имеют особое пространственное расположение. Аминокислота пролин имеет особую особенность, аминогруппа которой имеет вторичный амин и поэтому не так гибко вписывается в белковую складку, как другие протеиногенные аминокислоты - пролин, например, разрушает спираль в α-спиральных структурах. в белках. Из-за вторичной аминогруппы пролин также называют вторичной аминокислотой - часто неправильно или устаревшей как иминокислоту .
Из зеркально инвертированных энантиомеров только L- аминокислоты являются протеиногенными ( номенклатуру D / L см. В проекции Фишера ; в таких случаях, как гидроксипролин, присутствуют и другие стереоизомеры ). Молекулярные компоненты клеточного аппарата, необходимые для построения белков - в дополнение к рибосомам, тРНК и аминоацил-тРНК-синтетазам, загруженным аминокислотами - сами по себе также хиральны и распознают только L- вариант.
Тем не менее, D- аминокислоты иногда встречаются и в живых организмах . Однако они синтезируются независимо от протеиногенных метаболических путей и не используются в рибосомной структуре белков. Так , например, Д - аланин включены в пептидогликаны на клеточной стенки бактерий или D - валина в бактериальные циклотронах депсипептидов , таких как валиномицин . Различные типы архей , бактерий , грибов и голожаберников имеют мультиферментные комплексы, называемые нерибосомными пептидными синтетазами, с помощью которых такие (непротеиногенные) аминокислоты могут быть включены в нерибосомный пептид .
Канонические аминокислоты
Кодоны 20 протеиногенных аминокислот находятся в (наиболее часто используемой) стандартной версии генетического кода. Поэтому их называют стандартными аминокислотами или каноническими аминокислотами .
В аминокислотных последовательностях аминокислоты обычно обозначаются аббревиатурой названия в виде трехбуквенного кода или представлены в однобуквенном коде символом.
| аминокислота | Ацильная группа |
поесть ? |
Ø в белках |
||
|---|---|---|---|---|---|
| Фамилия | Сокр. | условное обозначение | |||
| Аланин | Ала | А. | Аланил | нет | 9,0% |
| Аргинин | Arg | Р. | Аргинил | полу | 4,7% |
| Аспарагин | Asn | N | Аспарагинил | нет | 4,4% |
| Аспарагиновая кислота | Жерех | Д. | α-аспартил | нет | 5,5% |
| Цистеин | Cys | С. | Цистеинил | нет * | 2,8% |
| Глутамин | Gln | Q | Глутаминил | нет | 3,9% |
| Глютаминовая кислота | Glu | Э. | α-глутамил | нет | 6,2% |
| Глицин | Gly | грамм | Глициловый | нет | 7,5% |
| Гистидин | Его | ЧАС | Гистидил | полу | 2,1% |
| Изолейцин | Иль | Я. | Изолейциловый | да | 4,6% |
| Лейцин | Лея | Л. | Лейциловый | да | 7,5% |
| Лизин | Lys | K | Лизил | да | 7,0% |
| Метионин | Мид | М. | Метионил | да | 1,7% |
| Фенилаланин | Phe | Ф. | Фенилаланил | да | 3,5% |
| Пролин | За | П. | Пролил | нет | 4,6% |
| Серин | Сер | С. | Серил | нет | 7,1% |
| Треонин | Thr | Т | Треонил | да | 6.0% |
| Триптофан | Trp | W. | Триптофил | да | 1,1% |
| Тирозин | Тюр | Y | Тирозил | нет * | 3,5% |
| Валин | Вал | V | Валил | да | 6,9% |
| * Незаменим для детей и беременных. | |||||
В дополнение к кодам, приведенным выше, дополнительные символы используются в качестве заполнителей, если точная аминокислота не может быть выведена из секвенирования белка или анализа структуры рентгеновских лучей .
| Возможные аминокислоты | Сокр. | условное обозначение |
|---|---|---|
| Аспарагин или аспарагиновая кислота | Asx | Б. |
| Глутамин или глутаминовая кислота | Glx | Z |
| Лейцин или изолейцин | Xle | J |
| неизвестная аминокислота | Хаа (редко Unk) | Икс |
Неканонические аминокислоты
Помимо канонических аминокислот , встречающиеся в природе аминокислоты включают другие аминокислоты, известные как неканонические аминокислоты , включая протеиногенные и непротеиногенные аминокислоты. Можно выделить несколько групп:
- Первая группа включает те протеиногенные аминокислоты, которые включаются в белки посредством перекодирования генетического материала. К ним относятся 21-я и 22-я протеиногенные аминокислоты: селеноцистеин (у эукариот, некоторых бактерий и архей ) и пирролизин (у некоторых бактерий и архей). Для обеих аминокислот были обнаружены специфические тРНК - тРНК Sec и тРНК Pyl , что позволяет встраивать их в рибосому во время трансляции. Их пары антикодонов , в зависимости от структурных элементов в контексте мРНК (см. Secis ), с кодоном UGA или UAG ; в стандартном коде они представляют собой стоп-кодон, однако не все организмы используют неканонические протеиногенные аминокислоты этой группы.
аминокислота Сокр. условное обозначение Пирролизин Пыл О Селеноцистеин Сек U
- Обычный стартовый кодон AUG кодирует аминокислоту метионин . В дополнение к тРНК Met у бактерий есть специальная тРНК fMet , которая также загружена метионином и служит инициаторной тРНК . Аминокислота, связанная с тРНК i fMet, но находящаяся в бактериях на N- конце , формилируется до N- формилметионина (fMet) до того, как она при инициации может оказаться на рибосоме до первой аминокислоты пептидной цепи. Это производное аминокислоты формилметионин поэтому иногда также считается (23-й) протеиногенной аминокислотой. Также митохондрии и хлоропласты используют исходный fMet. Напротив, он не используется при трансляции в цитозоле эукариотических клеток и архей .
- Вторая группа состоит из аминокислот , которые не являются протеиногенными в узком смысле слова и которые возникают из канонических аминокислот, когда аминокислотный остаток R изменяется после включения в белки, т.е. ЧАС. через одну из многих посттрансляционных модификаций . Таким образом , пролин в гидроксипролину , серин в O -Phosphoserin, тирозин в O - фосфотирозин и глутамат в гамма-карбоксиглутамат быть преобразованы. Важным изменением аминокислотного остатка также является гликозилирование : здесь углеводные остатки переносятся на аминокислотные остатки, образуя гликопротеины .
- Строго говоря, непротеиногенные аминокислоты, которые организм не может отличить от канонических аминокислот и которые он неспецифическим образом включает в белки, можно отнести к третьей группе . К ним относятся селенометионин , который может быть включен вместо метионина , или канаванин , который организм не может отличить от аргинина , или азетидин-2-карбоновая кислота , которая действует как ядовитый аналог пролина . Многие из аминокислот в этой группе токсичны, поскольку они часто приводят к неправильной укладке белка, что может ухудшить форму и, следовательно, функциональность белка. Азетидин-2-карбоновая кислота является токсичным компонентом ландыша , посредством чего ландыш защищает себя от неконтролируемого включения этой аминокислоты в свои белки с помощью высокоспецифичной пролил- тРНК-синтетазы .
В дополнение к каноническому 20, люди также используют селеноцистеин в качестве протеиногенной аминокислоты. Из 20 канонических аминокислот 12 синтезируются организмом человека или микроорганизмами, живущими в пищеварительном тракте человека. Остальные 8 аминокислот необходимы человеку, а это значит, что они должны поступать с пищей.
Включение искусственных, почти произвольно сконструированных аминокислот в ходе дизайна белка возможно, среди прочего, путем замены лиганда в соответствующей аминоацил-тРНК синтетазе . Эти методы частично продвинулись настолько далеко, что для этого целевого специфического белка может быть получен маркер , например, белок путем обработки специфическими реагентами для стимуляции флуоресценции (например, включение норборнен-аминокислоты через пирролизил-тРНК синтетазу / кодон CUA ). Это позволяет точно локализовать белок даже без образования антител и реакции с ними .
Биохимическое значение
Аминокислоты как строительные блоки белков
L- аминокислоты имеют большое значение в биохимии, потому что они являются строительными блоками пептидов и белков . На сегодняшний день известно более двадцати так называемых протеиногенных аминокислот. Это прежде всего те 20 L -α-аминокислот, которые кодируются как стандартные аминокислоты кодонами из трех азотистых оснований каждый в ДНК в соответствии со стандартным кодом . К этим канонически названным аминокислотам были добавлены еще две, селеноцистеин и пирролизин . Обе неканонические также являются α-аминокислотами, исходя из концевой карбоксильной группы , аминогруппа связана с непосредственно соседним атомом углерода (C α ). Кроме того, есть другие аминокислоты, которые входят в состав белков или пептидов, но не кодируются.
Аминокислотные цепи с длиной цепи менее 100 аминокислот обычно называют пептидами, а более крупные цепи, образованные рибосомами , называют белками. Отдельные аминокислоты связаны внутри цепи пептидными связями (амид кислоты). Автоматизированный метод синтеза пептидов обеспечивается синтезом Меррифилда .
Белки, поступающие с пищей, в процессе пищеварения расщепляются на L- аминокислоты. Далее они перерабатываются в печени . Они либо используются для биосинтеза белка, либо расщепляются ( см. Также: аминокислотный индекс ). Наиболее важные механизмы распада аминокислот:
Незаменимые аминокислоты
Аминокислоты, в которых организм нуждается, но не может производить сам, называются незаменимыми аминокислотами и должны поступать с пищей. Все эти незаменимые аминокислоты являются L- альфа-аминокислотами. Для человека незаменимыми аминокислотами являются валин , метионин , лейцин , изолейцин , фенилаланин , триптофан , треонин и лизин . С 1985 года ВОЗ также классифицирует аминокислоту гистидин как незаменимую аминокислоту. Таким образом, существует девять незаменимых аминокислот. Условно незаменимые или полузаменимые аминокислоты необходимо принимать внутрь только в определенных ситуациях, например, во время роста или после тяжелых травм. Остальные аминокислоты либо синтезируются напрямую, либо получаются из других аминокислот путем модификации. Цистеин можно синтезировать из незаменимой аминокислоты метионина. Поскольку способность производить аминокислоту тирозин из фенилаланина еще не полностью развита, это, наряду с другими, является одной из незаменимых аминокислот в детстве. По аналогичной причине тирозин также необходимо принимать в случае фенилкетонурии . Существуют также другие заболевания, которые нарушают метаболизм аминокислот и могут потребовать приема фактически несущественной аминокислоты. Все незаменимые или полузаменимые аминокислоты, которые необходимы человеческому организму, содержатся в куриных яйцах.
Растения и микроорганизмы могут самостоятельно синтезировать все необходимые им аминокислоты. Поэтому в них нет незаменимых аминокислот .

Химико-физические свойства
Протеиногенные аминокислоты можно разделить на группы в соответствии с их остатками (см. Обзор свойств в таблице ). Аминокислота может одновременно входить в разные группы. Перекрытие групп может быть показано графически на количественной диаграмме .
У авторов разные взгляды на свойства боковой цепи цистеина: Леффлер считает ее полярной, а Альбертс - неполярной. Правильно, сера является гетероатомом , поэтому применимо следующее: Боковая цепь цистеина имеет слабополярные свойства.
Кислотное и щелочное поведение

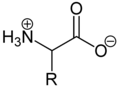
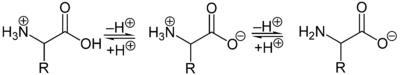
Из-за основной аминогруппы и кислотной группы карбоновой кислоты аминокислоты являются одновременно основаниями и кислотами . В твердом виде и в нейтральных водных растворах аминокислоты присутствуют в виде цвиттерионов , то есть аминогруппа протонирована, а карбоксильная группа депротонирована. В общих чертах цвиттерион можно представить следующим образом:
В качестве цвиттериона протонированная аминогруппа может реагировать как кислота ( донор протона ), а карбоксилатная группа может реагировать как основание ( акцептор протона ). В кислых растворах аминокислоты присутствуют в виде катионов, а в основных растворах - в виде анионов :
Заряд молекулы аминокислоты зависит от pH раствора. В случае цвиттер-иона с кислотной и основной группами полный заряд молекулы равен нулю при нейтральном pH. Кроме того, некоторые из боковых цепей аминокислот имеют заряженные кислотные или основные группы. PH с нулевым чистым зарядом - это изоэлектрическая точка (pH I , pI) аминокислоты. Растворимость аминокислоты в воде самая низкая в изоэлектрической точке.
| аминокислота | характерная черта | бесплатно | в белке |
|---|---|---|---|
| Жерех | злой | 3,68 | 3,7-4,0 |
| Glu | злой | 4,25 | 4,2-4,5 |
| Его | базовый | 6.00 | 6,7-7,1 |
| Cys | полукислый | 8,33 | 8,8-9,1 |
| Тюр | полукислый | 10.07 | 9,7-10,1 |
| Lys | базовый | 10,53 | 9,3-9,5 |
| Arg | базовый | 12,48 | - |
Для кислотно-основного поведения протеиногенных аминокислот особый интерес представляет поведение их боковой цепи (далее обозначаемой как R ). В белках группы NH 2 и COOH не могут быть протонированы при физиологическом значении pH (около pH 7) из-за пептидной связи и, следовательно, не могут быть титрованы . Исключение составляют амино- и карбокси-конец белка. Следовательно, остаток R в боковой цепи является определяющим для кислотно-основного поведения белков и пептидов .
Поведение боковой цепи R зависит от ее строения, то есть от того, может ли сама боковая цепь действовать как акцептор протонов или как донор протонов . Протеиногенные аминокислоты делятся в соответствии с функциональными группами на аминокислоты с неполярными или полярными боковыми цепями аминокислот и далее подразделяются на подгруппы, отсортированные по полярности : алифатические , ароматические , амидированные , серосодержащие , гидроксилированные , основные и кислые аминокислоты.
Хотя боковые цепи тирозина и цистеина относительно кислые по сравнению с другими неполярными боковыми цепями, они имеют тенденцию депротонировать только при нефизиологически высоких значениях pH. Пролин является вторичной аминокислотой, потому что N-конец образует пятиатомное кольцо с боковой цепью. Внутри белка карбокси-конец предыдущей аминокислоты связывается с азотом пролина, который не может быть протонирован из-за уже упомянутой пептидной связи. Гистидин, тирозин и метионин делятся на две подгруппы.
| аминокислота | pK 2 COOH |
pK 1 COOH |
Изоэлектрическая точка |
pK 1 NH 2 |
pK 2 NH 2 |
|---|---|---|---|---|---|
| Аланин | - | 2.3 | 6.1 | 9.9 | - |
| Аргинин | - | 2,81 | 10,76 | 9.09 | 12,5 |
| Аспарагин | - | 2,02 | 5,41 | 8,80 | - |
| Аспарагиновая кислота | 3,65 | 1,88 | 2,85 | 9,60 | - |
| Цистеин | 8,33 * | 1,71 | 5,05 | 10,78 | - |
| Глутамин | - | 2,17 | 5,65 | 9,13 | - |
| Глютаминовая кислота | 4,25 | 2,19 | 3,22 | 9,67 | - |
| Глицин | - | 2,21 | 5,97 | 9.15 | - |
| Гистидин | - | 1,78 | 7,47 | 8,97 | 5,97 |
| Изолейцин | - | 2.32 | 5,94 | 9,76 | - |
| Лейцин | - | 2,4 | 5,98 | 9,6 | - |
| Лизин | - | 2,20 | 9,59 | 8,90 | 10,28 |
| Метионин | - | 2,28 | 5,74 | 9.21 | - |
| Фенилаланин | - | 2,58 | 5,84 | 9,24 | - |
| Пролин | - | 1,99 | 6.3 | 10,60 | - |
| Серин | - | 2,21 | 5,68 | 9.15 | - |
| Треонин | - | 2,10 | 5,60 | 9,12 | - |
| Триптофан | - | 2,15 | 5,64 | 9,12 | - |
| Тирозин | 10.07 ** | 2,20 | 5,66 | 9,11 | - |
| Валин | - | 2.30 | 5,96 | 9,60 | - |
|
* Тиоловая группа ** фенольная гидроксильная группа | |||||
- Боковые цепи алифатических аминокислот
- Боковые цепи ароматических аминокислот
- Боковые цепи амидированных аминокислот
- Боковые цепи серосодержащих аминокислот
- Боковые цепи гидроксилированных аминокислот
- Боковые цепи основных аминокислот
- Боковые цепи кислотных аминокислот
- Аспарагиновая кислота (диссоциирует до аспартата)
- Глутаминовая кислота (диссоциирует на глутамат)
Значение pK представляет собой значение pH, при котором титруемые группы протонируются и депротонируются в равных частях; титруемая группа тогда присутствует в равных частях как в своей основной, так и в кислотной форме (см. также: уравнение Хендерсона-Хассельбаха ).
Обычно принято говорить о pK вместо pK S , т.е. о pK кислоты . В этом смысле, однако, pK лизина следует обозначать как pK B и pK основания . Для простоты эти обозначения обычно опускаются, поскольку контекст также показывает, действует ли группа как основание или как кислота.
PK не является постоянным, но зависит от температуры, активности , ионной силы и непосредственного окружения титруемой группы и, следовательно, может сильно колебаться.
Если pH выше, чем pK титруемой группы, титруемая группа находится в своей основной (депротонированной) форме. Если pH ниже, чем pK титруемой группы, титруемая группа находится в своей кислотной (протонированной) форме:
- Для Asp (pK = 3,86) при pH 7: боковая цепь почти полностью депротонирована.
- Для Lys (pK = 10,53) при pH 7: боковая цепь почти полностью протонирована.
Боковые цепи основных аминокислот просто положительно заряжены в их протонированной (кислотной) форме и не заряжены в их депротонированной (основной) форме. Боковые цепи кислых аминокислот (включая цистеин и тирозин) не заряжены в их протонированной (кислотной) форме и просто отрицательно заряжены в их депротонированной (основной) форме. Поскольку поведение боковой цепи совершенно иное, когда она заряжена или незаряжена, значение pH играет такую важную роль в свойствах боковой цепи.
Титруемые боковые цепи влияют, например, на поведение растворимости соответствующей аминокислоты. В полярных растворителях применяется следующее: заряженные боковые цепи делают аминокислоту более растворимой, незаряженные боковые цепи делают аминокислоту более нерастворимой.
В белках это может привести к тому, что определенные участки станут более гидрофильными или гидрофобными , что означает, что сворачивание и, следовательно, активность ферментов зависит от значения pH. Следовательно, белки могут быть денатурированы сильнокислотными или щелочными растворами .
Обзор свойств таблицы
| аминокислота | Боковая цепь R | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Фамилия | Сокр. | условное обозначение | Структурная формула | Конституционная формула | относительная молекулярная масса |
объем Ван-дер- Ваальса |
pola- rity |
Hydro phobi- мощность |
Кислотность или основность |
Кислотная константа (pK S ) |
| Аланин | Ала | А. | -CH 3 | 15-е | 67 | неполярный | +1,8 | нейтральный | - | |
| Аргинин | Arg | Р. | -CH 2 CH 2 CH 2 NH-C (NH) NH 2 | 100 | 148 | полярный | −4,5 | базовый (сильный) |
12,48 | |
| Аспарагин | Asn | N | -CH 2 CONH 2 | 58 | 96 | полярный | −3,5 | нейтральный | - | |
|
Аспарагиновая кислота |
Жерех | Д. | -CH 2 COOH | 59 | 91 | полярный | −3,5 | злой | 3,90 | |
| Цистеин | Cys | С. | -CH 2 SH | 47 | 86 | полярный | +2,5 | нейтральный | 8,18 | |
| Глутамин | Gln | Q | -CH 2 CH 2 CONH 2 | 72 | 114 | полярный | −3,5 | нейтральный | - | |
|
Глутаминовая кислота |
Glu | Э. | -CH 2 CH 2 COOH | 73 | 109 | полярный | −3,5 | злой | 4,07 | |
| Глицин | Gly | грамм | -ЧАС | 1 | 48 | неполярный | -0,4 | нейтральный | - | |
| Гистидин | Его | ЧАС | -CH 2 ( C 3 H 3 N 2 ) | 81 год | 118 | полярный | −3,2 | базовый (слабый) |
6,04 | |
| Изолейцин | Иль | Я. | -СН (СН 3 ) -СН 2 СН 3 | 57 год | 124 | неполярный | +4,5 | нейтральный | - | |
| Лейцин | Лея | Л. | -CH 2 CH (CH 3 ) 2 | 57 год | 124 | неполярный | +3,8 | нейтральный | - | |
| Лизин | Lys | K | -СН 2 СН 2 СН 2 -СН 2 NH 2 | 72 | 135 | полярный | −3,9 | базовый | 10,54 | |
| Метионин | Мид | М. | -CH 2 CH 2 SCH 3 | 75 | 124 | неполярный | +1,9 | нейтральный | - | |
| Фенилаланин | Phe | Ф. | -CH 2 ( C 6 H 5 ) | 91 | 135 | неполярный | +2,8 | нейтральный | - | |
| Пролин | За | П. | Один H отсутствует в NH 2 | 42 | 90 | неполярный | -1,6 | нейтральный | - | |
| Серин | Сер | С. | -СН 2 ОН | 31 год | 73 | полярный | -0,8 | нейтральный | - | |
| Треонин | Thr | Т | -СН (ОН) СН 3 | 45 | 93 | полярный | −0,7 | нейтральный | - | |
| Триптофан | Trp | W. | -CH 2 ( C 8 H 6 N ) | 130 | 163 | неполярный | -0,9 | нейтральный | - | |
| Тирозин | Тюр | Y | -СН 2 ( С 6 Н 4 ) ОН | 107 | 141 | полярный | −1,3 | нейтральный | 10,46 | |
| Валин | Вал | V | -CH (CH 3 ) 2 | 43 год | 105 | неполярный | +4,2 | нейтральный | - | |
Стереохимия
Согласно соглашению Кана-Ингольда-Прелога, 18 из 20 протеиногенных аминокислот имеют ( S ) -конфигурацию на α-атоме углерода , только цистеин имеет ( R ) -конфигурацию, поскольку здесь углерод с тиоловой группой имеет более высокий приоритет, чем имеет группа карбоновой кислоты. Глицин является ахиральным , поэтому невозможно определить абсолютную конфигурацию.
В дополнение к стереоцентру у атома α-C, изолейцин и треонин, каждый, имеют дополнительный стереогенный центр в своей R-группе . Протеиногенный изолейцин [ R = -C * H (CH 3 ) CH 2 CH 3 ] имеет там ( S ) -конфигурацию, треонин [ R = -C * H (OH) CH 3 ] ( R ) -конфигурируется.
Непротеиногенные аминокислоты

На сегодняшний день известно более 400 непротеиногенных (т. Е. Не включенных в белки во время трансляции ) аминокислот, обнаруженных в организмах. Среди них есть L - тироксин , гормон , вырабатываемый в щитовидной железе , L -DOPA , L - орнитин или почти во всех типах цианобактерий доказано нейротоксин β-Methylaminoalanin (BMAA).
Большинство непротеиногенных аминокислот являются производными протеиногенных, которые представляют собой L- α-аминокислоты. Тем не менее, β-аминокислоты ( β-аланин ) или γ-аминокислоты ( ГАМК ) также могут образовываться.
Среди не-протеиногенных аминокислот все D - энантиомеры из протеиногенных L -аминокислот. D -serine, в головном мозге по серин - рацемаза из L генерируется -serine (его энантиомер). Он служит и как нейротрансмиттер, и как медиатор , активируя рецептор NMDA , который вместе с глутаматом позволяет каналу открываться. Чтобы открыть ионный канал, необходимо связать глутамат и глицин или D- серин. D- серин является более сильным агонистом, чем сам глицин, в сайте связывания глицина глутаматного рецептора типа NMDA , но все еще был неизвестен в то время, когда сайт связывания глицина был впервые описан. После того, как D -аспартата, D -serine является второй D -аминокислоты , который был найден в организме человека.
Синтетические аминокислоты включают 2-амино-5-фосфоновалериановую кислоту (APV), антагонист рецептора NMDA, и экономически важный D- фенилглицин [синоним: ( R ) -фенилглицин], который содержится в боковой цепи многих полусинтетических β-лактамные антибиотики как частичный состав включены. ( S ) - и ( R ) - трет- лейцин [синоним: ( S ) - и ( R ) -β-метилвалин] являются синтетическими структурными изомерами протеиногенной аминокислоты ( S ) -лейцина и используются в качестве исходного материала в стереоселективной синтезы.
Существуют также аминосульфоновые кислоты [пример: 2-аминоэтансульфоновая кислота (синоним: таурин )], α-аминофосфоновые кислоты и α-аминофосфиновые кислоты. Это также α-аминокислоты, но не α- аминокарбоновые кислоты. Вместо карбоксильной группы (-COOH) эти α-аминокислоты содержат группу сульфоновой кислоты, фосфоновой кислоты или фосфиновой кислоты.
| аминокислота | Биологическое значение |
|---|---|
| Тироксин | Щитовидная железа - гормон |
| ГАМК | тормозной нейромедиатор |
| L - гомозер | Метаболический промежуточный продукт в синтезе аргинина |
| Орнитин | Промежуточный продукт метаболизма в цикле мочевины |
| Цитруллин | Промежуточный продукт метаболизма в цикле мочевины |
| Аргининосукцинат | Промежуточный продукт метаболизма в цикле мочевины |
| L- ДОПА | Промежуточный продукт метаболизма в синтезе катехоламинов |
| 5-гидрокситриптофан | Метаболический промежуточный продукт в синтезе серотонина |
| β-аланин | Строительный блок коэнзима А |
| β-метиламино-аланин | Neurotoxin из цианобактерий |
| Иботеновая кислота | Грибной яд |
| D - валин | В составе антибиотика валиномицин |
| D - аланин | Часть стенок бактериальных клеток |
| D - глутамат | Часть стенок бактериальных клеток |
| 2,6-диаминопимелиновая кислота | Часть стенок бактериальных клеток |
доказательство
Количественное фотометрическое определение аминокислот может быть выполнено с использованием теста Кайзера с нингидрином или с реагентом Фолина , с помощью которого могут быть обнаружены первичные амины. Для вторичных аминов используют изатиновый тест или хлораниловый тест . Разделение и обнаружение аминокислот также можно проводить с помощью капиллярного электрофореза или с помощью ВЭЖХ , в некоторых случаях в виде жидкостной хроматографии с масс-спектрометрическим сочетанием . В то время как большинство аминокислот не поглощают УФ-свет с длиной волны выше 220 нм, аминокислоты фенилаланин, тирозин, гистидин и триптофан являются ароматическими и поглощают УФ-свет с максимумом от 260 до 280 нм. Аминокислотный состав белка может быть изменен. определяется гидролизом исследуемого белка. Медленно происходящая рацемизация аминокислот в белках, изначально состоящих исключительно из L- аминокислот, исследуется во время определения возраста аминокислот .
Добыча и производство
Аминокислоты получают либо из природных веществ путем отделения гидролизованного белка, либо синтетическим путем. Первоначально разработка синтеза различных аминокислот в основном служила для выяснения структуры. Между тем, эти структурные вопросы были решены, и желаемые аминокислоты конкретно представлены с помощью различных синтезов, поскольку они все еще актуальны. Синтезы первоначально приводят к рацемическим смесям, которые можно разделить. Одним из методов этого является селективный ферментативный гидролиз, который используется для разделения рацематов .
Ниже приводится обзор различных синтезов, разработанных химиками еще в середине 19 века. Некоторые из этих старых синтезов представляют только исторический интерес из-за низкого выхода или других проблем. Однако некоторые из этих старых методов получили дальнейшее развитие, а некоторые до сих пор актуальны для представления аминокислот. Дополнительные сведения об этих синтезах, включая уравнения для синтезов, приведены по ссылкам на синтезы и указанные аминокислоты .
- С синтезом циангидрина химиком Адольфом Стрекером в 1850 году аланин был впервые синтезирован из ацетальдегида (см. Синтез Стрекера ).
- Синтез для получения глицина через α-жирные кислоты, которые образуются при реакции жирных кислот брома или хлора с аммиаком, был проведен Уильямом Х. Перкинсеном. и Болдуин Ф. Дуппа разработали еще в 1859 году.
- Йозеф Пёхль открыл синтез азлактона для получения аминокислот в 1883 году . Точная процедура была опубликована только в 1893 году Эмилем Эрленмейером- младшим. просвещенный. Поэтому этот метод также называют синтезом Эрленмейера . Этот процесс использовался для производства гистидина, а также фенилаланина и тироксина в 1911 году .
- Аспарагиновая кислота была впервые синтезирована в 1887 году путем восстановления α-оксиминокислоты . В 1906 году Луи Bouveault использовал тот же метод , чтобы подготовить изолейцин из оксима из эфира methylethylpyruvic кислоты .
- После синтеза Габриэля, разработанного Зигмундом Габриэлем , в 1889 году был синтезирован гидрохлорид глицина с использованием фталимида калия в качестве исходного химического вещества. Хотя этот синтез является устаревшим для получения глицина , он подходит для производства других аминокислот из-за его высоких выходов.
- При синтезе цианогидрина , Эмиль Фишер произвел серин в первый раз через гликолевый в 1902 году . В 1906 году разработанный им синтез эфира малоновой кислоты был использован для синтеза лейцина . Изолейцин , норлейцин , метионин и фенилаланин - это другие аминокислоты, которые можно легко представить с помощью этого синтеза.
- Теодор Курциус использовал разработанную им деградацию Курциуса для получения α-аминокислот путем использования производных эфира малоновой кислоты для синтеза глицина , аланина , валина и фенилаланина.
- В 1911 году тирозин , фенилаланин и триптофан были получены путем конденсации ароматических альдегидов с гидантоином .
- В 1931 году Джордж Баргер синтезировал метионин, используя комбинированный синтез фталимид-малонового эфира . Фенилаланин, пролин , тирозин, аспарагиновая кислота и серин также могут быть получены с использованием того же метода . Винсент дю Виньо произвел DL - цистин, используя этот метод в 1939 году .
Аминокислоты сегодня производятся промышленным способом с использованием следующих процессов:
- Метод экстракции : для этого белки сначала гидролизуют кислотами . После осаждения аминокислотной смеси гидролизата проводят хроматографическое разделение с помощью ионообменной хроматографии . При элюировании используются разные полярности аминокислот.
- Химический синтез : существует множество синтетических методов. Примеры являются синтезом Стрекер из D , L валин, Дегусс-Синтез D , L - цистеин и синтез D , L - метионин от метилмеркаптана , акролеин и цианистый водорода . Поскольку полученные аминокислоты получают в виде рацемата , необходимо проводить процессы разделения энантиомеров , если требуются чистые L- или D- аминокислоты.
- Ферментативные процессы . Преимущество этого процесса заключается в доставке энантиомерно чистых аминокислот L или D с подходящими ферментами в качестве биокатализаторов . Примерами являются производство L - аспарагиновой кислоты из фумаровой кислоты с L - аспартазы и производство L - триптофана из индола и пировиноградной кислоты с tryptopharase.
- Процесс ферментации : во время ферментации аминокислоты производятся с помощью подходящих микроорганизмов . Процесс синтеза происходит через очень сложные промежуточные этапы внутри клеток. Одним из примеров является производство L - глутаминовой кислоты из глюкозы . Таким образом, 1 грамм глутаминовой кислоты может быть получен из 2 граммов глюкозы. Большинство аминокислот сегодня производится путем ферментации. Ежегодно во всем мире производится 6 миллионов тонн глутаминовой кислоты и лизина, частично из гидролизованного крахмала или патоки с использованием бактерий Escherichia coli или Corynebacterium glutamicum .
использовать
Аминокислоты имеют фундаментальное значение для питания человека, особенно потому, что незаменимые аминокислоты не могут быть произведены сами по себе. Как правило, при сбалансированной диете потребность в незаменимых аминокислотах полностью покрывается животными белками или подходящей комбинацией различных растительных белков (например, из злаков и бобовых). Растительные белки обычно имеют более низкую биологическую ценность . Корм для животных также обогащен аминокислотами, например B. DL - метионин и L - лизин , а также разветвленные аминокислоты (лейцин, изолейцин, валин), что увеличивает их пищевую ценность. Различные аминокислоты продаются в виде пищевых добавок .
Аминокислоты и их производные используются в качестве добавок к пище . В человеческом языке есть рецептор глутамата , активация которого обычно связана с усилением вкуса. Поэтому глутамат натрия используется как усилитель вкуса . Подсластитель аспартам содержит аминокислоту. Аминокислоты являются предшественниками некоторых ароматизаторов, которые образуются в результате реакции Майяра при сухом приготовлении пищи .
Аминокислоты используются в клеточной биологии и микробиологии как компоненты сред для культивирования клеток . В биохимии производные аминокислот, такие как фото-лейцин или фото-метионин, используются для определения структуры белков и других для маркировки молекул. Кроме того, аминокислоты также используются в качестве вспомогательных веществ, например Б. как солеобразователь , буфер . В фармации и медицине , L- аминокислоты используются в качестве инфузионных растворов для парентерального питания и в качестве стабилизаторов для некоторых заболеваний печени . L- Допа применяется при заболеваниях с дефицитом нейромедиаторов . Аминокислоты являются необходимыми исходными материалами для синтетических пептидных гормонов и для биосинтеза антибиотиков . Аспартаты магния и калия играют важную роль в лечении болезней сердца и системы кровообращения.
Цистеин или производные ацетилцистеина и карбоцистеина также используются при инфекционных заболеваниях бронхов с повышенной секрецией бронхов . Кроме того, L цистеин в качестве восстанавливающего агента в химической завивке . Аминокислоты добавляют в средства по уходу за кожей и шампуни в косметике .
метаболизм
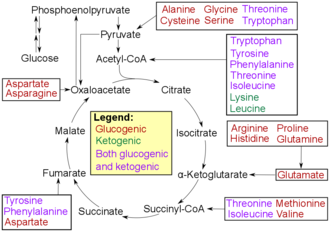
Аминокислоты можно разделить на кетогенные , глюкогенные и смешанные кето- и глюкогенные аминокислоты в соответствии с путями их распада . Кетогенные аминокислоты добавляются в цикл цитрата во время распада , глюкогенные аминокислоты - для глюконеогенеза . Кроме того, различные продукты распада с биологической активностью (например, нейротрансмиттеры ) образуются из аминокислот в процессе метаболизма . Триптофан является предшественником серотонина . Тирозин и его предшественник фенилаланин являются предшественниками катехоламинов дофамина , адреналина (синоним адреналина) и норадреналина (синоним норадреналина). Фенилаланин является предшественником фенэтиламина в организме человека. В растениях фенилаланин является предшественником фенилпропаноидов . Глицин является исходным материалом для синтеза порфирина ( гема ). Вторичное вещество- переносчик - монооксид азота - образуется из аргинина . Орнитин и S-аденозилметионин являются предшественниками полиаминов . Аспартат, глицин и глутамин являются исходными материалами для биосинтеза нуклеотидов.
При различных инфекциях человека патогенами описана конкуренция с хозяином за аминокислоты аспарагин, аргинин и триптофан.
литература
Книги
- Гарольд Харт: Органическая химия: Краткий учебник. ВЧ, 1989, ISBN 3-527-26480-9 .
- Джереми М. Берг, Люберт Страйер, Джон Л. Тимочко, Грегори Дж. Гатто: Биохимия. Macmillan Learning, 2015, ISBN 978-1-4641-2610-9 .
- GC Barrett: аминокислоты и пептиды. Cambridge University Press, 1998, ISBN 0-521-46827-2 .
- Уве Мейерхенрих : аминокислоты и асимметрия жизни. Springer-Verlag, Гейдельберг / Берлин 2008, ISBN 978-3-540-76885-2 .
- Хуберт Рем, Томас Летцель: Экспериментатор: Биохимия белка / Протеомика. 6-е издание. Издательство Spectrum Academic, Гейдельберг, 2009 г., ISBN 978-3-8274-2312-2 .
Журнальные статьи
- Лей Ван, Питер Г. Шульц : Расширение генетического кода. В: Angewandte Chemie. Том 117, №1, 2005 г., стр. 34-68.
- Х. Унеяма, Х. Кобаяси, Н. Тонучи: Новые функции и потенциальные применения аминокислот. В: Достижения биохимической инженерии / Биотехнологии . Том 159, 2017, стр 273-287,. Дои : 10.1007 / 10_2016_35 . PMID 27872968 .
- Бернд Хоппе, Юрген Мартенс: Аминокислоты - строительные блоки жизни. В кн . : Химия в наше время . 17-й год, № 2, 1983 г., стр. 41-53.
- Бернд Хоппе, Юрген Мартенс: Аминокислоты - производство и добыча. В кн . : Химия в наше время . 18-й год, № 3, 1984, стр. 73-86.
веб ссылки
Индивидуальные доказательства
- ^ Георг Лёффлер: Биохимия и патобиохимия. Springer-Verlag, 2013, ISBN 978-3-662-06062-9 , стр.25 .
- ↑ a b Катарина Мунк (Ред.): Биохимия - клеточная биология. Георг Тиме Верлаг, Штутгарт, 2008 г., ISBN 978-3-13-144831-6 , стр. 122, Google Книги .
- ↑ а б Питер Нун: Naturstoffchemie. S. Hirzel Wissenschaftliche Verlagsgesellschaft, Штутгарт 1990, ISBN 3-7776-0473-9 , стр. 70.
- ↑ Г. Генчи: Обзор D-аминокислот. В: Аминокислоты. Том 49, номер 9, сентябрь 2017 г., стр. 1521–1533, DOI: 10.1007 / s00726-017-2459-5 . PMID 28681245 .
- ↑ Исследователи НАСА впервые открыли строительный блок жизни в комете . nasa.gov, август 2009 г .; Хиральные аминокислоты в метеоритах подтверждают наличие внеземной жизни . spie.org, сентябрь 2010 г. (по состоянию на 4 октября 2010 г.).
- ↑ Л. Воклен, П. Робике: Открытие нового принципа растения в Asparagus sativus. В: Анналы де Шими. Том 57, 1806, с. 88-93.
- ↑ W. Rose et al.: Эксперименты по кормлению смесями высокоочищенных аминокислот. VIII. Выделение и идентификация новой незаменимой аминокислоты. В: Журнал биологической химии. Том 112, 1935, с. 283-302.
- ^ Р. Симони, Р. Хилл, М. Воган: открытие аминокислотного треонина: работа Уильяма К. Роуза. В: Журнал биологической химии. Том 277, № 37, 13 сентября 2002 г., стр. 56-58.
- ↑ Сабина Хансен: Открытие протеиногенных аминокислот с 1805 г. в Париже по 1935 г. в Иллинойсе. Берлин 2015.
- ^ Теодор Виланд: История химии пептидов. В: Бернд Гутте (ред.): Пептиды. Academic Press, 1995, стр. 2.
- ↑ a b Science Online Lexica: Об аминокислотах в лексиконе биологии. Проверено 25 апреля 2009 года.
- ^ Г. Лёффлер, П. Е. Петридес, П. К. Генрих: биохимия и патобиохимия. 8-е издание. Springer, Heidelberg 2007, ISBN 978-3-540-32680-9 .
- ↑ Хао Ван, Дэвид Фьюер, Лийза Холм, Лео Рухайайнен, Каарина Сивонена: Атлас путей биосинтеза нерибосомальных пептидов и поликетидов. Выявлена частая встречаемость немодульных ферментов . В: Proc Natl Acad Sci USA . Лента 111 , нет. 25 июня 2014 г., стр. 9259-9264 , PMC 4078802 (полный текст).
- ^ A b Международный союз теоретической и прикладной химии и Международный союз биохимии: номенклатура и символика аминокислот и пептидов (Рекомендации 1983 г.) . В: Pure & Appl. Chem . Лента 56 , нет. 5 , 1984, стр. 595-624 , DOI : 10,1351 / pac198456050595 .
- ↑ Паула Юрканис Брюс: Органическая химия. 4-е издание. Pearson Education, 2004 г., ISBN 0-13-121730-5 , стр. 960-962.
- ↑ Кацура Асано: Почему у эукариот такой точный выбор стартового кодона? В кн . : Перевод. Том 2, № 1, март 2014 г., DOI: 10.4161 / trla.28387 , PMC 4705826 (полный текст).
- ↑ Y. Fan, CR Evans, J. Ling: Перепрограммирование синтеза белка: от природных к синтетическим аминокислотам. В: Biochimica et Biophysica Acta . Том 1861, номер 11, часть B, 2017, стр. 3024-3029, DOI : 10.1016 / j.bbagen.2017.01.014 . PMID 28095316 , PMC 5511583 (полный текст).
- ↑ Катрин Ланг, Ллойд Дэвис и др.: Генетически кодируемый норборнен направляет сайт-специфическое мечение клеточного белка посредством быстрой биоортогональной реакции. В кн . : Химия природы . 2012, стр. 298-304, DOI : 10.1038 / nchem.1250 .
- ↑ Научный отчет о биологической ценности - Какие есть аминокислоты: Незаменимые аминокислоты
- ↑ a b c WR Taylor: Классификация консервации аминокислот. В: Журнал теоретической биологии. Том 119, 1986 год, стр. 205-218. DOI: 10.1016 / S0022-5193 (86) 80075-3 .
- ^ Георг Лёффлер: Базовые знания биохимии. (= Учебник Springer ). Гейдельберг 2005, ISBN 3-540-23885-9 , стр.24 .
- ↑ Брюс Альбертс, Александр Д. Джонсон, Джулиан Льюис, Мартин Рафф, Кейт Робертс, Питер Уолтер Альбертс, Джонсон, Льюис, Рафф, Робертс, Уолтер: Молекулярная биология клетки. WILEY-VCH Verlag, Weinheim 2004, ISBN 3-527-30492-4 , стр. 152.
- ^ Зигфрид Гауптманн : органическая химия. 2-е исправленное издание. Немецкое издательство базовой промышленности ВЭБ, Лейпциг, 1985, ISBN 3-342-00280-8 , стр. 506-507.
- ↑ Дж. Кайт, Р.Ф. Дулиттл: простой метод отображения гидропатического характера белка . В: Журнал молекулярной биологии . Лента 157 , нет. 1 , 1982, стр. 105-132 , PMID 7108955 .
- ↑ Изображение недоступно, потому что с пролином на основе пептида на один атом водорода на азоте меньше ( вторичный амин ), потому что боковая цепь образует кольцо с атомом азота (–NHCH 2 CH 2 CH 2 -).
- ↑ Жан-Пьер Мотет, Анжель Т. Пэрент, Герман Волоскер, Роско О. Брэди, младший, Дэвид Дж. Линден, Кристофер Д. Феррис, Майкл А. Рогавски, Соломон Х. Снайдер: d-серин является эндогенным лигандом для глициновый сайт рецептора N- метил-d-аспартата . В: Proc. Natl. Акад. Sci. США . Лента 97 , нет. 9 , 2000, стр. 4926-4931 , DOI : 10.1073 / pnas.97.9.4926 , PMID 10781100 , PMC 18334 (бесплатно полный текст).
- ↑ Карлхайнц Драуз, Ханс Гюнтер Кобан, Юрген Мартенс , Вернер Шварце : Аналоги пеницилламина на основе фосфоновых и фосфиновых кислот . В: Анналы химии Либиха . Лента 1985 , нет. 3 , 1985, стр. 448-452 , DOI : 10.1002 / jlac.198519850303 .
- ↑ Д.А. Веллингс, Э. Атертон: Стандартные протоколы Fmoc. В кн . : Методы энзимологии. Том 289, 1997, стр. 44-67. PMID 9353717
- ^ Бинг Ян: Аналитические методы в комбинаторной химии, второе издание. CRC Press, 2011, ISBN 978-1-4398-5760-1 .
- ↑ Ю. Сонг, К. Сюй, Х. Куроки, Ю. Ляо, М. Цунода: Последние тенденции в аналитических методах определения аминокислот в биологических образцах. В кн . : Журнал фармацевтического и биомедицинского анализа. Том 147, январь 2018 г., стр. 35-49, DOI: 10.1016 / j.jpba.2017.08.050 . PMID 28927726 .
- ^ A b Здзислав Э. Сикорский: Химические и функциональные свойства пищевых белков. CRC Press, 2001, ISBN 1-56676-960-4 , стр. 71, 219.
- ↑ Мебус А. Гейх, Гельмут Шлейхер: Абсолютное определение возраста - физические и химические методы датирования и их применение. Springer-Verlag, Берлин / Гейдельберг 1990, ISBN 3-540-51276-4 , стр. 345-371.
- ↑ Н. Фуджи, Т. Таката, Н. Фуджи, К. Аки, Х. Сакауэ: D-аминокислоты в белке: зеркало жизни как молекулярный показатель старения. В: Biochimica et Biophysica Acta . [электронная публикация перед печатью] март 2018 г., doi: 10.1016 / j.bbapap.2018.03.001 . PMID 29530565 .
- ↑ a b c Л. Ф. Физер, М. Физер: Учебник органической химии. 3. Издание. Verlag Chemie, 1957, с. 506.
- ↑ а б Л. Ф. Физер, М. Физер: Учебник органической химии. 3. Издание. Verlag Chemie, 1957, с. 507.
- ↑ LF Fieser, M. Fieser: Учебник органической химии. 3. Издание. Verlag Chemie, 1957, с. 511.
- ↑ LF Fieser, M. Fieser: Учебник органической химии. 3. Издание. Verlag Chemie, 1957, с. 516.
- ↑ а б Л. Ф. Физер, М. Физер: Учебник органической химии. 3. Издание. Verlag Chemie, 1957, с. 508.
- ↑ а б Л. Ф. Физер, М. Физер: Учебник органической химии. 3. Издание. Verlag Chemie, 1957, с. 510.
- ↑ Бернд Хоппе, Юрген Мартенс : Аминокислоты - производство и добыча. В кн . : Химия в наше время . 18-й год, № 3, 1984, стр. 73-86.
- ↑ Н. Тонучи, Х. Ито: Современное положение с аминокислотами в промышленности в мире. В: Достижения биохимической инженерии / Биотехнологии . Том 159, 2017, стр 3-14,. Дои : 10.1007 / 10_2016_23 . PMID 27832295 .
- ^ A b М. Д'Эсте, М. Альварадо-Моралес, И. Ангелидаки: Производство аминокислот с упором на технологии ферментации - обзор. В: Достижения биотехнологии . Том 36, номер 1, январь-февраль 2018 г., стр. 14-25, DOI: 10.1016 / j.biotechadv.2017.09.001 . PMID 28888551 .
- ↑ Дж. Х. Ли, В. Ф. Вендиш: Производство аминокислот - подходы генетической и метаболической инженерии. В: Биоресурсные технологии . Volume 245, Pt B, декабрь 2017 г., стр. 1575–1587, DOI: 10.1016 / j.biortech.2017.05.065 . PMID 28552565 .
- ↑ Запись о ценности белка. В: Römpp Online . Георг Тиме Верлаг, доступ 18 января 2013 г.
- ↑ К. Ямамото, А. Цучисака, Х. Юкава: Аминокислоты с разветвленной цепью. В: Достижения биохимической инженерии / Биотехнологии. Том 159, 2017, стр 103-128,. Дои : 10.1007 / 10_2016_28 . PMID 27872960 .
- ↑ Вольфганг Легрум: Ароматы, Между вонью и запахом: Возникновение, свойства и использование ароматов и их смесей. Gabler Wissenschaftsverlage, 2011, стр. 165 ( ограниченный предварительный просмотр в поиске книг Google).
- ↑ К.В. Савельева, С. Чжао, В.М. Погорелов, И. Раджан, К. Ян, Э. Куллинан, Т.Х. Ланторн: Генетическое нарушение обоих генов триптофангидроксилазы резко снижает уровень серотонина и влияет на поведение в моделях, чувствительных к антидепрессантам . В: PLOS ONE . Лента 3 , вып. 10 , 2008, статья e3301 , doi : 10.1371 / journal.pone.0003301 , PMID 18923670 , PMC 2565062 (свободный полный текст), bibcode : 2008PLoSO ... 3.3301S .
- ↑ Дэвид Шемин , Д. Риттенберг: Биологическое использование глицина для синтеза протопорфирина гемоглобина . В: Журнал биологической химии . Лента 166 , нет. 2 , декабрь 1946 г., стр. 621-5 , PMID 20276176 ( jbc.org ).
- ↑ J. Tejero, A. Biswas, ZQ Wang, RC Page, MM Haque, C. Hemann, JL Zweier, S. Misra, DJ Stuehr: Стабилизация и характеристика промежуточного соединения гемоксигруппы в индуцибельной синтазе оксида азота . В: Журнал биологической химии . Лента 283 , нет. 48 , ноябрь 2008 г., стр. 33498-507 , doi : 10.1074 / jbc.M806122200 , PMID 18815130 , PMC 2586280 (полный текст).
- ↑ К. Родригес-Касо, Р. Монтаньес, М. Касканте, Ф. Санчес-Хименес, М. А. Медина: Математическое моделирование метаболизма полиаминов у млекопитающих . В: Журнал биологической химии . Лента 281 , нет. 31 августа 2006 г., стр. 21799-21812 , DOI : 10,1074 / jbc.M602756200 , PMID 16709566 .
- ↑ Люберт Страйер, Джереми М. Берг, Джон Л. Тимочко: Биохимия . 5-е издание. WH Freeman, Нью-Йорк 2002, ISBN 978-0-7167-4684-3 , стр. 693-698 .
- ↑ W. Ren, R. Rajendran, Y. Zhao, B. Tan, G. Wu, FW Bazer, G. Zhu, Y. Peng, X. Huang, J. Deng, Y. Yin: аминокислоты как медиаторы метаболизма Перекрестный разговор между хозяином и патогеном. В кн . : Границы иммунологии. Том 9, 2018 г., стр. 319, DOI: 10.3389 / fimmu.2018.00319 . PMID 29535717 , PMC 5835074 (полный текст).