Охраняющая группа


Защитная группа ( английский защитная группа - поэтому часто называют общее сокращением в формуле схемах PG ) в химии на заместитель , который, в течение более сложного, многостадийный химического синтеза в молекуле вводит к конкретной функциональной группе для защиты временно и поэтому нежелательная реакция для предотвращения этой группы. После того, как желаемая реакция была проведена в другом месте молекулы, защитная группа снова отщепляется. Для многих функциональных групп известно несколько возможных защитных групп, которые различаются по своей стабильности и условиям их расщепления.
При синтезе специальных классов соединений с повторяющимися функциональными группами - как правило, это биомолекулы, такие как пептиды , олигосахариды или нуклеотиды, - стали установлены стандартные наборы защитных групп. Сегодня защитные группы стали важным инструментом в синтезе сложных соединений.
Требования к группе защиты достаточно высоки. Это включает в себя то, что он может быть введен специально в функциональную группу с очень хорошим выходом и что он также должен иметь возможность снова отщепляться в мягких условиях. Должна быть возможность стандартизировать условия реакции для обеих стадий. Кроме того, защитная группа должна быть стабильной при максимально возможном количестве условий реакции. Если возможно, полученные продукты реакции должны легко разделяться, и в оптимальном случае реагент с защитной группой также является недорогим. Чем шире опыт работы с защитной группой, тем лучше предсказуемость реактивности защитной группы.
история
История технологии защитных групп неразрывно связана с целевым использованием различных исходных соединений для синтеза целевой молекулы. Ранние защитные группы обычно основывались на том факте, что исходное соединение было выбрано таким образом, чтобы реакционноспособная функциональная группа блокировалась остатком и, таким образом, была неактивной. Так были z. Б. выбрал анизолы вместо фенолов или сложные эфиры вместо свободных спиртовых групп . Только с целевым синтезом все более сложных соединений, появившихся в начале 20-го века, технология защитных групп стала действительно важной. Примерно с 1960 года значительные затраты на исследования стали вкладываться в химию защитных групп. За это время химики начали синтезировать все более сложные натуральные продукты . Особого внимания заслуживают работы лауреатов Нобелевской премии Роберта Б. Вудворда , Элиаса Дж. Кори и Альберта Эшенмозера , пионеров в синтезе сложных природных веществ.
Сегодня существует большое количество защитных групп, свойства которых обобщены в монографиях . Помимо установленных защитных групп, существует множество экзотических защитных групп, которые были разработаны только для синтеза или в очень специальной области.
Требования к группе защиты
Введение и удаление защитных групп не представляет собой продуктивных реакций в последовательности стадий синтеза; их продукт не приближается к желаемому конечному продукту синтеза. По этой причине к реакциям защитных групп часто предъявляются высокие требования с точки зрения цены, выхода и усилий по разработке реакции.
Следующие характеристики стали основными требованиями к хорошей группе защиты:
- Реагент должен быть коммерчески доступным и недорогим и легким в изготовлении
- Защитная группа должна быть простой, специфической и способной вноситься с высокими урожаями.
- Он должен быть устойчивым к максимально возможному количеству условий реакции и методов обработки и очистки.
- Он должен быть специфическим, очень селективным и способным отделяться с высокими урожаями. Должна быть возможность стандартизировать условия.
- Он не должен образовывать новый стереоцентр или диастереотопный центр.
- Он должен быть легко распознаваемым в спектрах ЯМР и как можно меньше мешать из-за перекрытия сигналов.
Высокая селективность расщепления представляет собой очень важный аспект, поскольку разные функциональные группы часто необходимо защищать и снимать защиту независимо друг от друга. В идеале процесс расщепления влияет только на одну из множества защитных групп. Поведение защитных групп на практике не всегда может быть правильно предсказано на основе литературы, особенно если в одной молекуле используется несколько различных защитных групп. Следовательно, в некоторых случаях, несмотря на богатый опыт, все же необходимо проделать значительную работу по развитию во время синтеза как для введения, так и для расщепления.
Ортогональность защитных групп

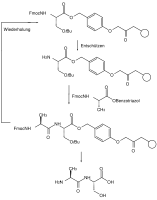
Ортогональность защитных групп означает, что при использовании нескольких защитных групп разных типов каждая защитная группа может быть отделена индивидуально и в любом порядке на основе различных расщепляющих реагентов без воздействия на одну из других защитных групп. В показанном примере защищенной аминокислоты тирозина бензиловый эфир может быть расщеплен гидрогенолитически , флуоренилметиленоксигруппа (Fmoc) - основаниями (например, пиперидином ) и фенольным трет-бутиловым эфиром - кислотами (например, трифторуксусной кислотой ).
Широко распространенным примером этого применения является синтез пептида Fmoc, который приобрел большое значение как в растворе, так и на твердой фазе. Защитные группы в твердофазном синтезе должны быть стандартизованы в отношении условий реакции, таких как время реакции, температура и реагенты, чтобы их можно было проводить с помощью машины и достигать выходов более 99%, поскольку в противном случае разделение образования смеси продуктов реакции практически невозможно.
Другое важное применение ортогональных защитных групп - химия углеводов . Поскольку углеводы имеют гидроксильные группы с очень похожей реакционной способностью, защита или снятие защиты с отдельных гидроксильных групп должна быть возможной для целевого синтетического превращения. Синтез нуклеотидов представляет собой аналогичный случай.С одной стороны, существует проблема (как и в случае с синтезом пептидов), что молекулы являются векторными. С другой стороны, существует также проблема химии углеводов с сахарным остатком рибозы при синтезе молекул РНК .
Но также при синтезе сложных природных веществ или активных ингредиентов со многими функциональными группами зависит от ортогональности защитных групп.
Лабильность или отщепление защитных групп
В случае защитных групп были установлены различные условия реакции, соответствующие принципу ортогональности, при которых защитные группы отщепляются. Грубо говоря, можно выделить следующие условия спайности:
- Кислотно-лабильные защитные группы
- Основные лабильные защитные группы
- Фторид-лабильные защитные группы
- Ферментно-лабильные защитные группы
- Восстановительно- лабильные защитные группы
- Устойчивые к окислению защитные группы
- Защитные группы, расщепляемые солями тяжелых металлов или их комплексами
- Фотолабильные защитные группы
- Двухступенчатые защитные группы
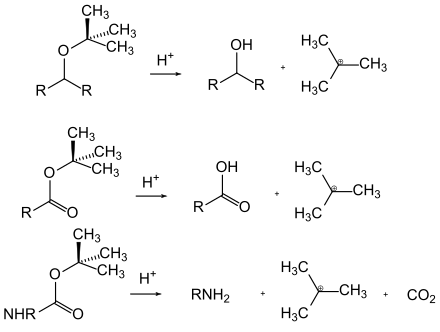
Кислотно-лабильные защитные группы могут быть отщеплены под действием кислот. Движущей силой здесь часто является образование относительно стабильного карбокатиона или катализируемого кислотой равновесия, которое находится на стороне свободной функциональной группы. Примерами кислотолабильных защитных групп являются трет-бутиловые эфиры, простые эфиры и карбаматы, которые образуют стабильные катионы, и ацетали , в которых в присутствии воды катализируемое кислотой равновесие находится на стороне соответствующих альдегидов или кетоны.
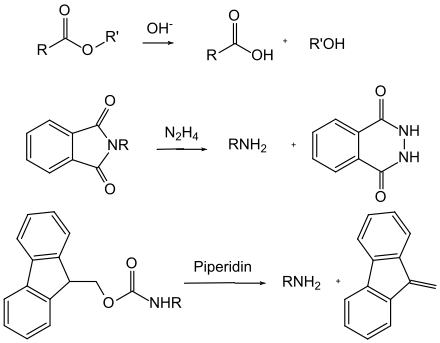
В случае лабильных к основанию защитных групп можно провести различие по механизму между основным гидролизом и индуцированным основанием β-элиминированием . Сложные эфиры карбоновых кислот (за исключением трет-бутиловых эфиров) подвергаются нуклеофильной атаке гидроксид-ионами и, таким образом, гидролитически расщепляются. Амиды, с другой стороны, редко расщепляются таким образом, потому что они требуют очень суровых условий. Фталоильная группа является исключением , поскольку она расщепляется гидразином в очень мягких условиях. Во время β-элиминирования происходит каскад реакций: сначала протон отщепляется основанием и образуется карбанион. Затем защитная группа отщепляется подходящей уходящей группой с образованием винилового соединения . В последнем случае группа Fmoc является одной из важнейших.
Ионы фтора образуют очень прочную связь с кремнием . Таким образом, кремниевые защитные группы практически без исключения отщепляются фторид-ионами. Однако в зависимости от типа противоиона или расщепляющего реагента различные защитные группы кремния также могут быть выборочно отщеплены в зависимости от стерических препятствий атома кремния. Преимущество лабильных фтористых групп защитных групп состоит в том, что никакая другая защитная группа не подвергается атаке в условиях расщепления.
Сложные эфиры часто могут расщепляться ферментами, такими как липазы . Поскольку ферменты работают при pH от 5 до 9 и при умеренных температурах около 30-40 ° C, а также очень селективны в отношении карбоновой кислоты, этот метод используется редко, но очень привлекателен для расщепления защитных групп.
Бензильные группы можно отщепить восстановительным путем каталитическим гидрированием . Бензильные группы используются в виде простых и сложных эфиров, уретанов, карбонатов или ацеталей и используются для защиты спиртов, карбоновых кислот, аминов и диолов.
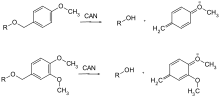
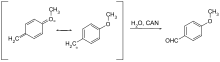
Используются только несколько защитных групп, которые можно удалить окислением. Как правило, это метоксибензиловый эфир. Они могут быть расщеплены нитратом церия (IV), аммония (CAN) или дихлородицианобензохиноном (DDQ) через хинометин .
Двойная связь аллил радикал может быть изомеризуется с виниловым соединением с помощью элементов платиновой группы (например, палладий , иридий или платину ) . Полученные таким образом енольные эфиры в случае защищенных спиртов или енамины в случае защищенных аминов могут легко гидролизоваться в кислых условиях.
Фотолабильные защитные группы содержат хромофор, который может быть активирован облучением с подходящей длиной волны и, таким образом, отщеплен. О- нитробензильная группа (ONB) указана здесь в качестве примера .
Двухступенчатые защитные группы представляют собой особую форму защитных групп, которые характеризуются высокой стабильностью, поскольку защитная группа сначала должна быть преобразована в расщепляемую группу путем химического превращения. Однако этот тип защитной группы используется редко, поскольку здесь необходима дополнительная стадия активации, которая продлевает синтез на следующую стадию.
Функциональные группы
Амины
До сих пор наибольшее разнообразие защитных групп доступно для функциональной аминогруппы . Это связано, с одной стороны, с тем фактом, что амины имеют особое значение в синтезе пептидов , но также и с их свойствами: с одной стороны, они являются довольно сильными нуклеофилами , но также относительно сильными основаниями . Эти свойства привели к разработке новых защитных групп для аминов.
Многие защитные группы для аминов основаны на карбаматах . Они могут быть легко введены в форме хлоридов карбоновых кислот. Они получают свою движущую силу в расщеплении от образования очень стабильной молекулы углекислого газа . Были разработаны различные варианты расщепления на основе различных остатков карбамата. Наиболее часто используемые карбаматы представляют собой трет- бутилоксикарбонил, бензилоксикарбонил, флуоренилметиленоксикарбонил и аллилоксикарбонильные соединения.
| отдых | формула | Фамилия | сокращение | расщепление |
|---|---|---|---|---|
| трет- бутил | 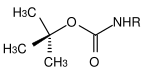 |
трет- бутилоксикарбонил | Boc | сердитый; Трифторуксусная кислота (TFA) в чистом виде или в виде раствора в дихлорметане , 3 М соляной кислоты в этилацетате или 10% серной кислоты в диоксане |
| Бензил | 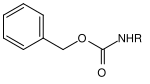 |
Бензилоксикарбонил | Cbz или Z | гидрогенолитический; Водород и палладий на активированном угле , литий или натрий в жидком аммиаке |
| Флуоренилметилен | 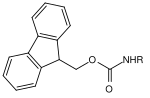 |
Флуоренилметилен оксикарбонил | Fmoc | базовый; 20–50% пиперидина в диметилформамиде (ДМФ) или N-метил-2-пирролидоне , 50% морфолина в ДМФ для чувствительных гликопептидов |
| Аллил | 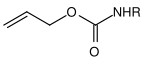 |
Аллилоксикарбонил | Распределить | расщепление, катализируемое переходными металлами; Металлы, такие как комплексы палладия (0) или никеля (0) |
Помимо карбаматов, ряд других N- ацильных производных важны в качестве защитных групп, но далеко не так широко распространены. К ним относятся, например, фталимиды , которые доступны либо путем реакции первичных аминов с фталевым ангидридом, либо путем наращивания аминогруппы посредством синтеза Габриэля . Фталимиды обычно расщепляются гидразингидратом или боронатом натрия . Трифторацетамиды очень легко омыляются в основании , поэтому ацетамиды, полученные реакцией с трифторуксусным ангидридом , иногда используются в качестве защитной группы для аминов.
В случае индолов , пиррола и имидазолов , то есть гетероциклических соединений, N- сульфонильные производные используются в качестве защитных групп. В случае нормальных аминов эта защитная группа часто слишком устойчива. Представление происходит здесь сульфировании с хлоридом фенилсульфонил и депротонированный гетероцикл. Расщепление происходит путем основного гидролиза. N- ацильные производные первичных и вторичных аминов относительно легко доступны путем взаимодействия аминов с хлорангидридом арилсульфоновой кислоты, но могут быть получены только с трудом, например. B. быть расщепленным в условиях восстановления по Березе ( натрий в жидком аммиаке ) или реакцией с нафталидом натрия .
Среди N- алкильных производных, представляемые алкилированием или восстановительным алкилированием, некоторое значение имеют производные N- бензила. Как и в случае группы Cbz, расщепление происходит восстановительно и обычно путем каталитического гидрирования или восстановления по Берчу. Здесь N- алкиламины имеют решающий недостаток по сравнению с карбаматами или амидами, заключающийся в сохранении основного азота.
Спирты
Классической защитной группой для спиртов являются сложные эфиры карбоновых кислот . Сложные эфиры предшественников часто имеются в продаже или могут быть легко получены взаимодействием спиртов с хлорангидридами или ангидридами кислот по реакции Шоттена-Баумана или путем переэтерификации . Сложные эфиры обычно расщепляются реакцией с нуклеофилами, такими как гидроксиды щелочных металлов, алкоголяты щелочных металлов или органические соединения лития или магния ; альтернативно также восстановительным путем реакции с комплексными гидридами, такими как алюмогидрид лития . Реактивность сложного эфира по отношению к нуклеофильной атаке снижается со стерическими затруднениями карбоновой кислоты в следующем порядке:
- Хлорацетил> ацетил> бензоил> пивалоил
Реакционная способность спиртов также снижается с увеличением стерических затруднений спиртов:
Наиболее важные сложные эфиры, используемые в качестве защитных групп являются кислыми сложными эфирами уксусными , как сложные эфиры бензойной кислоты и сложные эфиры пивалиновой кислоты , так как они могут быть отделились друг от друга в различных формах в соответствии с реакционными данными.
Наиболее важные защитные группы спиртов и фенолов включают хорошо изученные и задокументированные тризамещенные силиловые эфиры . Кремний несет как алкильные, так и арильные группы в качестве органических радикалов. Этот тип защитной группы имеет то преимущество, что ее можно очень легко ослабить в отношении введения и особенно в отношении расщепления. Эти простые эфиры получают либо путем синтеза эфира Вильямсона из хлорсилана и иона алкоголятов, либо с использованием активирующих реагентов, таких как имидазол .
Для чисто аналитических целей, например Б. Чтобы сделать углевод летучим и обнаружить его с помощью ГХ-МС , существуют коммерчески доступные реакционные наборы. Силиловые эфиры обычно чувствительны к кислотам и фторид-ионам. Последний в основном используется для их разделения. Однако коммерческие цены на хлорсиланы сильно различаются в зависимости от замещения. Самый дешевый хлорсилан здесь - хлортриметилсилан (TMS-Cl), который, по мнению Рохова и Мюллера , является побочным продуктом производства силикона . Другой распространенный источник триметилсилильной группы - гексаметилдисилазан (HMDS). Однако простые эфиры триметилсилила также чрезвычайно чувствительны к кислотному гидролизу (например, силикагель достаточен в качестве донора протонов) и поэтому в настоящее время редко используются в качестве защитной группы.
| Фамилия | формула | сокращение | расщепление |
|---|---|---|---|
| Триметилсилил | 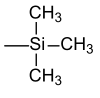 |
ТМС | Фторид калия , уксусная кислота или карбонат калия в метаноле |
| Триэтилсилил |  |
TES | В 10-100 раз стабильнее, чем группа ТМС; Трифторуксусная кислота в воде / тетрагидрофуране , уксусная кислота в воде / тетрагидрофуране, фтористоводородная кислота , гидрофторид пиридиния в пиридине |
| трет- бутилдиметилсилил |  |
TBS, TBDMS | Уксусная кислота в тетрагидрофуране / воде, тозилат пиридиния в метаноле, трифторуксусная кислота в воде, фтористоводородная кислота в ацетонитриле , гидрофторид пиридиния в тетрагидрофуране, фторид тетрабутиламмония в ТГФ |
| Триизопропилсилил |  |
ЧАЕВЫЕ | В тех же условиях, что и TBS, но с более длительным временем реакции; Фторид тетрабутиламмония в тетрагидрофуране, плавиковая кислота в ацетонитриле, гидрофторид пиридиния в тетрагидрофуране. |
| трет- бутилдифенилсилил | 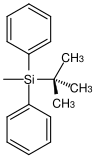 |
TBDPS | В тех же условиях, что и TBS, но с более длительным временем реакции (в 100–250 раз медленнее, чем TBS, и в 5–10 раз медленнее, чем TIPS); Фторид тетрабутиламмония в тетрагидрофуране, фтористоводородная кислота в ацетонитриле, гидрофторид пиридиния в тетрагидрофуране |
Другой класс защитных групп для спиртов - это простые алкиловые эфиры. Здесь также есть различные и ортогональные возможности расщепления эфиров. Алифатические метоксиэфиры трудно расщеплять в жестких условиях, поэтому их обычно используют только с фенолами.
| Фамилия | формула | сокращение | расщепление |
|---|---|---|---|
| метил | Мне | Обычно используется только для фенолов; Йодотриметилсилан в хлороформе , дихлорметане или ацетонитриле, трибромид бора или трихлорид бора в дихлорметане, кислоты Льюиса (хлорид алюминия, трифторид бора в присутствии тиолов) | |
| Бензил |  |
Млрд | восстановительный; Каталитическое гидрирование (палладий на активированном угле, никель Ренея или родий на оксиде алюминия в качестве катализатора) |
| п- метоксибензил | PMB, MPM | окислительный; DDQ (дихлордицианохинон) в дихлорметане, хлорид церия-аммония в воде | |
| 3,4-диметоксбензил | 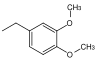 |
DMB, DMPM | как окислительный PMB; DDQ (дихлордицианохинон) в дихлорметане, хлорид церия-аммония в воде |
| Трифенилметил (тритил) | 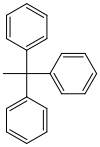 |
Тр | сердитый; Муравьиная кислота в эфире или воде, 80% уксусная кислота, 1 М соляная кислота |
| трет- бутил |  |
сердитый; безводная трифторуксусная кислота, бромистоводородная кислота / уксусная кислота, 4 н. соляная кислота | |
| Аллил | Трет- бутанолат калия , палладий на активированном угле, DABCO в метаноле, различные комплексы платиновых элементов - затем кислотная обработка. | ||
| Аллилоксикарбонил | Распределить | Как аллил; Трет- бутанолат калия , палладий на активированном угле, DABCO в метаноле, различные комплексы платиновых элементов - затем кислотная обработка | |
| Метоксиметил | МАМА | Сердитый; 6 М соляная кислота в тетрагидрофуране / воде | |
| Метилтиометил | MTM | Хлорид ртути (II) / карбонат кальция в ацетонитриле / воде, нитрат серебра в тетрагидрофуране / воде | |
| (2-метоксиэтокси) метил | MEM | Водная бромистоводородная кислота в тетрагидрофуране, бромид цинка в дихлорметане | |
| Бензилоксиметил | Спецификация | Сравним со стабильностью MOM, MEM и SEM; Восстановительный; Натрий в жидком аммиаке, каталитическое гидрирование (гидроксид палладия на активированном угле), никель Ренея в этаноле | |
| β- (триметилсилил) этоксиметил | 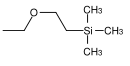 |
SEM | Более лабильны, чем MEM и MOM по отношению к кислотному гидролизу; 0,1 М соляная кислота в метаноле, концентрированная фтористоводородная кислота в ацетонитриле, эфират трифторида бора в дихлорметане, фторид тетрабутиламмония в HMPT ( триамид гексаметилфосфорной кислоты) или в тетрагидрофуране |
| Тетрагидропиранил |  |
THP | Уксусная кислота в тетрагидрофуране / воде, п- толуолсульфоновая кислота в метаноле |
1,2-диолы
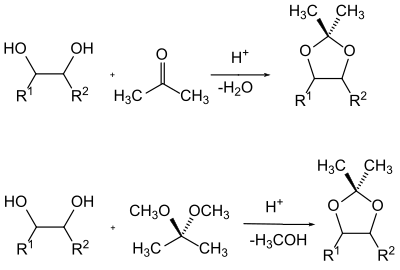
1,2-диолы ( гликоли ) представляют собой особый класс спиртов в химии защитных групп . Б. В случае сахаров воспользоваться преимуществом того факта, что обе гидроксильные группы защищены как ацетали в зависимости друг от друга . Обычно здесь используются бензилиден , изопропилиден и циклогексилиден или циклопентилиденацетали .
Ацетали обычно получают путем сдвига равновесия смеси гликоля с карбонильным компонентом путем удаления реакционной воды или путем трансацетализации простым ацеталем и удаления спирта, образовавшегося из реакционной смеси.
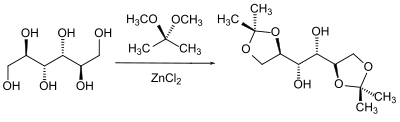
В частности, в химии сахаров различные положения гидроксильных групп относительно друг друга используются для их избирательной защиты в определенной стереохимической зависимости. В дополнение к другим возможным комбинациям две соседние гидроксильные группы, которые образуют наиболее стабильную конформацию, предпочтительно реагируют друг с другом.
В принципе, ацетали можно снова расщепить в водных кислотных растворителях. Бензилиденовая защитная группа, которая также может быть расщеплена восстановительным путем, представляет собой особый случай. Это осуществляется либо каталитическим гидрированием, либо гидрид- донором диизобутилалюминийгидридом (DIBAL). Однако расщепление с помощью DIBAL снимает защиту только с одной спиртовой группы, поскольку бензильный остаток остается на второй и более пространственно затрудненной гидроксильной группе, чем бензиловый эфир.
Карбонильные группы
Карбонильные группы в первую очередь подвержены риску нуклеофильных атак, таких как реагенты Гриньяра или гидрид-ионы. Альдегиды также могут окисляться до карбоновых кислот. Но также и нежелательные реакции, вызванные реакциями карбонильной группы, катализируемыми кислотой и основанием, например. Б. Альдольные реакции можно предотвратить с помощью подходящей защитной группы.
Наиболее распространенными защитными группами для карбонильных групп являются ацетали и особенно циклические ацетали с диолами. Кроме того, также используются циклические ацетали с 1,2-гидрокситиолами или дитиогликолами - так называемые O , S или S , S ацетали.
Для ацеталей в качестве защитной группы для карбонильных соединений в принципе применимо то же самое, что и для ацеталей в качестве защитной группы для 1,2-диолов. И производство, и расщепление естественно идентичны. Однако при использовании ацеталей в качестве защитной группы процесс трансацетализации играет второстепенную роль, и они обычно производятся из гликолей путем отщепления воды. В более современных вариантах также используются гликоли, в которых гидроксильные атомы водорода заменены триметилсилильной группой. Обычно простые гликоли, такие как этиленгликоль или 1,3-пропандиол, используются в качестве диолов для ацеталей.
Ацетали можно расщеплять в кислых водных условиях. Минеральные кислоты используются как кислоты. Сорастворителем часто является ацетон , который используется в качестве солюбилизатора. В качестве некислотного метода элиминирования можно использовать комплекс хлорид палладия (II) -ацетонитрил в ацетоне или хлорид железа (III) на силикагеле, абсорбированный в хлороформе.
Циклические ацетали намного более устойчивы к кислотному гидролизу, чем ациклические ацетали. Следовательно, ациклические ацетали используются почти исключительно в том случае, если необходимо очень мягкое расщепление или если необходимо дифференцировать две разные защищенные карбонильные группы в отношении их высвобождения.
Однако, помимо их единственной функции в качестве защитной группы, ацетали также используются в качестве хиральных вспомогательных реагентов. Итак, ацетали хиральных гликолей, такие как. Б. производные винной кислоты могут быть раскрыты асимметрично с высокой селективностью. Это позволяет создавать новые центры хиральности.
Помимо O , O- ацеталей, S , O- и S , S- ацетали также имеют, хотя и меньшее значение, в качестве карбонильной защитной группы. Тиолы , которые должны использоваться для производства этих ацеталей, имеют очень неприятный запах и ядовиты, что сильно ограничивает их использование. Тиоацетали и смешанные S , O- ацетали, по сравнению с чистыми O , O- ацеталями, намного более устойчивы к кислотному гидролизу. Это делает возможным селективное расщепление этих карбонильных групп в присутствии защищенных серой карбонильных групп.
S , S ацетали обычно получают аналогично O , O ацетали путем кислотного катализа из дитиолов и компонента карбонильной. Благодаря высокой стабильности тиоацеталей равновесие находится на стороне ацеталей. В отличие от ацеталей O , O , не нужно удалять воду из реакции, чтобы сместить равновесие.
Ацетали S , O гидролизуются в 10000 раз быстрее, чем соответствующие ацетали S , S. Они производятся аналогично этим из тиоспиртов. Их расщепление также происходит в сопоставимых условиях и в первую очередь через соединения ртути (II) в водном ацетонитриле.
Временная защита карбонильной группы в присутствии кетонов в виде полуаминального аниона была описана для альдегидов . Это использует тот факт, что альдегиды обладают гораздо более высокой карбонильной активностью, чем кетоны, и что многие реакции присоединения являются обратимыми.
Карбоксильные группы
Наиболее важными защитными группами для карбоксильных групп являются сложные эфиры различных спиртов. Также используются ортоэфиры и оксазолины , но они имеют второстепенное значение. Существуют принципиально разные методы производства сложных эфиров карбоновых кислот:
- Прямая этерификация карбоновых кислот и спиртовых компонентов. Из-за неблагоприятного равновесия в реакции между спиртами и карбоновыми кислотами равновесие должно достигаться либо путем удаления реакционной воды, либо путем работы с большим избытком спирта. Однако для этого алкоголь должен быть очень дешевым. Эта реакция является катализируемой кислотой (серная кислота, п- толуолсульфоновая кислота или кислотные ионообменники являются наиболее распространенными катализаторами этерификации).
- Реакция ангидридов кислот или хлорангидридов со спиртами в присутствии вспомогательных оснований. В качестве вспомогательных оснований здесь часто используются пиридин , диизопропилэтиламин или триэтиламин . Эту реакцию можно катализировать с помощью 4- N , N- диметиламинопиридина , который увеличивает скорость реакции в 10 4 раз по сравнению с чистым пиридином . По сравнению с прямой этерификацией эти методы проводят в очень мягких условиях.
- Реакция солей карбоновых кислот с алкилгалогенидами - еще один метод получения сложных эфиров карбоновых кислот.
- Реакция карбоновых кислот с изобутеном - щадящий метод получения трет-бутиловых эфиров. Здесь изобутен реагирует с карбоновой кислотой в присутствии сильной кислоты, такой как серная кислота.
- Реакция карбоновых кислот с диазоалканами - очень щадящий и количественный метод получения сложных эфиров. Однако из-за плохой доступности сложных диазоалканов он в основном используется только для производства метиловых и бензгидриловых эфиров.
В дополнение к этим классическим методам этерификации были разработаны другие, более современные методы для специальных реакций.
- Активация карбоновой кислоты дициклогексилкарбодиимидом и реакция полученной таким образом O- ацилизомочевины со спиртовым компонентом в присутствии 4- N , N- диметиламинопиридина ( этерификация по Стеглиху ).
- Активация карбоновой кислоты путем получения смешанного ангидрида с 2,4,6-трихлорбензойной кислотой путем взаимодействия карбоновой кислоты с бензоилхлоридом в присутствии 4- N , N- диметиламинопиридина и триэтиламина. Смешанный ангидрид образуется на месте и немедленно подвергается дальнейшей реакции со спиртовым компонентом ( этерификация Ямагути ).
- Активация спиртового компонента посредством реакции в условиях Мицунобу с диэтилазодикарбоксилатом и трифенилфосфином и последующей реакции in situ с карбоновой кислотой ( этерификация Мицунобу ).
Спиртовым компонентом могут служить различные группы. Однако здесь очень распространены метиловый, трет- бутиловый, бензиловый и аллиловый эфиры. Кроме того, существует также ряд защитных групп, которые являются производными простых эфирных защитных групп гидроксильных групп. Однако специфические условия расщепления часто очень похожи. В принципе, любой сложный эфир можно гидролизовать в присутствии гидроксид-ионов в водно-спиртовом растворе. Однако для более чувствительных субстратов часто используется гидроксид лития в тетрагидрофуране и в присутствии метанола. Те же правила, естественно, применимы к тенденции к гидролизу, как и к сложным эфирам как защитным группам спирта.
| Фамилия | формула | сокращение | расщепление | Специальное производство |
|---|---|---|---|---|
| метил | Мне | нуклеофильно-щелочные гидроксиды или карбонаты металлов в водном метаноле или тетрагидрофуране, галогениды щелочных металлов во влажных апротонных растворителях, таких как диметилсульфоксид, N , N- диметилформамид при нагревании, ферментативно z. Б. эстеразой печени свиньи | Диазометан в диэтиловом эфире, карбонат цезия и метилиодид в N , N- диметилформамиде, метаноле и каталитическом триметилсилилхлориде | |
| трет- бутил |  |
трет- Бу | сердитый; Трифторуксусная кислота (чистая или в дихлорметане), муравьиная кислота, п- толуолсульфоновая кислота | Изобутен в диоксане и каталитической серной кислоте |
| Бензил |  |
Млрд | гидрогенолитический; Водород / палладий на активированном угле | |
| Бензгидрил | 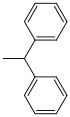 |
гидрогенолитический; Водород / палладий на активированном угле (очень легко расщепляется) | ||
| Аллил | Аллил | аналога эфирам; Трет- бутанолат калия , палладий на активированном угле, DABCO (1,4-диазабицикло [2.2.2] октан) в метаноле, различные комплексы платиновых элементов - затем кислотная обработка |
Алкенес
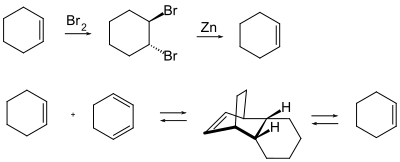
Алкены редко нуждаются в защите защитной группой. Как правило, на них влияет только электрофильная атака, изомеризация и, во время каталитического гидрирования, нежелательные побочные реакции. В основном для алкенов известны две защитные группы:
- Временное галогенирование бромом с образованием транс- 1,2-дибромалкильного соединения: алкен регенерируется путем восстановления конформации элементарным цинком или дихлоридом титаноцена .
- Защита с помощью реакции Дильса-Альдера : реакция алкена с диеном приводит к циклическому алкену, который подвергается риску электрофильной атаки аналогично исходному алкену. Диен, используемый в качестве защитной группы, термически отщепляется, поскольку реакция Дильса-Альдера является обратимой или равновесной реакцией.
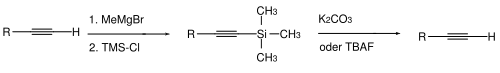
Алкины
Для алкинов также известны два типа защитных групп. В случае терминальных алкинов иногда необходимо замаскировать кислый атом водорода. Обычно это делается депротонированием (с использованием сильных оснований, таких как метилмагнийбромид или бутиллитий в тетрагидрофуране / диметилсульфоксиде ) и последующей реакции с хлортриметилсиланом с образованием алкина, защищенного концевым ТМС. Расщепление происходит гидролитически - карбонатом калия в метаноле - или ионами фтора, такими как, например, фторид тетрабутиламмония .
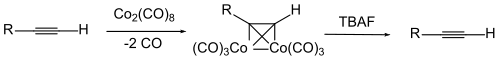
Для защиты самой тройной связи иногда используется комплекс алкинового соединения с октакарбонилом дикобальта . Кобальт отделяется от окисления.
Приложения
Защитные группы используются в широком спектре синтетической органической химии. Это относится как к лабораторному синтезу, так и к крупномасштабному синтезу сложных активных ингредиентов. Как только оказывается, что функциональная группа нарушает порядок или может подвергнуться нежелательной атаке, применяется метод защитной группы. Защитные группы используются почти в каждом синтезе сложной целевой молекулы. Поскольку введение, а также расщепление защитных групп влечет за собой как усилия, так и потерю выхода, желательно обходиться без защитных групп, чего, однако, часто бывает трудно достичь.
В автоматическом синтезе пептидов и нуклеотидов химия защитных групп является неотъемлемой частью концепции синтеза. Защитные группы также незаменимы в химии сахаров из-за очень схожих гидроксильных групп в молекулах сахара.
Важным примером промышленного применения технологии защитных групп является синтез аскорбиновой кислоты (витамина С) по Райхштейну .
Чтобы предотвратить окисление вторичных спиртов перманганатом калия , их защищают ацетализацией ацетоном и снова снимают защиту после окисления первичной гидроксильной группы до карбоновой кислоты.
Очень впечатляющим примером синтеза натуральных продуктов для применения защитных групп является полный синтез палитоксинкарбоновой кислоты рабочей группой Йошито Киши в 1994 году. 42 функциональные группы (39 гидроксильных групп, одна диол, одна аминогруппа и одна карбоновая кислота). группа) должны были быть защищены. Это было сделано с помощью восьми различных защитных групп (один метиловый эфир, пять ацетатных групп, 20 простых эфиров TBDMS, девять п- метоксибензиловых эфиров, четыре бензоата, один метил-гемиацеталь, один ацеталь с ацетоном и один сложный эфир SEM).
Введение или изменение защитной группы иногда также влияет на реакционную способность всей молекулы. В качестве примера, отрывок из синтеза аналога митомицина С помощью Danishefsky будет показан здесь.
Изменение защитной группы с метилового эфира на эфир MOM предотвращает раскрытие эпоксида с образованием альдегида .
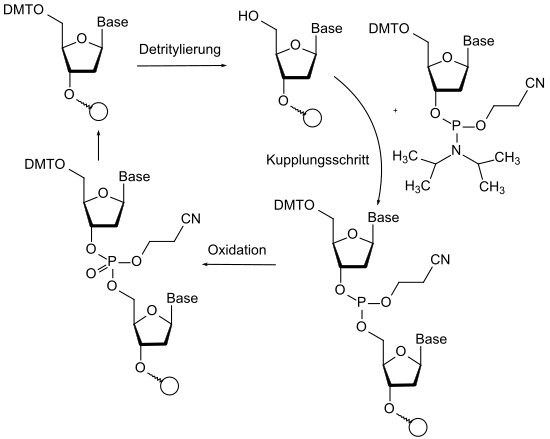
Важное применение химии защитных групп можно найти в автоматическом синтезе пептидов и нуклеозидов. При синтезе пептидов с помощью автоматических синтезаторов используются ортогональность группы Fmoc (основное расщепление), трет- бутильной группы (кислотное расщепление) и различные защитные группы для функциональных групп в боковой цепи аминокислот. При автоматическом синтезе нуклеотидов последовательностей ДНК и РНК после синтеза фосфорамидита на строительный блок используется до четырех различных защитных групп. Здесь даже происходит окислительно-восстановительная химия на защищенных атомах фосфора. Трехвалентный фосфор, используемый из-за его более высокой реакционной способности, снабжен цианоэтильной защитной группой на свободном кислороде. За стадией связывания следует окисление до фосфата с сохранением защитной группы. Свободные группы ОН, которые не прореагировали на стадии сочетания, ацетилируются на промежуточной стадии. Эта дополнительно введенная защитная группа затем предотвращает соединение этой группы ОН в следующих циклах.
Как правило, введение защитной группы не представляет проблемы. Сложности заключаются скорее в их устойчивости и избирательном расщеплении. Проблемы, возникающие при стратегиях синтеза с защитными группами, редко документируются в специальной литературе.
Атомная экономика
Синтезы с использованием защитных групп обычно имеют низкую атомную экономию . Иногда приходится прибегать к использованию защитных групп, чтобы исключить нежелательные конкурирующие реакции и достичь желаемой селективности синтеза. Защитные групповые стратегии часто незаменимы при синтезе сложных структур.
Синтезы хапалиндола U сравниваются в качестве примера стратегии защитных групп по сравнению с синтезом без защитных групп . В то время как в синтезе Хидеаки Муратаке с 1990 года в качестве защитной группы использовался тозил , в синтезе Филом С. Бараном с 2007 года защитная группа не использовалась. Количество стадий синтеза было значительно сокращено.
Hapalindol U Muratake 1990 Ts синтез защитной группы (защитные группы отмечены синим .)
литература
- Филип Дж. Коценски : Защитные группы , 1-е издание, Георг Тиме Верлаг, Штутгарт 1994, ISBN 3-13-135601-4 .
- Питер Г.М. Вутс, Теодора В. Грин: Защитные группы Грина в органическом синтезе , 4-е изд., John Wiley & Sons Inc., Хобокен, Нью-Джерси, ISBN 0-471-69754-0 .
- Майкл Шелхас, Герберт Вальдманн : «Защита групповых стратегий в органическом синтезе», в: Angewandte Chemie , 1996 , 103 , стр. 2192–2219; DOI: 10.1002 / anie.19961081805 .
- Кшиштоф Яровицки, Филип Коценски: «Защищая группы» , в: J. Chem. Soc., Perkin Trans. 1 , 1998 , pp. 4005-4037; DOI: 10.1039 / A803688H .
веб ссылки
- Марбургский университет : Защитные группы в синтетической органической химии (PDF; 284 kB)
- Organic-Reaction.com: группа защиты
- Organic-Chemistry.org: Защитные группы
Индивидуальные доказательства
- ↑ a b Кириакос К. Николау, Эрик Дж. Соренсен: Классика в полном синтезе: цели, стратегии, методы , 1996, ISBN 3-527-29284-5 .
- ↑ a b c Кириакос К. Николау, Скотт А. Снайдер: Классика в полном синтезе II , Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 2003, ISBN 3-527-30684-6 .
- ↑ Филип Дж. Коциенски: Защитные группы , 1-е издание, Георг Тим Верлаг, Штутгарт 1994, ISBN 3-13-135601-4 .
- ↑ Питер Г.М. Вутс, Теодора В. Грин: Защитные группы Грина в органическом синтезе , Четвертое изд. John Wiley & Sons Inc., Хобокен, Нью-Джерси, ISBN 0-471-69754-0 .
- ↑ PJ Kocienski: Protecting Groups , страницы 245-250.
- ^ Дитрих Шпицнер, Кай Остеррайх: «Анионно индуцированные домино-реакции - синтез терпена норпачуленольного типа», в: European Journal of Organic Chemistry , 2001 , 10 ; С. 1883–1886; DOI : 10.1002 / 1099-0690 (200105) 2001: 10 <1883 :: АИД-EJOC1883> 3.0.CO; 2-М .
- ↑ а б в Вен Чан, Питер Д. Уайт: твердофазный синтез пептидов Fmoc . Перепечатка 2004 г., Oxford University Press, ISBN 0-19-963724-5 .
- ↑ Вен Чан, Питер Д. Уайт: Fmoc Solid Phase Peptide Synthesis , стр. 10-12.
- ↑ Кириакос К. Николау, Эрик Дж. Соренсен: Классика полного синтеза: цели, стратегии, методы , VCH Verlagsgesellschaft mbH, Weinheim, 1996, стр. 711-729, ISBN 3-527-29284-5 .
- ↑ Майкл Шелхас, Герберт Вальдманн: «Стратегии защитных групп в органическом синтезе», в: Angewandte Chemie , 1996 , 103 , стр. 2195-2200; DOI: 10.1002 / anie.19961081805 .
- ^ В. Н. Раджасекхаран Пиллаи: «Фотоэлементные защитные группы в органическом синтезе», в: Синтез , 1980 , стр. 1-26.
- ↑ PJ Kocienski: Protecting Groups , S. 186th
- ↑ Наоми Сакаи, Ясуфуми Офуне: «Полный синтез галантина I. Катализируемая кислотой циклизация галантиновой кислоты», в: J. Am. Chem. Soc. , 1992 , 114 , стр. 998-1010; DOI: 10.1021 / ja00029a031 .
- ↑ Гленн Л. Шталь, Родерих Уолтер, Кларк В. Смит: «Общая методика синтеза моно-N-ацилированных 1,6-диаминогексанов», в: J. Org. Chem. , 1978 , 43 , стр. 2285– 2286; DOI: 10.1021 / jo00405a045 .
- ^ Р. Houghton, А. Бекман, JM Ostresh: Int. J. Pept. Protein Res. , 1986 , 27 , с. 653.
- ↑ PJ Kocienski: Protecting Groups , S. 195th
- ^ Роберт М. Уильямс, Питер Дж. Синклер, Дунгуань Чжай, Даймо Чен: «Практический асимметричный синтез α-аминокислот через конструкции углерод-углеродных связей на электрофильных глициновых матрицах», в: J. Am. Chem. Soc. , 1988 , 110 , pp. 1547-1557; DOI: 10.1021 / ja00213a031 .
- ↑ Вен Чан, Питер Д. Уайт: Fmoc Solid Phase Peptide Synthesis , стр. 27-30.
- ^ Грегг Б. Поля: методы удаления группы Fmoc. (PDF; 663 kB) В: Майкл У. Пеннингтон, Бен М. Данн (ред.): Peptide Synthesis Protocols, том 35, 1995, ISBN 978-0-89603-273-6 , стр. 17-27.
- ↑ Б. Либе, Х. Кунц: Твердофазный синтез гликопептида сиалил-Tn антигена, ассоциированного с опухолью, с частичной последовательностью из «тандемного повтора» муцина MUC-1 In: Angew. Chem., Том 109, 1997, стр. 629-631.
- ↑ ChemPep Inc.: Fmoc Solid Phase Peptide Synthesis. Проверено 16 ноября 2013 года.
- ↑ PJ Kocienski: Protecting Groups , страницы 199-201.
- ↑ Джон О. Осби, Майкл Г. Мартин, Брюс Ганем: Исключительно мягкое снятие защиты с фталимидов , в: Tetrahedron Lett. , 1984 , 25 , стр. 2093-2096; DOI: 10.1016 / S0040-4039 (01) 81169-2 .
- ↑ PJ Kocienski: Protecting Groups , страницы 220-227.
- ↑ П. Вурос: «Химическая дериватизация в газовой хроматографии-масс-спектрометрии», в: «Масс-спектрометрия», Деггер, Нью-Йорк, 1979, т. 2, стр. 129.
- ↑ PJ Kocienski: Protecting Groups , S. 29th
- ↑ PJ Kocienski: Protecting Groups , S. 31st
- ↑ Тод К. Джонс, Роберт А. Ример, Ричард Десмонд, Сандер Г. Миллс: «Химия трикарбонильных гемикеталей и применение технологии Эванса для полного синтеза иммунодепрессанта (-) - FK-506», в: J. Am. Chem. Soc. , 1990 , 112 , pp. 2998-3017; DOI: 10.1021 / ja00164a023 .
- ↑ Дитер Сибах, Хак-Фан Чоу, Ричард Ф.У. Джексон, Мариус А. Саттер, Сувит Тайсривонгс, Юрг Циммерманн: «(+) - 11,11'-Ди-О-метилелайофилиден - препарат из элаиофилина и полный синтез из (R) -3-гидроксибутират и (S) -малат », в: Liebigs Ann. Chem. , 1986 , стр. 1281-1308; DOI: 10.1002 / jlac.198619860714 .
- ↑ Дэвид А. Эванс, Стивен В. Калдор, Тодд К. Джонс, Джон Кларди, Томас Дж. Стаут: «Полный синтез макролидного антибиотика цитоварицина», в: J. Am. Chem. Soc. , 1990 , 112 , pp. 7001-7031; DOI: 10.1021 / ja00175a038 .
- ↑ Джеймс А. Маршалл, Ричард Седрани: «Конвергентный, высокостереоселективный синтез C-11-C-21 субъединицы макбецинов», в: J. Org. Chem. , 1991 , 56 , стр. 5496-5498; DOI: 10.1021 / jo00019a004 .
- ↑ a b Джеймс Д. Уайт, Мотодзи Кавасаки: «Полный синтез (+) - латрункулина A», в: J. Am. Chem. Soc. , 1990 , 112 , pp. 4991-4993; DOI: 10.1021 / ja00168a071 .
- ↑ Моррис Дж. Робинс, Висенте Самано, Марк Д. Джонсон: «Соединения, родственные нуклеиновой кислоте. 58. Окисление периодинаном, селективное первичное снятие защиты и чрезвычайно стереоселективное восстановление трет-бутилдиметилсилил-защищенных рибонуклеозидов. Синтез 9- (β-D-ксилофуранозил) аденина или 3'-дейтериоаденозина из аденозина », в: J. Org. Chem. , 1990 , 55 , стр. 410-412; DOI: 10.1021 / jo00289a004 .
- ^ Р. Роджер Ф. Ньютон, Дерек П. Рейнольдс, Колин Ф. Уэбб, Стэнли М. Робертс: «Короткий и эффективный полный синтез (±) метилового эфира простагландина D 2 с использованием нового метода расщепления диметил- трет-бутилсилиловый эфир », в: J. Chem. Soc., Perkin Trans. 1 , 1981 , стр. 2055-2058; DOI: 10,1039 / P19810002055 .
- ↑ Kyriacos C. Nicolaou, RA Daines, TK Chakraborty: «Полный синтез амфотеронолида B», в: J. Am. Chem. Soc. , 1987 , 109 , стр. 2208-2210; DOI: 10.1021 / ja00241a063 .
- ↑ Лео А. Пакетт, Аннет М. Доэрти, Кристофер М. Рейнер: «Полный синтез фураноцембранолидов. 1. Стереоконтролируемая подготовка ключевых гетероциклических строительных блоков и сборка полного секо-псевдоптеранового каркаса », в: J. Am. Chem. Soc. , 1991 , 109 , pp. 3910-3926; DOI: 10.1021 / ja00036a045 .
- ↑ PJ Kocienski: Protecting Groups , p. 40
- ↑ PJ Kocienski: Protecting Groups , страницы 38-39.
- ↑ а б П.Дж. Коценски: Защитные группы , стр. 43.
- ↑ JFW McOmie, DE West: 3,3'-Dihyroxybiphenyl In: Organic Syntheses . 49, 1969, стр 50,. DOI : 10,15227 / orgsyn.049.0050 ; Coll. Том 5, 1973, с. 412 ( PDF ).
- ↑ PJ Kocienski: Protecting Groups , страницы 46-49.
- ↑ Юдзи Оикава, Тадао Йошиока, Осаму Йонемицу: «Специальное удаление о-метоксибензильной защиты путем окисления DDQ», в: Tetrahedron Lett. , 1982 , 23 , стр. 885-888; DOI: 10.1016 / S0040-4039 (00) 86974-9 .
- ↑ Рольф Йоханссон, Бертил Самуэльссон: «Региоселективное восстановительное раскрытие цикла 4-метоксибензилиденацеталей гексопиранозидов. Доступ к новой стратегии группы защиты. Часть 1 », в: J. Chem. Soc., Perkin Trans. 1 , 1984 , стр. 2371-2374; DOI: 10,1039 / P19840002371 .
- ↑ Литература по п- метоксибензилу.
- ↑ Мишель Бессодес, Дмитрий Комиотис, Костас Антонакис: «Быстрое и селективное детритилирование первичных спиртов с использованием муравьиной кислоты», в: Tetrahedron Lett. , 1986 , 27 , стр. 579-580; DOI: 10.1016 / S0040-4039 (00) 84045-9 .
- ↑ Б. Гельферих: Углеводород. Chem. Biochem. , 1948 , 3 , с. 79.
- ↑ ML García, J. Pascual, L. Borràs, JA Andreu, E. Fos, D. Mauleón, G. Carganico, F. Arcamone: «Синтез новых глицерофосфолипидов простого эфира, структурно связанных с модулятором», in: Tetrahedron , 1991 , 47 , Стр. 10023-10034; DOI: 10.1016 / S0040-4020 (01) 96051-X .
- ↑ PJ Kocienski: Protecting Groups , страницы 59-60.
- ↑ PJ Kocienski: Protecting Groups , S. 62nd
- ↑ RE Ireland, DW Norbeck: «Конвергентный синтез полиэфирных ионофорных антибиотиков: синтез монензин-бис (тетрагидрофурана) посредством перегруппировки Клайзена енолата сложного эфира с β-уходящей группой», в: J. Am. Chem. Soc. , 1985 , 107 , pp. 3279-3285; DOI: 10.1021 / ja00297a038 .
- ↑ Литература см. Аллил.
- ^ Пол А. Вендер, Карлос Р. Д. Коррейя: «Внутримолекулярные фотоиндуцированные диен-диеновые циалоадобавки: селективный метод синтеза сложных восьмичленных колец и полихинанов», в: J. Am. Chem. Soc. , 1987 , 109 , стр. 2523-2525; DOI: 10.1021 / ja00242a053 .
- ↑ Элиас Дж. Кори, Марк Г. Бок: «Защита первичных гидроксильных групп с помощью метилтиометиловых эфиров», в: Tetrahedron Lett. , 1975 , 16 , pp. 3269-3270; DOI: 10.1016 / S0040-4039 (00) 91422-9 .
- ↑ Элиас Дж. Кори, Дай Х. Хуа, Бай Чуан Пан, Стивен П. Зейтц: «Полный синтез аплазмомицина», в: J. Am. Chem. Soc. , 1982 , 104 , pp. 6818-6820; DOI: 10.1021 / ja00388a074 .
- ↑ Серж Давид, Энни Тифри, Ален Вейриер: «Мягкая процедура региоспецифического бензилирования и аллилирования полигидроксисоединений через их производные станнилена в неполярных растворителях», в: J. Chem. Soc., Perkin Trans. 1 , 1981 , С. 1796–1801; DOI: 10,1039 / P19810001796 .
- ↑ Каору Фудзи, Сигетоши Накано, Эйити Фудзита: «Улучшенный метод метоксиметилирования спиртов в слабокислых условиях», в: Синтез , 1975 , стр. 276-277.
- ↑ PJ Kocienski: Protecting Groups , S. 77th
- ↑ Х. Нагаока, В. Рутч, Г. Шмидт, Х. Ито, М. Р. Джонсон, Ю. Киши: «Полный синтез рифамицинов. 1. Стереоуправляемый синтез алифатического строительного блока », в: J. Am. Chem. Soc. , 1980 , 102 , pp. 7962-7965; DOI: 10.1021 / ja00547a037 .
- ^ В. Кларк Стилл, Доминик Мобилио: «Синтез аспердиола», в: J. Org. Chem. , 1983 , 48 , стр. 4785-4786; DOI: 10.1021 / jo00172a070 .
- ↑ Масахиро Хирама, Мицуко Уэй: «Хиральный полный синтез компактина», в: J. Am. Chem. Soc. , 1982 , 104 , pp. 4251-4253; DOI: 10.1021 / ja00379a037 .
- ↑ W. Clark Still, Shizuaki Murata, Gilbert Revial, Kazuo Yoshihara: «Синтез цитотоксического гермакранолида эвканнабинолида», в: J. Am. Chem. Soc. , 1983 , 105 , pp. 625-627; DOI: 10.1021 / ja00341a055 .
- ↑ Роберт С. Гэдвуд, Рене М. Летт, Джейн Э. Виссинджер: «Полный синтез (±) -поитидиола и (±) 4-эпипоитдиола», в: J. Am. Chem. Soc. , 1984 , 106 , стр. 3869-3870; DOI: 10.1021 / ja00325a032 .
- ↑ Стивен Д. Берк, Грегори Дж. Пакофски: «Клайзеновая перегруппировка енолятного эфира. Полный синтез (±) -этизолида », в: Tetrahedron Lett. , 1986 , 27 , стр. 445-448; DOI: 10.1016 / S0040-4039 (00) 85501-X .
- ↑ Тошиюки Кан, Масару Хашимото, Мицутоши Янагия, Харухиса Сирахама: «Эффективное снятие защиты с 2- (триметилсилилэтокси) метилированных спиртов (эфиры SEM). Синтез тирсиферил-23 ацетата », в: Tetrahedron Lett. , 1988 , 29 , стр. 5417-5418; DOI: 10.1016 / S0040-4039 (00) 82883-X .
- ↑ Джозеф П. Марино, Скотт Л. Дакс: «Эффективный метод десилилирования для получения о-хинонметидов: применение для синтеза (+) - и (-) - гексагидроканнабинола», в: J. Org. Chem. , 1984 , 49 , стр. 3671-3672; DOI: 10.1021 / jo00193a051 .
- ↑ Карел Ф. Бернади, М. Браунер Флойд, Джон Ф. Полетто, Мартин Дж. Вайс: «Простагландины и родственные им. 20. Синтез простагландинов путем сопряженного добавления реагентов транс-1-алкенилтриалкилаланата лития. Новый реагент для конъюгированных 1,4-добавлений », в: J. Org. Chem. , 1979 , 44 , стр. 1438-1447; DOI: 10.1021 / jo01323a017 .
- ↑ Элиас Дж. Кори, Харуки Нива, Йохен Нолле: «Полный синтез (S) -12-гидрокси-5,8,14-цис, -10-транс-эйкозатетраеновой кислоты (HETE Самуэльсона)», в: J. Am. . Chem. Soc. , 1978 , 100 , стр. 1942-1943; DOI: 10.1021 / ja00474a058 .
- ^ A b П. Коллинз, Р. Феррье: Моносахариды - их химия и их роль в натуральных продуктах , Уайли, Западный Суссекс, 1995, ISBN 0-471-95343-1 .
- ↑ Christopher R. Schmid, Jerry D. Bryant: D- (R) -Glycerinaldehyde Acetonide In: Organic Syntheses . 72, 1995, стр 6,. DOI : 10,15227 / orgsyn.072.0006 ; Coll. Том 9, 1998, с. 450 ( PDF ).
- ↑ Андраш Липтак, Янош Имре, Янош Харанги, Пал Нанаси, Андраш Несмели: «Хемо-, стерео- и региоселективный гидрогенолиз углеводных бензилиденацеталей. Синтез бензиловых эфиров бензил-α-D-, метил-β-D-маннопиранозидов и бензил-α-D-рамнопиранозида расщеплением кольца производных бензилидена с помощью реагента LiAlH 4 -AlCl 3 », в: Tetrahedron , 1982 , 38 , p. 3721-3727; DOI: 10.1016 / 0040-4020 (82) 80083-5 .
- ↑ Джеймс А. Маршалл, Джозеф Д. Трометр, Брюс Э. Блаф, Томас Д. Крут: «Стереохимия добавок SN2 'к ациклическим винилоксиранам», в J. Org. Chem. , 1988 , 53 , стр. 4274-4282 doi : 10.1021 / jo00253a020
- ↑ Т. Цунода, М. Судзуки, Р. Нойори: «Простая процедура ацетализации в апротонных условиях», в: Tetrahedron Lett. , 1980 , 21 , стр. 1357-1358; DOI: 10.1016 / S0040-4039 (00) 74575-8 .
- ↑ Джуджи Йошимура, Сигэоми Хорито, Хирориобу Хашимото: «Простой синтез 2,3,4,6-Тетра-О-бензил-D-глюкопиранозилиден ацеталей с использованием катализатора триметилсилилтрифторметансульфоната», в: Chem. Lett. , 1981 , 10 , стр. 375-376; DOI: 10.1246 / cl.1981.375 .
- ↑ Брюс Х. Липшуц, Даниэль Полларт, Джозеф Монфорте, Хиёсизо Коцуки: «Катализируемые Pd (II) реакции гидролиза / обмена ацеталей / кеталей», в: Tetrahedron Lett. , 1985 , 26 , стр. 705-708; DOI: 10.1016 / S0040-4039 (00) 89114-5 .
- ↑ Кван Су Ким, Ян Хон Сон, Бонг Хо Ли, Чи Сун Хан: «Эффективное и селективное расщепление ацеталей и кеталей с использованием хлорида железа, адсорбированного на силикагеле», в: J. Org. Chem. , 1986 , 51 , с. 404-407; DOI: 10.1021 / jo00353a027 .
- ↑ PJ Kocienski: Protecting Groups , страницы 167-170.
- ↑ PJ Kocienski: Protecting Groups , страницы 164-167.
- ↑ PJ Kocienski: Protecting Groups , S. 176th
- ↑ PJ Kocienski: Protecting Groups , страницы 178-180.
- ↑ Сэмюэл Дж. Данишефски, Натан Б. Мантло, Деннис С. Ямашита, Гейл. Шульте: «Краткий путь к ряду калихемицин-эсперамицин: кристаллическая структура прототипа агликона», в: J. Am. Chem. Soc. , 1988 , 110 , pp. 6890-6891; DOI: 10.1021 / ja00228a051 .
- ↑ Джон Н. Хазелтин, Мария Паз Кабал, Натан Б. Мантло, Нобухару Ивасава, Деннис С. Ямасита, Роберт С. Коулман, Сэмюэл Дж. Данишефски, Гейл К. Шульте: «Полный синтез калихеамицинона: новые механизмы активации восстановительная циклоароматизация конгенеров агликонов », в: J. Am. Chem. Soc. , 1991 , 113 , стр. 3850-3866; DOI: 10.1021 / ja00010a030 .
- ↑ PJ Kocienski: Protecting Groups , S. 119th
- ↑ Сатоми Ниваяма: «Высокоэффективный селективный моногидролиз симметричных диэфиров», в: J. Org. Chem. , 2000 , 65 , стр. 5834-5836; DOI: 10,1021 / jo0001986 .
- ↑ Дж. М. Хурана, Арти Сегал: «Эффективная и удобная процедура гидролиза сложного эфира», в: Org. Prep. Процедуры. Ind. , 1994 , 26 , стр. 580-583.
- ^ Роберт В. Стивенс, Альберт WM Ли: «Стереохимия реакции Робинсона-Шёпфа. Стереоспецифический полный синтез защитных алкалоидов божьей коровки преокцинеллина и кокцинеллина ”, в: J. Am. Chem. Soc. , 1979 , 101 , pp. 7032-7035; DOI: 10.1021 / ja00517a042 .
- ↑ Дж. Вробель, К. Такахаши, В. Хонкан, Дж. Ланное, Дж. М. Кук, Стивен Х. Берц: «α-Литио кетоны. 1. Стереоуправляемый синтез (±) -модефена посредством реакции Вейсса », в: J. Org. Chem. , 1983 , 48 , pp. 139-141; DOI: 10.1021 / jo00149a034 .
- ↑ Деннис Д. Кейт, Джон А. Тортора, Роксана Янг: «Синтез L-2-амино-4-метокси-транс-бут-3-еновой кислоты», в: J. Org. Chem. , 1978 , 43 , Стр. 3711–3713; DOI: 10.1021 / jo00413a016 .
- ↑ Петер Мор, Нада Ваэспе-Шарчевич, Кристоф Тамм, Кристина Гавронска, Яцек К. Гавронски: «Исследование стереоселективного гидролиза симметричных диэфиров с помощью эстеразы печени свиньи», в: Helv. Chim. Acta , 1983 , 66 , pp. 2501-2511; DOI: 10.1002 / hlca.19830660815 .
- ↑ Теофил Тшамбер, Нада Ваэспе-Шарчевич, Кристоф Тамм: «Стереоконтролируемый синтез эпимера C (19) -to-C (27) сегмента рифамицина S», в: Helv. Chim. Acta , 1986 , 69 , стр. 621-625; DOI: 10.1002 / hlca.19860690311 .
- ↑ Ив Рубин, Кэролайн Б. Ноблер, Франсуа Дидерих: «Предшественники цикло [n] углеродов: 3,4-диалкинил-3-циклобутен-1,2-дионы и 3,4-диалкинил-3-циклобутен-1 , 2-диолы в циклобутенодегидроаннулены и высшие оксиды углерода », в: J. Am. Chem. Soc. , 1990 , 112 , pp. 1607-1617; DOI: 10.1021 / ja00160a047 .
- ↑ Сунгак Ким, Йонг Гил Ким, Деог-ил Ким: «Новый метод селективного диоксоланирования кетонов в присутствии альдегидов», в: Tetrahedron Lett. , 1992 , 33 , стр. 2565-2566; DOI: 10.1016 / S0040-4039 (00) 92243-3 .
- ↑ Г. Баудуин, Д. Бондон, Ю. Пьетрасанта, Б. Пуччи: «Реакции трансцетализации - II: Влияние стерических и электронных факторов на энергии децетализации», в: Tetrahedron , 1978 , 34 , стр. 3269-3274 ; DOI: 10.1016 / 0040-4020 (78) 80243-9 .
- ↑ Джон Э. Макмерри, Стивен Дж. Иссер: «Полный синтез лонгифолена», в: J. Am. Chem. Soc. , 1972 , 94 , стр. 7132-7137; DOI: 10.1021 / ja00775a044 .
- ↑ MP Bosch, M. Pilar Bosch, Francisco Camps, Jose Coll, Angel Guerrero, Toshio Tatsuoka, Jerrold Meinwald: «Стереоселективный полный синтез (±) -музигадиала», in: J. Org. Chem. , 1986 , 51 , С. 773-784; DOI: 10.1021 / jo00356a002 .
- ↑ Ульрих Шмидт, Томас Бейттлер, Альбрехт Либеркнехт, Гельмут Гриссер: «Аминокислоты и пептиды - XXXXII. Синтез хламидоцина + эпи-хламидоцина », в: Tetrahedron Lett. , 1983 , 24 , pp. 3573-3576; DOI: 10.1016 / S0040-4039 (00) 88171-X .
- ↑ Элиас Дж. Кори, Платон А. Магриотис: «Полный синтез и абсолютная конфигурация 7,20-диизоцианоадоциана», в: J. Am. Chem. Soc. , 1987 , 109 , стр. 287-289; DOI: 10.1021 / ja00235a052 .
- ↑ Элиас Дж. Кори, Кириакос К. Николау, Такеши Тору: «Полный синтез (±) -вермикулина», в: J. Am. Chem. Soc. , 1975 , 97 , pp. 2287-2288; DOI: 10.1021 / ja00841a058 .
- ↑ Тайнэдзиро Хияма, Акихиро Канакура, Хадзиме Ямамото, Хитоси Нодзаки: «Общий путь к α, β-ненасыщенным альдегидам гомотерпеноидной и терпеноидной структуры. Синтез JH-II и β-Sinensal », в: Tetrahedron Lett. , 1978 , 19 , стр. 3051-3054; DOI: 10.1016 / S0040-4039 (01) 94936-6 .
- ↑ F. Huet, A. Lechevallier, M. Pellet, JM Conia: «Влажный силикагель; Удобный реагент для деацетализации », в: Synthesis , 1978 , стр. 63-64.
- ↑ Ф. Зималкоковски: Каталитическое гидрирование , Фердинанд Энке Верлаг, Штутгарт, 1965, стр. 127-133.
- ↑ PJ Kocienski: Protecting Groups , S. 136th
- ↑ PJ Kocienski: Protecting Groups , страницы 139-142.
- ↑ Ахмед М. Тафеш, Йенс Вейгуни: «Обзор избирательного каталитического восстановления ароматических нитросоединений до ароматических аминов, изоцианатов, карбаматов и мочевины с использованием CO», в: Chem. Rev. , 1996 , 96 , p. 2035– 2052; DOI: 10.1021 / cr950083f .
- ↑ Эван Л. Оллред, Бойд Р. Бек, Кент Дж. Вурхиз: «Образование двойных углерод-углеродных связей в результате реакции вицинальных дигалогенидов с натрием в аммиаке», в: J. Org. Chem. , 1974 , 39 , с. 1426-1427; DOI: 10.1021 / jo00926a024 .
- ↑ Тимоти С. Бутчер, Фэн Чжоу, Майкл Р. Детти: «Дебромирование вик-дибромидов с помощью диорганотеллуридов. 1. Стереоселективность, относительные скорости и механические последствия », в: J. Org. Chem. , 1998 , 63 , стр. 169-176; DOI: 10,1021 / jo9713363 .
- ^ CJ Li, Дэвид Н. Харпп: «Бис (трифенилстанил) теллурид - мягкий и селективный реагент для теллурации и дебромирования», в: Tetrahedron Lett. , 1990 , 31 , pp. 6291-6293; DOI: 10.1016 / S0040-4039 (00) 97045-X .
- ↑ Коррадо Маланга, Серена Маннуччи, Лучано Лардиччи: «Активация углерод-галогеновой связи никелевым катализатором: синтез алкенов из 1,2-дигалогенидов», в: Tetrahedron , 1998 , 54 , стр. 1021-1028; DOI: 10.1016 / S0040-4020 (97) 10203-4 .
- ↑ Бён У Ю, Со Хи Ким, Чон Хо Ким: «Мягкое, эффективное и селективное расщепление вик-дибромидов до алкенов с помощью системы Cp 2 TiCl 2 / Ga», в: Bull. Korean Chem. Soc. , 2010 , 31 , pp. 2757-2758; DOI: 10.5012 / bkcs.2010.31.10.2757 .
- ^ Антониус JH Klunder, Джи Чж, Binne Званенбург: «Концепция переходной хиральности в стереоселективном синтезе функционализированных циклоалкенов Применения ретро-Дильс-Альдер Методология», в: Chem . Rev. , 1999 , 99 ., Стр 1163-1190 ; DOI: 10,1021 / cr9803840 .
- ↑ Хидеюки Танака, Такаши Камикубо, Наоюки Ёсида, Хидеки Сакагами, Такахико Танигучи, Кунио Огасавара: «Энантио- и диастереоконтролируемый синтез (-) - иридолактона и (+) - Pedicularis-lactone», in: Org. Lett. , 2001 , 3 , стр. 679-681; DOI: 10.1021 / ol0070029 .
- ↑ Мартин Бэнвелл, Дэвид Хоклесс, Бевин Джарротт, Брайан Келли, Эндрю Книлл, Роберт Лонгмор, Грегори Симпсон: «Химиоэнзиматические подходы к ядрам декагидро-индацена, связанным с инсектицидами класса спинозин», в: J. Chem. Soc. Perkin Trans. 1 , 2000 , pp. 3555-3558; DOI: 10.1039 / b006759h .
- ↑ Венцель Э. Дэвидсон, Малкольм К. Генри: «Металлоорганические ацетилены основных групп III-V», в: Chem. Rev. , 1967 , 67 , стр. 73-106; DOI: 10.1021 / cr60245a003 .
- ↑ Барри Дж. Теобальд: «Реакция Николаса: использование пропаргиловых катионов, стабилизированных гексакарбонилом дикобальта, в синтезе», в: Tetrahedron , 2002 , 58 , pp. 4133-4170; DOI: 10.1016 / S0040-4020 (02) 00315-0 .
- ↑ Кеннет М. Николас, Р. Петтит: «Группа защиты алкинов», в: Tetrahedron Lett. , 1971 , 37 , стр. 3475-3478; DOI: 10.1016 / S0040-4039 (01) 97209-0 .
- ↑ Ричард Коннор, Кеннет М. Николас: «Выделение, характеристика и стабильность ионов α - [(этинил) дикобальт гексакарбонил] карбония», в: J. Organomet. Chem. , 1977 , 125 , C45-C48; DOI: 10.1016 / S0022-328X (00) 89454-1 .
- ↑ Роза Ф. Локвуд, Кеннет М. Николас: «Ионы карбения, стабилизированные переходными металлами, как синтетические промежуточные соединения. I. Ионы α - [(алкинил) дикобальта, гексакарбонил] карбения как пропаргилирующие агенты », в: Tetrahedron Lett. , 1977 , pp. 4163-4166; DOI: 10.1016 / S0040-4039 (01) 83455-9 .
- ^ KM Николас, Р. Петтит: "О стабильности α- (алкинил) дикобальт гексакарбонилкарбониевых ионов", в: J. Organomet. Chem. , 1972 , 44 , C21-C24; DOI: 10.1016 / 0022-328X (72) 80037-8 .
- ↑ Т. Райхштейн, А. Грюсснер: «Продуктивный синтез L-аскорбиновой кислоты (витамин С)», в: Helv. Chim. Acta , 1934 , 17 , стр. 311-328; DOI: 10.1002 / hlca.19340170136 .
- ^ KC Николау, EJ Соренсен: Классика в Total Synthesis: задачи, стратегии, методы , VCH Verlagsgesellschaft мбХ, Weinheim 1996, С. 711-729,. ISBN 3-527-29284-5 .
- ↑ Питер Г.М. Вутс, Теодора В. Грин: Защитные группы Грина в органическом синтезе , 4-е изд., John Wiley & Sons Inc., Хобокен, Нью-Джерси, стр. 10-13; ISBN 0-471-69754-0 .
- ↑ Дж. М. МакКлюр, Сэмюэл Дж. Данишефски: «Новая реакция Хека арилирования: быстрый доступ к родственным соединениям FR 900482», в: J. Am. Chem. Soc. , 1993 , 115 , стр. 6094-6100; DOI: 10.1021 / ja00067a026 .
- ↑ Серж Л. Бокаж, Радхакришман П. Айер: «Достижения в синтезе олигонуклеотидов с помощью фосфорамидитного подхода», в: Tetrahedron , 1992 , 48 , стр. 2223-2311; DOI: 10.1016 / S0040-4020 (01) 88752-4 .
- ↑ Майкл Шелхас, Герберт Вальдманн: «Стратегии защитных групп в органическом синтезе», в: Angewandte Chemie , 1996 , 103 , стр. 2194; DOI: 10.1002 / anie.19961081805 .
- ↑ Марко Эйссен, Радослав Мазур, Хайнц-Георг Квеббеманн и Карл-Хайнц Пеннеманн: «Атомная экономика и выход последовательностей синтеза», в: Helv. Chim. Acta , 2004 , 87 , стр. 524-535; DOI: 10.1002 / hlca.200490050 .
- ^ Марко Эйссен, Юрген О. Мецгер: «Показатели экологической эффективности для повседневного использования в синтетической химии», в: Химия - Европейский журнал , 2002 , 8 , стр. 3580-3585; DOI: 10.1002 / chin.200247273 .
- ↑ Марко Эйссен, Юрген О. Мецгер, Эберхард Шмидт, Уве Шнайдевинд: 10 лет после «Рио» - концепции вклада химии в устойчивое развитие , в: Angewandte Chemie , 2002 , 114 , стр. 402–425; DOI : 10.1002 / 1521-3757 (20020201) 114: 3 <402 :: АИД-ANGE402> 3.0.CO; 2-Д .
- ↑ Зигфрид Хауптманн : Organische Chemie , 2-е издание, VEB Deutscher Verlag für Grundstoffindindustrie, Лейпциг 1985, ISBN 3-342-00280-8 , стр. 621–622.
- ↑ Хидеаки Муратаке, Харуми Кумагами, Мицутака Нацумэ: Синтетические исследования морских алкалоидов гапалиндолов. Часть 3 Полный синтез (±) -апалиндолов H и U , в: Tetrahedron , 1990 , 46 , pp. 6351-6360; DOI: 10.1016 / S0040-4020 (01) 96007-7 .
- ↑ Хидеаки Муратаке, Мицутака Нацумэ: Синтетические исследования морских алкалоидов гапалиндолов. Часть I Полный синтез (±) -апалиндолов J и M , в: Tetrahedron , 1990 , 46 , pp. 6331-6342; DOI: 10.1016 / S0040-4020 (01) 96005-3 .
- ↑ Хидеаки Муратаке, Мицутака Нацумэ: Синтетические исследования морских алкалоидов гапалиндолов. Часть 2. Восстановление алюмогидридным литием богатой электронами двойной связи углерод-углерод, сопряженной с ядром индола , в: Tetrahedron , 1990 , 46 , стр. 6343-6350; DOI: 10.1016 / S0040-4020 (01) 96006-5 .
- ↑ Фил С. Баран, Томас Дж. Маймон, Джереми М. Рихтер: Полный синтез морских природных продуктов без использования защитных групп , в: Nature , 446 , стр. 404-408; DOI: 10,1038 / природа05569 .