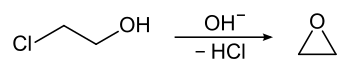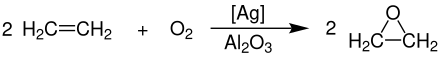Окись этилена
| Структурная формула | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
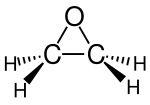
| ||||||||||||||||
| Клинья для уточнения геометрии | ||||||||||||||||
| Общий | ||||||||||||||||
| Фамилия | Окись этилена | |||||||||||||||
| другие имена |
|
|||||||||||||||
| Молекулярная формула | С 2 Н 4 О | |||||||||||||||
| Краткое описание |
бесцветный газ со сладким эфирным запахом |
|||||||||||||||
| Внешние идентификаторы / базы данных | ||||||||||||||||
| ||||||||||||||||
| характеристики | ||||||||||||||||
| Молярная масса | 44,05 г моль -1 | |||||||||||||||
| Физическое состояние |
газообразный |
|||||||||||||||
| плотность |
1,965 кг м −3 (0 ° C, 1013 гПа) |
|||||||||||||||
| Температура плавления |
-112,55 ° С |
|||||||||||||||
| точка кипения |
10,5 ° С |
|||||||||||||||
| Давление газа |
|
|||||||||||||||
| растворимость |
легко растворим в воде |
|||||||||||||||
| Показатель преломления |
1,3597 (7 ° С) |
|||||||||||||||
| правила техники безопасности | ||||||||||||||||
| ||||||||||||||||
| MAK |
|
|||||||||||||||
| Токсикологические данные | ||||||||||||||||
| Термодинамические свойства | ||||||||||||||||
| ΔH f 0 |
−78,0 кДж / моль (л) |
|||||||||||||||
| Насколько это возможно и общепринято, используются единицы СИ . Если не указано иное, приведенные данные относятся к стандартным условиям . Показатель преломления: линия Na-D , 20 ° C | ||||||||||||||||
Оксид этилена (сокращенно ЭО ) - это бесцветный, чрезвычайно легковоспламеняющийся газ со сладким запахом и простейшей эпоксидной смолой . Это важный промежуточный продукт при производстве этиленгликоля и других химикатов. Окись этилена используется в качестве дезинфицирующего средства для пищевых продуктов, органических изоляционных материалов (шерсть, растительные волокна), текстильных волокон и медицинских устройств.
В качестве мутагенного clastogen окись этилена является токсичным , что хромосомные аберрации могут вызвать. Номер ООН 1040 назначается ему.
Согласно номенклатуре IUPAC оксид этилена называют оксираном , название которого происходит от системы Ганча-Видмана .
история
Окись этилена впервые была выпущена в 1859 годом Вюрца , для которых он рассматривал 2-хлорэтанол с основанием .
Во время Первой мировой войны окись этилена приобрела промышленное значение как исходный продукт для охлаждающего этиленгликоля. Поскольку горчичный газ для химического оружия ( иприт ) может производиться с использованием окиси этилена , он подпадает под действие Закона о внешней торговле .
В 1931 году французский химик Теодор Лефорт открыл производство окиси этилена непосредственно из этилена и кислорода с использованием серебра в качестве катализатора .
Извлечение и представление
Историческая процедура
Окись этилена была впервые произведена в 1925 году компанией Union Carbide Chemicals с использованием хлоргидринового процесса. Для этой цели этилен сначала подвергали реакции с хлором в щелочном водном растворе с образованием этиленхлоргидрина , который затем реагировал с гидроксидом кальция с образованием оксида этилена. Недостатками процесса были значительное загрязнение сточных вод хлоридами и образование галогенированных углеводородов (например, 1,2-дихлорэтана ) в качестве побочных продуктов. Первое каталитическое прямое окисление этилена до окиси этилена также было технически внедрено компанией Union Carbide в 1930-х годах.
Промышленный синтез
Крупномасштабное производство окиси этилена в настоящее время происходит исключительно через каталитические окисления из этено с кислородом при температурах 230-270 ° С и давлением 10-20 бара. Мелко измельченный порошок серебра , который применяется к неорганическим , содержащего оксид носителя (предпочтительно оксид алюминия ) используют в качестве катализатора .
Полная реакция проводится в кожухотрубного реактора , в котором значительная теплота реакции (H R = -119,7 кДж моль -1 основной реакции и & delta ; H R = -1324 кДж моль -1 побочной реакции) будет рассеиваться с помощью расплавов солей и для генерации перегретого пара высокого давления. В этом процессе катализатор представляет собой неподвижный слой . Выход чистого оксида этилена составляет 85%. Полное окисление этена до диоксида углерода и воды происходит как побочная реакция .
В 2010 году во всем мире было потреблено около 21 миллиона тонн окиси этилена.
характеристики
Оксид этилена - чрезвычайно легковоспламеняющийся газ. Температура вспышки составляет -57 ° C, а температура воспламенения составляет 435 ° C. Образует взрывоопасные смеси с воздухом, нижний предел взрываемости (LEL) 2,6%, верхний (UEL) 100%.
использовать
Как сырье
Большая часть производимого этиленоксида используется в качестве промежуточного продукта при производстве других химикатов. Большая часть окиси этилена используется в производстве этиленгликоля , в настоящее время с помощью процесса OMEGA . Он также необходим для производства полиэфиров (например, ПЭТ ) или гидроксиэтилцеллюлозы (ГЭЦ). Этиленоксид может полимеризоваться с образованием полиэтиленгликоля (также известного как полиэтиленоксид), который является нетоксичным и легко растворимым в воде полимером. Это также важно для производства поверхностно-активных веществ (см. Неионные поверхностно-активные вещества ), например Б. эфиры полиалкиленгликоля . Одна категория производных этиленоксида, которая привлекла большое научное внимание, - это краун-эфиры , которые представляют собой циклические олигомеры этиленоксида. Эти соединения обладают способностью делать ионные вещества растворимыми в неполярных растворителях, в которых они иначе не растворимы. Из-за высокой стоимости использование этих веществ по-прежнему ограничено лабораторными применениями.
стерилизация
Стерилизация оксидом этилена в настоящее время является широко распространенным процессом в промышленном производстве медицинских изделий, особенно одноразовых изделий, таких как повязки, швы или шприцы и катетеры, а также хирургических инструментов и чувствительных медицинских изделий (например, кохлеарных имплантатов ). Процесс строго стандартизирован (включая ISO 11135, ISO 10993-7 , EN 1422). Обработка ватных тампонов газом этиленоксидом может привести к разрушению следов ДНК таким образом, что их невозможно будет обнаружить с помощью методов судебной экспертизы . Только около 2% мирового производства используется для стерилизации газообразным ЭО.
Как топливо
В военном секторе окись этилена используется в качестве топлива в небольших аэрозольных бомбах, например. Б. в кассетных бомбах используются типа КБУ-55 .
В качестве пестицида, биоцида и при хранении
Этиленоксидный газ убивает бактерии, вирусы и грибки, поэтому его можно использовать для фумигации термочувствительных веществ. Стерилизация специй ЭО была запатентована в 1938 году американским химиком Ллойдом Холлом и до сих пор практикуется в некоторых странах. В Германии использование окиси этилена в качестве средства защиты растений запрещено Постановлением о применении защиты растений с 1981 года, поскольку при этом может образовываться токсичный 2-хлорэтанол . В ЕС также запрещено использование окиси этилена в качестве средства защиты растений с 1991 года. Окись этилена использовалась вместе с более высокой долей двуокиси углерода (для уменьшения воспламеняемости) под торговыми названиями Cartox и T-Gas в качестве фумиганта от z. B. Используются силосы, складские помещения и контейнеры. В ЕС оксид этилена был запрещен как биоцид для защиты пищевых продуктов и кормов в 2011 году.
Максимальное значение остатков этиленоксида в пищевых продуктах составляет от 0,02 до 0,1 мг / кг, в зависимости от продукта. В 2020 и 2021 годах в ЕС и Швейцарии было множество отзывов различных продуктов, таких как импортные семена и продукты кунжута , загуститель гуаровая камедь , диетические добавки или порошок имбиря, для которых максимально допустимое значение было многократно превышено.
Использование окиси этилена в косметике регулируется в ЕС с 1976 года.
правила техники безопасности
Оксид этилена токсичен и канцерогенен при вдыхании. Симптомы отравления включают головную боль, головокружение и тошноту / рвоту. С увеличением дозы доходит до подергивания, судорог и, наконец, до комы. Раздражает кожу и дыхательные пути. Легкие могут наполняться жидкостью через несколько часов после вдоха ( отек легких ).
Окись этилена обычно хранится под давлением в сочетании с 10% двуокиси углерода . При нормальном давлении и комнатной температуре он очень быстро испаряется и вызывает обморожение кожи.
У животных это вызвало многочисленные репродуктивные дефекты, такие как мутации или выкидыши. Влияние на репродуктивную способность человека еще не изучено подробно, но вполне вероятно, что будут иметь место те же эффекты, что и в экспериментах на животных.
В 2012 году оксид этилена был включен в план текущих действий ЕС ( CoRAP ) в соответствии с Регламентом (ЕС) № 1907/2006 (REACH) как часть оценки вещества . Воздействие вещества на здоровье человека и окружающую среду повторно оценивается и, при необходимости, принимаются последующие меры. Причиной поглощения этиленоксида были опасения по поводу его классификации как CMR- вещества высокой (совокупной) тоннажности. Переоценка проводилась с 2012 года в Австрии . Затем был опубликован окончательный отчет.
Смотри тоже
- Этиленимин (азиридин), азотсодержащий аналог
- Тииран (сульфид этилена), серосодержащий аналог
литература
- Вольфганг Своденк, Гельмут Вальдманн: Современные процессы в крупномасштабной химии: оксид этилена и оксид пропилена. В кн . : Химия в наше время . Vol. 12, No. 3, 1978, pp. 65-70. DOI : 10.1002 / ciuz.19780120302 .
аннотация
- ↑ 18 февраля 2020 г. эта согласованная классификация и маркировка были опубликованы в Официальном журнале ЕС с Регламентом (ЕС) 2020/217 (14-й СПС). Гармонизированная классификация имеет обязательную юридическую силу в соответствии с Регламентом (ЕС) № 1272/2008 (CLP) и должна быть полностью внедрена производителями и дистрибьюторами в ЕЭЗ и Швейцарии не позднее 1 октября 2021 года.
Индивидуальные доказательства
- ↑ б с д е е г ч я J к л м п о р д вход на этиленоксида в базе данных GESTIS вещества в IFA , доступ к 8 января 2021 года. (Требуется JavaScript)
- ↑ Дэвид Р. Лид (Ред.): Справочник по химии и физике CRC . 90-е издание. (Интернет-версия: 2010 г.), CRC Press / Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, pp. 3-408.
- ↑ запись на оксид этилена в классификации и маркировки Перечня в Европейское химическое агентство (ECHA), доступ к 7 января 2021 года производители или дистрибьюторы могут расширить гармонизированной системы классификации и маркировки .
- ↑ Швейцарский фонд страхования от несчастных случаев (Сува): предельные значения - текущие значения MAK и BAT (поиск 75-21-8 или оксид этилена ), по состоянию на 13 сентября 2019 г.
- ↑ Справочник CRC, 90-е издание (2009–2010), стр. 5–22 ( памятная записка от 26 апреля 2015 г. в Интернет-архиве ). - см. также статью об оксиде этилена . В: P. J. Linstrom, W. G. Mallard (Eds.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69 . Национальный институт стандартов и технологий , Gaithersburg MD, доступ к 22 марта 2010 .
- ↑ Закон о внешней торговле ( памятная записка от 6 июня 2014 г. в Интернет-архиве ) (PDF; 1,3 МБ) в версии сообщения от 27 мая 2009 г. ( Вестник федеральных законов I, стр. 1150 ), в который внесены изменения статьей 1 Постановление от 12 декабря 2012 г. (BAnz. 2012) было изменено. С. 200.
- ↑ a b c Манфред Бернс, Арно Бер, Аксель Брем, Юрген Гмелинг, Кай-Олаф Хинрихсен, Ханс Хофманн, Регина Палковиц, Ульферт Онкен, Альберт Ренкен: Technische Chemie . 2-е издание. Wiley-VCH Verlag GmbH & Co. KGaA, Вайнхайм, Германия 2013, ISBN 978-3-527-33072-0 , стр. 16 ф., 592 .
- ↑ Йенс Люббаде: Судебно-медицинский анализ ДНК - ватный тампон слабого места , сообщение от 26 марта 2009 г. в Spiegel Online Wissenschaft.
- ↑ BAK to BSU / BSG - Equipment Listing Designation-Systems.net, по состоянию на 30 мая 2013 г.
- ↑ Постановление о запретах и ограничениях на использование продуктов для обработки растений (Постановление о применении средств защиты растений) в BGBl. 1980 г. I стр. 2335
- ↑ a b Напоминания: кунжут и оксид этилена. Потребительский консультационный центр Северный Рейн-Вестфалия , 10 мая 2021, доступ к 1 июня 2021 года .
- ↑ База данных пестицидов ЕС (v.2.1) Действующее вещество - оксид этилена. В: ec.europa.eu. 1 июля 2013, доступ к 16 декабря 2020 .
- ↑ Регламент (ЕС) 2015/868 от 26 мая 2015 г., вносящий поправки в Приложения II, III и V Регламента (ЕС) № 396/2005 Европейского парламента и Совета в отношении максимальных уровней остатков 2,4, 5-T, Барбан, бинапакрил, бромфосэтил, камфехлор (токсафен), хлорбуфам, хлороксурон, хлозолинат, ДНОК, диаллат, диносеб, динотерб, диоксатион, оксид этилена, ацетат фентина, гидроксид фентина, флукотомиклон, флукотоминакрион, флукотоминакрилон. Propham, Pyrazophos, Quinalphos, Resmethrin, Tecnazen и Vinclozolin в некоторых продуктах или на них
- ↑ Оксид этилена в семенах кунжута из Индии: изъятия и отзыв продуктов. В: swissdocu.ch. 6 декабря 2020, доступ к 1 июня 2021 .
- ^ Ядовитый импортный кунжут: Проблемы в швейцарской системе контроля. Kassensturz (телевизионное вещание) , 1 июня 2021, доступ к 1 июня 2021 года .
- ↑ Уведомление 2021.2013 Окись этилена в гуаровой камеди из Индии /// Окись этилена в гуаровой смоле из Индии. В: ОКНО РАСФФ. Проверено 21 августа 2021 года .
- ↑ Уведомление 2021. 4399 Окись этилена (сумма окиси этилена и 2-хлорэтанола, выраженная как окись этилена) в пищевых добавках из США. В: ОКНО РАСФФ. Проверено 21 августа 2021 года .
- ↑ Уведомление 2021. 4293 Оксид этилена в порошке органического имбиря. В: ОКНО РАСФФ. Проверено 21 августа 2021 года .
- ↑ Директива Совета 76/768 / EEC от 27 июля 1976 г. о сближении законов государств-членов в отношении косметических продуктов , замененная Регламентом (ЕС) № 1223/2009 Европейского парламента и Совета от 30 ноября , 2009 г. по косметической продукции
- ^ Европейское химическое агентство (ECHA): Отчет об оценке вещества и Заключительный документ .
- ↑ Переключающийся план действий Сообщества ( CoRAP ) Европейского химического агентства (ECHA): оксид этилена , по состоянию на 26 марта 2019 г.