Этен
| Структурная формула | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Общий | ||||||||||||||||
| Фамилия | Этен ( ИЮПАК ) | |||||||||||||||
| другие имена |
|
|||||||||||||||
| Молекулярная формула | С 2 Н 4 | |||||||||||||||
| Краткое описание |
чрезвычайно легковоспламеняющийся бесцветный газ со слегка сладковатым запахом |
|||||||||||||||
| Внешние идентификаторы / базы данных | ||||||||||||||||
| ||||||||||||||||
| характеристики | ||||||||||||||||
| Молярная масса | 28,05 г моль -1 | |||||||||||||||
| Физическое состояние |
газообразный |
|||||||||||||||
| плотность |
1,178 кг м −3 (15 ° C) |
|||||||||||||||
| Температура плавления |
-169,18 ° С |
|||||||||||||||
| точка кипения |
-103,8 ° С |
|||||||||||||||
| Давление газа |
4,1 МПа (20 ° C) |
|||||||||||||||
| растворимость |
очень плохо в воде (130 мг л -1 ) |
|||||||||||||||
| Дипольный момент |
0 |
|||||||||||||||
| правила техники безопасности | ||||||||||||||||
| ||||||||||||||||
| MAK |
Швейцария: 10 000 мл м -3 или 11 500 мг м -3 |
|||||||||||||||
| Термодинамические свойства | ||||||||||||||||
| ΔH f 0 |
52,4 кДж / моль |
|||||||||||||||
| Насколько это возможно и общепринято, используются единицы СИ . Если не указано иное, приведенные данные относятся к стандартным условиям . | ||||||||||||||||
Этен (также этен , этилен или этилен ) представляет собой газообразное, бесцветное, легковоспламеняющееся органическое соединение со сладким запахом с эмпирической формулой C 2 H 4 . Это простейший алкен , ненасыщенный углеводород, имеющий двойную связь углерод- Коленстофф .
Этен производят в промышленных масштабах путем парового крекинга различных углеводородов . В Европе и Азии этен в основном производится из нафты или газойля , в США , Канаде и на Ближнем Востоке он также производится из этана , пропана и сжиженного газа .
Этен является наиболее широко производимым основным органическим химическим веществом и используется для производства первичных вторичных продуктов, таких как полиэтилен , оксид этилена , стирол и α-олефины .
Такие растения, как спелые яблоки и бананы, а также красная японская сосна выделяют этен, который играет важную роль в качестве газа для созревания и фитогормона .
история
В Древнем Египте этен неосознанно использовали для созревания тутового инжира . Для этого незрелые плоды чесали. Затем они производили этен и ускоряли процесс созревания. Впервые Этен был упомянут как газ в 1669 году в работе немецкого алхимика Иоганна Иоахима Бехера « Actorum Laboratorii Chymici Monacensis, seu Physicae subterraneae» . В химическом стакане газ получали нагреванием этанола с серной кислотой .
Говорят, что голландский врач Ян Ингенхауз узнал о синтезе этена, проведенном в Амстердаме Хенрикусом Энеэ (Enée) и его коллегой Джоном Катбертсоном еще в 1777 году . В 1795 году четыре голландских химика Йохан Рудольф Дейман , Адриан Паэтс ван Троствейк , Антони Лауверенбург и Николаас Бондт открыли синтез 1,2-дихлорэтана из этена и хлора . Поскольку продукт назывался нефтью голландских химиков , этен назывался по-французски gaz oléfiant («нефтематеринский газ»), по-английски олефиантный газ . В 1807 году Джон Далтон попытался создать структурную формулу. Во второй половине XIX века удалось получить синтетические растительные кислоты, такие как янтарная кислота, из этена.
Технически этен был сначала дегидратации в этаноле или путем выделения из коксового газа извлекают. Первое крупномасштабное производство этена из этанола произошло в 1913 году на электрохимическом заводе в Биттерфельде. Полученный таким образом этен использовали для охлаждения. Только в 1981 году Salgema Industrias Quimicas возобновила этот процесс в Бразилии. Salgema производит около 100 000 тонн в год на основе патента Petrobras . Исходным материалом для «зеленого этилена» является этанол сахарного тростника . В 2010 году Braskem построил завод по обезвоживанию этанола в Триунфо в Риу-Гранди-ду-Сул мощностью 200 000 тонн в год.
Сегодня технически соответствующий процесс является парового крекинга из нафты или более углеводородных смесей , таких как hydrowax . Германия является крупнейшим производителем этилена в Европе с объемом производства 2,9 миллиона тонн (1989 г.), за ней следуют Франция с 2,5 и Англия с 1,9 миллиона тонн.
Этен может быть получен в подходящих условиях процесса с катализаторами из оксида алюминия и диоксида титана с дегидратацией из метанола или диметилового эфира его вторичного продукта . В лаборатории это дегалогенирования из 1,2-дихлорэтана с цинком , полученного.
Извлечение и представление
Этен частично получается как побочный продукт , но большая часть необходимого этена получается термическим или каталитическим крекингом углеводородов. В качестве сырья в основном используются природный газ , нафта или фракции высококипящего дистиллята. Помимо крекинга, техническим путем является дегидратация этана , который в больших количествах содержится в сланцевых газах. Обезвоживание этанола играет важную роль в странах с большим производством биоэтанола .
В 2010 году во всем мире производилось около 123 миллионов тонн этилена в год . Производство в Германии составило 5,1 млн тонн в год.
Распределение этена
В Германии и некоторых частях Нидерландов существует система трубопроводов этена для транспортировки между химическими объектами из Роттердама через Антверпен в район Кельна и район Эмшер-Липпе, а также район Рейн-Майн и Людвигсхафен-на-Рейне.
В Баварии есть трубопровод между химическим треугольником на юго-востоке и химическим заводом недалеко от Ингольштадта ( этиленовый трубопровод Münchsmünster-Gendorf ). С вводом в эксплуатацию 370-километрового этиленового трубопровода к югу от Мюнксмюнстера до Людвигсхафена-на-Рейне в июле 2013 года сеть северо-западной Германии была соединена с баварскими химическими предприятиями.
характеристики
Молекулярные свойства
Между двумя углеродными - атомов представляет собой двойную связь . Вращение вокруг этой связи требует значительно больше энергии, чем вращение вокруг одинарной связи между двумя атомами углерода. Из - за зр 2 - гибридизации атомов углерода представляет собой молекулу плоской , то есть, все атомы лежат в одной плоскости. Валентные углы H - C - H составляют 117 ° каждый и, таким образом, лишь незначительно отклоняются от теоретически идеального значения 120 ° для плоской тригональной формы. Двойная связь C = C с длиной связи 133 пм значительно короче, чем одинарная связь C-C в этане (154 пм). Тем не менее, эти две связи между атомами углерода в этена не одинаково сильны: энергия связи в сг связи составляет около 450 кДж / моль, что и п - связь около 270 кДж / моль (смотри также σ-модель П ). Соответственно, π-связь может быть легче расщеплена, например, в химической реакции. В общем, из-за высокой электронной плотности между двумя атомами углерода этен гораздо более реакционноспособен, чем, например, просто связанный этан.
Физические свойства
Из-за реакционноспособной двойной связи C = C присоединение к этой связи является типичной реакцией этена. Только 130 мг / л этена растворимо в воде, но этен легко растворяется в органических (неполярных) растворителях. Этен имеет слегка сладковатый неприятный запах. Порог запаха - 260 мл / м 3 . Теплотворная этена составляет 47,2 МДж / кг.
Другие особенности:
- Теплота плавления : 3,35 кДж / моль.
- Теплота испарения : 13,9 кДж / моль.
- C p : 42,9 Дж / (моль K)
- Δ f H 0 г : 52,47 кДж / моль
- S 0 : 219,32 Дж / (моль К)
Этен кристаллизуется при -175 ° C в ромбической элементарной ячейке с двумя молекулами на ячейку и параметрами решетки a = 6,46, b = 4,87, c = 4,14. Плотность 0,717 г / см 3 .
Температура вспышки −136 ° C, точка воспламенения 425 ° C.
Химические свойства
Реакции с образованием углерод-углеродной связи
Молекулы этена радикально полимеризуются под высоким давлением или с помощью катализаторов Циглера с образованием полиэтилена .
Этен реагирует с другими олефинами, такими как пропилен, с образованием сополимеров этилена-пропилена с добавлением диенов с образованием этилен-пропилен-диенового каучука .
Этен реагирует с тетрафторэтиленом с образованием этилен-тетрафторэтилена , а с другими ненасыщенными соединениями - с образованием сополимеров.
При никелевом катализе этен может быть олигомеризован до α-олефинов. Внутренние олефины могут быть превращены в -олефины с помощью этена с метатезисом . Обе реакции используются в промышленном масштабе в процессе SHOP .
Гидроформилирования этена с монооксидом углерода и водородом является техническим способом подготовки пропанали .
Гидроцианирование этена цианистым водородом до пропионитрила катализируется никелевыми катализаторами . Гидрирование или гидролиз дает пропиламин или пропионовую кислоту .
Этен реагирует в еновой реакции , перициклической реакции с соединением, которое содержит водород в аллильном положении, образуя связь между атомом углерода двойной связи и энофилом, передавая аллильный водород энофилу.
Реакции с образованием кислородно-углеродной связи
При поступлении достаточного количества кислорода этен горит с образованием воды и углекислого газа.
С воздухом или кислородом и серебром в качестве катализатора эпоксидирование до этиленоксида происходит при температуре от 220 до 280 ° C и при повышенном давлении . Дальнейшая реакция с водой дает этиленгликоль .
При взаимодействии с серной кислотой образуется полуэфир серной кислоты, который можно превратить в этанол путем гидролиза . Этот путь синтеза технического спирта был заменен реакцией с водой, катализируемой фосфорной кислотой .
В процессе Wacker-Hoechst этен окисляется до ацетальдегида с использованием палладиевого катализа . Реакция представлена следующими уравнениями:
Металлоорганические соединения
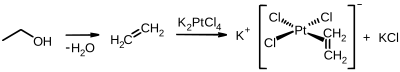
Первое металлоорганическое соединение с этеновым лигандом, соль Цейзе с эмпирической формулой K [PtCl 3 (C 2 H 4 )] H 2 O, было синтезировано в 1830 году датским химиком Уильямом Кристофером Цейзе . Этен образует π-комплексы с переходными металлами.
Другие реакции
Под воздействием тепла и в отсутствие воздуха этен распадается на метан и углерод.
Этен реагирует с хлором с образованием 1,2-дихлорэтана ( реакция присоединения ).
Этен реагирует с водородом под высоким давлением и в присутствии металлических катализаторов, таких как платина и никель, с образованием этана ( гидрирование ).
использовать

Наиболее важными побочными продуктами этена являются полиэтилен (56%), т.е. ЧАС. пластиковые типы HDPE, LDPE и LLDPE, этилендихлорид для производства ПВХ (14%), оксид этилена (11%) для производства предшественника полиэфира этиленгликоля или, например, неионогенных поверхностно- активных веществ (детергентов) и этилбензола (7 %) для производства полистирола . Это означает, что более 75% этилена используется для производства пластмасс.
Этен также является исходным материалом для производства многочисленных органических соединений, таких как антрацен , 2-хлорэтанол , хлорэтан , пропаналь , изопрен , винилацетат , пропановая кислота , бутен , стирол , этандиол и другие вещества. В процессе Wacker-Hoechst этен превращается в ацетальдегид (этаналь) в промышленных масштабах с использованием молекулярного кислорода (около 1,3% от расхода этена).
Этен использовался как анестетик в дополнение к закиси азота , особенно при слабой анестезии. Обладает наркотическим и расслабляющим действием на мышцы. Впервые он был использован публично в Чикаго в 1923 году; наркотический эффект этена несколько сильнее, чем у закиси азота, и имеет аналогичный механизм действия. Однако сегодня он больше не используется, потому что он легко воспламеняется и имеет неприятный запах. Кроме того, анестезирующий эффект этена не очень хорош по сравнению с другими распространенными наркотиками; Для достижения хорошего эффекта смесь анестетиков должна содержать не менее 80% этена.
Он также используется для созревания незрелых фруктов, таких как яблоки , бананы и помидоры, а также для стимулирования образования цветов путем фумигации в закрытых теплицах или на открытом воздухе с помощью активных ингредиентов, которые выделяют этилен в растительной клетке, например. Б. Этефон или Этацеласил. Этен также является топливным газом и используется для высокоскоростного напыления пламенем . Этен используется в химической промышленности как сырье для синтеза более 30% нефтехимических продуктов , он вытеснил этин после Второй мировой войны в основном из-за более высокой стоимости производства ацетилена, в то время как этен массово получается в промышленных процессах, поскольку нефть в больших количествах доступно.
Он также используется в производстве пестицидов и химического оружия, такого как горчичный газ (2,2-дихлордиэтилсульфид).
Во время Второй мировой войны , этан газ экспериментально используется Тайфун специальный отряд для атаки крепостей .
Биологический эффект
Этен - фитогормон (растительный гормон). Он синтезируется растениями из аминокислоты метионина , частично стимулируемой ауксином фитогормона . Как гормон он влияет на рост и старение зародышей растений . Это вызывает созревание плодов , развитие цветов , опадание листьев осенью и гибель частей растения. Как газообразное вещество, этен в основном находится в промежутках между клетками, межклеточных областях .
Еще в 1901 году Дмитрий Нелюбов показал, что этен вызывает у растений так называемый «тройной ответ». Это происходит с прорастающими корнями, обработанными этиленом. Эффект был заметен на заводах на неисправных городских газопроводах, которые показали необычный рост. Речь идет о торможении продольного роста в сочетании с утолщением стержня и дезактивацией гравитропизма , то есть ростом в направлении силы тяжести . Этот эффект достигается за счет переориентации микротрубочек , которые, как скелетные структуры, определяют направление роста (накопление целлюлозных волокон ) зародыша. Их переводят из вертикальной в горизонтальную ориентацию. Предполагается, что преодоление препятствий имеет биологический смысл: Этен образуется в течение всего процесса роста и накапливается перед препятствиями, на которых происходит увеличение толщины и, следовательно, большее развитие силы через кончик корня.
Вторая функция этена связана с различными процессами старения растений. Это включает созревание плодов и развитие цветов, а также опадание листьев ( опадение ) или гибель частей растений ( старение ). Важным для этих функций является лавинообразное увеличение доступного количества этена, которое происходит потому, что синтез этена активируется его присутствием. Таким образом, плод созревает во всех местах одновременно. Эффект созревания плодов используется в сельском хозяйстве, чтобы впоследствии побудить незрелые собранные фрукты к метаболическим процессам, которые позволяют фруктам созреть.
С середины 1990-х годов, конкретные генетические модификации были использованы для производства томатов , которые особенно прочные ( Flavr-Savr томаты ). Ген, ответственный за производство этена, выключен. Затем эти помидоры можно окурить этеном по мере необходимости и таким образом сделать их спелыми. Часто плоды намеренно не доводят до созревания, а затем транспортируют, а созревают только в месте назначения с помощью этена. Незрелые помидоры можно сделать спелыми, добавив несколько спелых помидоров. Они выделяют этен и, таким образом, созревают незрелые помидоры.
Этен также важен как «средство тревоги» в случае заражения растений вредителями и ран. Вместе с другими веществами, такими как салициловая кислота и жасмонат , этен ограничивает пораженную область и обеспечивает растительные яды . Как газ, этен действует на соседние части растения или растения и запускает там сигнальный каскад. Как показывает исследование Сильвии Хьюз, акации передают опасность через выделение этена ближайшим акациям, когда они пасутся антилопами или жирафами.
Как и в случае с другими фитогормонами, было проведено очень мало исследований механизма действия этена. Предполагается, что этен действует на специфические молекулы рецептора (рецептор этена ETR) на клеточных мембранах , которые инициируют каскад эффектов внутри клетки . В частности, это инактивация серин / треонинкиназы CTR1. Сигнал передается в различные ядра клетки - белки ( белки IN3 / EIL) в качестве факторов транскрипции в эффекте экспрессии генов и, таким образом, активируются определенные гены . Первый известный ген-мишень для этих белков был описан как фактор ответа на этен 1 (ERF1). Этот фактор, в свою очередь, контролирует несколько генов, поэтому, когда этен действует на эту систему, всегда запускается целая серия генетических активностей. Например, во время созревания плодов должны образовываться различные ферменты для смягчения клеточной стенки, тогда как старение включает образование хитина и ферментов, разлагающих целлюлозу ( хитиназы , целлюлазы ). Репертуар стресса растений , то есть реакции на вредителей и ран, вызванной этеном, очень обширен . В этой ситуации, помимо прочего, продуцируются хитиназы (как защита от насекомых ), глюканазы , ингибиторы протеиназ (ингибиторы ферментов, расщепляющих белок, против грибков) и многие другие антитела.
В основе синтеза этена в растении лежит аминокислота метионин . Это производит на первой стадии путем связывания с аденозиновым на S-аденозилметионин (SAM). АСС- оксидаза высвобождает этен из вторичного продукта 1-аминоциклопропанкарбоновой кислоты (АСС) . Образование оксидазы стимулируется самим этеном, который, подобно цепной реакции в соседних клетках, способствует образованию этена.
опасности
Этен горит в воздухе слегка закопченным, раскаленным пламенем. Этен очень легко воспламеняется. Емкости с этиленом необходимо хранить в хорошо вентилируемом месте. Он должен храниться вдали от источников возгорания и должны быть приняты меры для предотвращения электростатического заряда. При долях воздуха от 3 до 36 об.% Он образует взрывоопасные смеси. Этен в высоких концентрациях оказывает наркотическое действие.
доказательство
Двойная связь этена может быть обнаружена с помощью бромной воды , так как реакция двух веществ потребляет бром с образованием 1,2-дибромэтана, и в результате бромная вода коричневатого цвета обесцвечивается.
литература
- Клаус Люрссен: Растительный гормон этилен. Биосинтез, воздействие на растения и возможные применения. В кн . : Химия в наше время . 15-й год, № 4, 1981, стр. 122–129, DOI: 10.1002 / ciuz.19810150405 .
- Клаус-Юрген Эстлер: фармакология и токсикология . Schattauer, Штутгарт 1992, 2000, ISBN 3-7945-1898-5 .
- Герхард Люфт: Полимеризация этилена под высоким давлением. В кн . : Химия в наше время . 34. Jg, № 3, 2000, стр 190-199,.. DOI : 10.1002 / 1521-3781 (200006) 34: 3 <190 :: АИД-CIUZ190> 3.0.CO; 2-V .
веб ссылки
- Вход на этен . В: P. J. Linstrom, W. G. Mallard (Eds.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69 . Национальный институт стандартов и технологий , Гейтерсбург, Мэриленд
Индивидуальные доказательства
- ↑ б с д е е г ч запись на этена в базе данных GESTIS вещества в IFA , доступ к 1 февраля 2016 года. (Требуется JavaScript)
- ↑ Дэвид Р. Лид (Ред.): Справочник CRC по химии и физике . 90-е издание. (Интернет-версия: 2010 г.), CRC Press / Тейлор и Фрэнсис, Бока-Ратон, Флорида, Диэлектрическая проницаемость (диэлектрическая проницаемость ) газов, стр. 6-188.
- ↑ запись на этилен в классификации и маркировки Перечня в Европейское химическое агентство (ECHA), доступ к 1 февраля 2016 г. Производители или поставщики могут расширить гармонизированной системы классификации и маркировки .
- ↑ Швейцарский фонд страхования от несчастных случаев (Сува): предельные значения - текущие значения MAK и BAT (поиск 74-85-1 или этен ), по состоянию на 2 ноября 2015 г.
- ↑ Дэвид Р. Лид (Ред.): Справочник CRC по химии и физике . 90-е издание. (Интернет-версия: 2010), CRC Press / Тейлор и Фрэнсис, Бока-Ратон, Флорида, Стандартные термодинамические свойства химических веществ, стр. 5-22.
- ↑ Sycomore Fig (версия Html) ( Memento от 8 января 2012 г. в Интернет-архиве ) , версия PDF (593 kB) от 30 мая 2009 г.
- ^ Винфрид Р. Пётч, Аннелора Фишер и Вольфганг Мюллер в сотрудничестве с Хайнцем Кассебаумом : лексикон выдающихся химиков . Bibliographisches Institut, Лейпциг 1988, ISBN 3-323-00185-0 , стр. 33-34.
- ↑ Приложение, §VIII, стр. 474 и сл., Эксперименты и наблюдения, относящиеся к различным разделам естественной философии: с продолжением наблюдений в эфире , Джозеф Пристли, Лондон: напечатано для Дж. Джонсона, 1779, Том 1.
- ^ Сет С. Расмуссен: Ацетилен и его полимеры. 150+ лет истории. Springer, ISBN 978-3-319-95488-2 , стр. 9 f. ( Ограниченный предварительный просмотр в поиске книг Google).
- ↑ Запись о дихлорэтане. В: Römpp Online . Георг Тиме Верлаг, по состоянию на 12 июня 2014 г.
- ^ A b Питер Имхоф (редактор), Ян Корнелис ван дер Ваал (редактор): Разработка каталитических процессов для возобновляемых материалов. Wiley-VCH Verlag, 2013, ISBN 978-3-527-33169-7 , стр. 25-27.
- ↑ Манфред Бернс, Арно Бер, Аксель Брем, Юрген Гмелинг, Кай-Олаф Хинрихсен, Ханс Хофманн, Регина Палковиц, Ульферт Онкен, Альберт Ренкен: Technische Chemie . 2-е издание. Wiley-VCH Verlag GmbH & Co. KGaA, Вайнхайм, Германия 2013, ISBN 978-3-527-33072-0 , стр. 551 .
- ↑ Оливер Конзе: Трубопровод заполнен за две недели. Сообщение в Donaukurier от 13 сентября 2012 г.
- ↑ https://bauforumstahl.de/upload/documents/brandschutz/kennwerte/Heizwertstoffe.pdf
- ↑ WH Keesom, KW Taconis: Рентгеновский гониометр для исследования кристаллической структуры затвердевшего газа. В кн . : Physica. 2, 1935 г., стр. 463, DOI: 10.1016 / S0031-8914 (35) 90116-1 .
- ^ Карл Циглер - Последствия и развитие изобретения. (PDF, 633 кБ) Проверено 29 мая 2013 .
- ↑ Хайке Клоппенбург, Томас Гросс, Мартин Мезгер, Клаус Врана: Эластичный век. Синтетические каучуки. В кн . : Химия в наше время. 43, 2009, стр. 392-406, DOI : 10.1002 / ciuz.200600515 .
- ^ Ричард А. Лав, Томас Ф. Кетцл, Грэм Дж. Б. Уильямс, Лоуренс С. Эндрюс, Роберт. Конструкция: Нейтронографическое исследование структуры соли Цейзе, KPtCl3 (C2H4) .H2O. В кн . : Неорганическая химия. 14, 1975, стр. 2653, DOI: 10.1021 / ic50153a012 .
- ↑ Исследование рынка этилена, проведенное Ceresana Research, декабрь 2010 г.
- ↑ Сильвия Хьюз: Антилопа активирует сигнализацию акации. Проверено 9 июня 2015 года .
- ↑ а б Шопфер, Питер. Бреннике, Аксель. Мор, Ганс .: Физиология растений . Spectrum Academic Publishing House, 2010, ISBN 978-3-8274-2351-1 .







![{\ displaystyle n \ \ mathrm {CH_ {2} {=} CH_ {2} \ longrightarrow [-CH_ {2} {-} CH_ {2} -]} _ {n}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a3c5b6af3a6389e162b9365b78de1f79c8eb6735)





![\ mathrm {[PdCl_ {4}] ^ {2 -} + C_ {2} H_ {4} + H_ {2} O \ rightarrow CH_ {3} CHO + Pd + 2 \ HCl + 2 \ Cl ^ {-} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/84f36753ba6922fdba1d1d36fe0f86d94c664f66)
![\ mathrm {Pd + 2 \ CuCl_ {2} +2 \ Cl ^ {-} \ rightarrow [PdCl_ {4}] ^ {2 -} + 2 \ CuCl}](https://wikimedia.org/api/rest_v1/media/math/render/svg/572ed0fdcaf257aec043465677973e1a9651b67c)




