Болезнь неправильной упаковки белков
В качестве белковых неправильного сворачивания заболеваний , в том числе сворачивания белка заболеваний ( Engl. Белковые заболеваний неправильного сворачивания или белковых неправильного сворачивания расстройств или конформационных заболеваний или proteopathies называемых), это относится к тем заболеваниям , вызванных неправильно свернутых белков , вызванных внутри и вне клеток. Неправильно свернутые белки либо хранятся в клетках, либо расщепляются в протеасоме . В первом случае образуются токсические отложения (бляшки), во втором - потеря функции из-за дефицита соответствующего белка в клетке или во всем организме . Со временем оба они могут стать патологическими для человека и, в зависимости от рассматриваемого белка, привести к различным заболеваниям.
Биохимический механизм
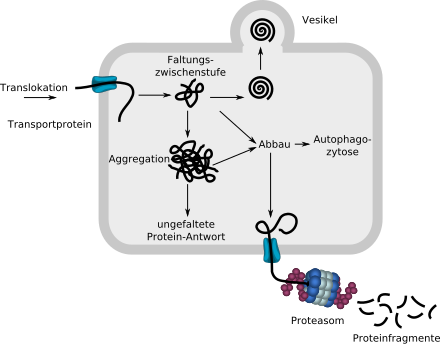
через транспортный белок, начинает сворачиваться с помощью шаперонов (не показаны). Если контроль качества белка распознает его как правильно свернутый, он удаляется из ER через везикулу. Неправильно свернутые белки направляются в цитозоль через транспортный белок, где они расщепляются на фрагменты в протеасоме. Аморфные агрегаты также могут разрушаться посредством аутофагоцитоза .
Если слишком много молекул разрушается из-за неправильного складывания, это может привести к потере функции клетки или всего организма. Если образуется слишком много нерастворимых, больше не разлагаемых агрегатов, образуются отложения, токсичные для клетки и всего организма.
В большинстве клеток всех организмов в процессе синтеза белка постоянно вырабатываются самые разнообразные белки , которые выполняют самые разные функции в клетке и во всем организме. Для правильного функционирования белка решающее значение имеет его третичная структура . Эта структура достигается за счет процесса, называемого сворачиванием белка. Сворачивание белков - сложный и деликатный процесс. Правильная укладка белка контролируется контролем качества белка . По статистике, около 30% всех белков биосинтеза белка неправильно свернуты и обычно расщепляются в протеасоме клетки в течение примерно десяти минут. Накопление неправильно свернутых белков в эндоплазматическом ретикулуме приводит к ответу развернутого белка , стрессовому ответу клеток, который связан с подавлением трансляции и повышенным синтезом шаперонов .
Одна молекула неправильно свернутого белка не ответственна за серьезные клинические картины заболеваний неправильной укладки белка. Для этого необходимо продуцировать большие количества этих белков или уменьшить количество правильно свернутых молекул. В случае с прионами это происходит потому, что неправильно свернутая молекула, когда она входит в контакт с правильно свернутой молекулой, заставляет правильную молекулу разворачиваться и в конечном итоге снова неправильно складываться. Поскольку первый неправильно свернутый белок не изменяется в этом процессе (он действует как фермент ), тогда присутствуют две неправильно свернутые молекулы. Они могут складывать и другие правильные молекулы.
Дефектные белки также называются дефектными рибосомами (Products Engl. Defective ribosomal products , drips) соответственно.
причины
Причины неправильного сворачивания белков сложны. Генные мутации в экзонах , которые приводят к изменениям в аминокислотной последовательности , т.е. первичной структуры с продуктом гена , оказывают непосредственное влияние на вторичную и третичную структуру, или на кинетику сворачивания белка. Ошибки в транскрипции или трансляции также могут привести к неправильной укладке белков. Другой возможный фактор - это окружающая среда; Например, при инфекционных прионных заболеваниях прионный белок попадает в организм с пищей или переносится с помощью хирургических инструментов. В настоящее время появились первые признаки токсина ( BMAA ), продуцируемого саговниками и цианобактериями , который при включении в белки приводит к их неправильной укладке и, таким образом, возможно, к форме БАС .
Повышение токсической функции
Если DRiP в протеасоме не может быть разрушен, например, потому что они ранее были агрегированы с образованием агрегатов, DRiP накапливаются в клетке. Там они со временем могут стать патологическими, то есть привести к конкретным заболеваниям. Эти белковые агрегаты ведут главным образом к нейродегенеративных заболеваний , таких как болезнь Паркинсона , болезнь Альцгеймера или Хантингтона болезни «ы . Агрегаты выполняют в клетках новую токсическую функцию. Английский термин усиление (токсической) функции используется для обозначения токсического действия внутри клеток .
В англоязычной специальной литературе термины протеинопатия и протеопатия стали использоваться для обозначения этой формы болезни неправильного сворачивания белков . Соответствующие немецкие термины протеопатия и протеинопатия ( приставка протео- = « белок » и суффикс -патия = «болезнь»), с другой стороны, до сих пор почти не закрепились в немецкоязычной специальной литературе.
В настоящее время (по состоянию на 2011 г.) известно более 100 протеинопатий у человека и животных. Они вызваны отложением около 20 негомологичных белков. Амилоидозы составляют большую и важную группу .
К болезням неправильного сворачивания белков с усилением токсической функции относятся следующие заболевания:
Потеря физиологической функции
Заболевания неправильного свертывания белков также включают заболевания, при которых неправильно свернутые белки расщепляются в протеасоме, в результате чего недостаточные количества белка становятся доступными для клеток или организма. Эта потеря функции, англ. потеря (физиологической) функции может привести к таким заболеваниям, как муковисцидоз . Большинство пациентов с муковисцидозом имеют мутацию ΔF508 (тип делеции ) в белке CFTR - хлоридном канале . Удаление трех нуклеотидов приводит к тому, что аминокислота фенилаланин (в однобуквенном коде F) отсутствует в положении 508 CFTR . Эта мутация сильно изменяет кинетику сворачивания очень сложного CFTR, который , помимо прочего, имеет 21 трансмембранный белковый домен . Процесс сворачивания CFTR дикого типа занимает более двух часов, и только около 30% синтезированных молекул CFTR сворачиваются достаточно быстро, чтобы избежать ER-ассоциированной деградации белка (ERAD). ΔF508-CFTR складывается немного хуже и полностью разрушен, хотя в принципе он мог бы полностью функционировать как ионный канал. У пациентов, затронутых этой мутацией, отсутствует хлоридный канал (= потеря функции), что означает, что состав секретов различных выделительных желез резко изменяется.
Утрата физиологической функции возникает, в частности, при следующих заболеваниях:
| болезнь | дефектный белок / ген | Замечания |
| Кистозные почки | Полицистин-1 | |
| Болезнь Шарко-Мари-Тута | Аминоацил-тРНК синтетаза (AARS) | |
| Х-сцепленный лимфопролиферативный синдром | SH2D1A | |
| Болезнь Гиршпрунга | Рецептор тирозинкиназы Ret | |
| Гомоцистинурия и метилмалоновая ацидурия | MMACHC | |
| Гипоплазия надколенника | TBX4 | Ишиопателлярная дисплазия |
| Склеростеоз | Склеростин | |
| Муковисцидоз | CFTR | |
| Фенилкетонурия | Фенилаланингидроксилаза | |
| Ладонно-стопно-генитальный синдром | Гомеобокс протеин A13 | |
| лизосомные болезни накопления | различные лизосомальные ферменты | более 40 индивидуальных заболеваний, в том числе Болезнь Гоше, болезнь Фабри , синдром Тея-Сакса или болезнь Краббе |
| QT синдром | я. hERG | |
| Синдром Ангельмана | UBE3A | |
| наследственный рак груди | BRCA1 |
Прирост функции и потеря функции
Кроме того, существуют заболевания неправильной укладки белка, при которых как потеря функции, так и отложения токсичного белка могут стать патологическими. Примером этого является дефицит альфа-1-антитрипсина . Мутации в SERPINA1 гена , который кодирует острой фазы белка альфа-1-антитрипсина - это ингибитор протеазы - закодированные , вызывает неправильного сворачивания альфа-1-антитрипсина. α-1-антитрипсина в основном выражается гепатоцитов в печени . Из-за неправильной укладки он не может секретироваться гептоцитами и образует внутриклеточные отложения. Утрата функции приводит у пораженного пациента к прогрессирующей эмфиземе легких , так как из-за недостатка α-1-антитрипсина фермент лейкоцитарной эластазы (англ. Human Leukocyte elastase , HLE) может безудержно разрушить структуру легких. Отложения α-1-антитрипсина в гепатоцитах приводят к циррозу печени, параллельному эмфиземе легких .
Концепции лечения
Заболевания неправильной укладки белка в настоящее время неизлечимы. Пока не существует причинной или лечебной терапии наиболее распространенных нейродегенеративных заболеваний, вызванных усилением токсической функции . Лечение пациентов обычно симптоматическое или чисто паллиативное . В будущем есть несколько концепций лечебного лечения, такие как генная терапия , но до их утверждения еще много лет .
Заболевания, связанные с неправильной упаковкой белка, которые вызваны потерей функции белка, в некоторых случаях можно лечить лечебно. При заместительной ферментной терапии недостающий белок, созданный с помощью генной инженерии, искусственно вводится пациенту . Шаперонная терапия может стать будущим вариантом лечения обоих типов нарушений неправильного свертывания белков. Молекулярные шапероны - это белки, наиболее важной задачей которых является «помочь» вновь синтезируемым белкам в их правильной укладке. Кроме того, были идентифицированы и разработаны «искусственные» химические и фармакологические шапероны, которые также поддерживают процесс сворачивания. Активный ингредиент сапроптерин для лечения фенилкетонурии является примером одобренного фармакологического шаперона. Iminosugar 1-deoxygalactonojirimycin (DGJ), международные неправительственные фирменное наименование Migalastat, является еще одним фармакологическим компаньонка , что в настоящее время (по состоянию на октябрь 2011 года) в клинической фазе III для проверки его эффективности у пациентов с болезнью Фабри.
Особенно зеленый чай происходит эпигаллокатехин галлат (EGCG), очевидно , поддерживать возможность правильного сворачивания белков. В экспериментах in vitro EGCG был способен ингибировать фибриллогенез (образование фибрилл ) хантингтина, α-синуклеина и β-амилоида. EGCG гарантирует, что вместо волокнистых токсичных фибрилл образуются безвредные сферические олигомеры . Очевидно, он также способен растворять уже образовавшиеся бляшки. У окрашенных мышей количество бляшек в коре, гиппокампе и энторинальной коре может быть уменьшено примерно на 50%.
Неправильная сворачивание вне ячеек
Примерно с 2008 года становится все более очевидным, что неправильная упаковка белков приводит не только к проблемам внутри клеток, но и в значительной степени во интерстициальном пространстве . Важность глифатической системы (утилизация отходов центральной нервной системы ) для удаления неправильно свернутых белков из мозга была обнаружена в 2012 году и с тех пор является предметом интенсивных исследований. В частности, это относится ко всем известным и широко распространенным нейродегенеративным заболеваниям .
дальнейшее чтение
Справочная литература
- М. Рамирес-Альварадо, Дж. В. Келли, С. М. Добсон (ред.): Заболевания неправильной укладки белков. Издатель John Wiley and Sons, 2010 г., ISBN 0-471-79928-9 ограниченный предварительный просмотр в Поиске книг Google
- J. Ovádi, F. Orosz (Eds.): Сворачивание и неправильное сворачивание белков: нейродегенеративные заболевания. Verlag Springer, 2009, ISBN 1-4020-9433-7 ограниченный предварительный просмотр в поиске книг Google
- HJ Smith, C. Simons, RDE Sewell: Неправильная укладка белков при нейродегенеративных заболеваниях. CRC Press, 2008, ISBN 0-8493-7310-7
- В. Н. Уверский, А. Л. Финк (ред.): Неправильная укладка белков, агрегация и конформационные заболевания. Verlag Springer, 2007, ISBN 0-387-36529-X ограниченный предварительный просмотр в поиске книг Google
- Р. М. Мерфи, А. М. Цай: Неподходящие белки - белковая (неправильная) укладка, агрегация и стабильность. Verlag Springer, 2006, ISBN 0-387-30508-4 ограниченный предварительный просмотр в поиске книг Google
- П. Бросс, Н. Грегерсен (ред.): Неправильная укладка белков и болезнь: принципы и протоколы. Humana Press, 2003, ISBN 1-58829-065-4 ограниченный предварительный просмотр в Поиске книг Google
Обзорная статья
- К.Ф. Винкльхофер, Дж. Татцельт, К. Хаасс: Две стороны неправильного свертывания белков: усиление и потеря функции при нейродегенеративных заболеваниях. В кн . : Журнал EMBO . Том 27, номер 2, январь 2008 г., стр. 336-349, ISSN 1460-2075 . DOI: 10.1038 / sj.emboj.7601930 . PMID 18216876 . PMC 2234348 (полный текст).
- H. Naiki, Y. Nagai: Молекулярный патогенез болезней неправильного свертывания белков: патологические молекулярные среды по сравнению с системами контроля качества против неправильно свернутых белков. В кн . : Журнал биохимии . Том 146, номер 6, декабрь 2009 г., стр. 751-756, ISSN 1756-2651 . DOI: 10.1093 / jb / mvp119 . PMID 19643812 .
- LM Luheshi, CM Dobson : Преодоление разрыва: от неправильного свертывания белка до болезней неправильного свертывания белка. В: Письма FEBS . Volume 583, Number 16, August 2009, pp. 2581-2586, ISSN 1873-3468 . DOI: 10.1016 / j.febslet.2009.06.030 . PMID 19545568 .
- М. Стоппини, Л. Обичи и др.: Протеомика при заболеваниях неправильной укладки белков. В кн . : Клиническая химия и лабораторная медицина. Volume 47, Number 6, 2009, pp. 627-635, ISSN 1434-6621 . DOI: 10.1515 / CCLM.2009.164 . PMID 19527136 .
- Х. Экройд, Дж. А. Карвер: разгадывая тайны сворачивания и неправильного сворачивания белков. В кн . : Жизнь МСБМБ. Том 60, номер 12, декабрь 2008 г., стр. 769-774, ISSN 1521-6551 . DOI: 10.1002 / iub.117 . PMID 18767168 . (Рассмотрение).
- Г.Б. Ирвин, О.М. Эль-Агнаф и др.: Агрегация белков в головном мозге: молекулярная основа болезней Альцгеймера и Паркинсона. В: Молекулярная медицина (Кембридж, Массачусетс). Том 14, номера 7-8, июль-август 2008 г., стр. 451-464, ISSN 1076-1551 . DOI: 10.2119 / 2007-00100.Irvine . PMID 18368143 . PMC 2274891 (полный текст). (Рассмотрение).
- E. Laskowska, E. Matuszewska, D. Kuczynska-Wisnik: Малые белки теплового шока и болезни неправильного связывания белков. В: Текущая фармацевтическая биотехнология . Том 11, номер 2, февраль 2010 г., стр. 146-157, ISSN 1873-4316 . PMID 20166966 .
- Н. Грегерсен: Нарушения неправильного свертывания белков: патогенез и вмешательство. В: Журнал наследственных метаболических заболеваний. Том 29, номера 2-3, апрель-июнь 2006 г., стр. 456-470, ISSN 1573-2665 . DOI: 10.1007 / s10545-006-0301-4 . PMID 16763918 . (Рассмотрение).
- М. Стефани: Неправильная укладка и агрегация белков: новые примеры в медицине и биологии темной стороны белкового мира. В: Biochimica et biophysica acta . Том 1739, номер 1, декабрь 2004 г., стр. 5-25, ISSN 0006-3002 . DOI: 10.1016 / j.bbadis.2004.08.004 . PMID 15607113 . (Рассмотрение).
Индивидуальные доказательства
- ↑ DM Cyr, DN Hebert: Контроль качества протеина - связь развернутой реакции протеина с болезнью. Конференция «От развернутых белков эндоплазматического ретикулума к заболеванию». В: Отчеты EMBO. Том 10, номер 11, ноябрь 2009 г., стр. 1206-1210, ISSN 1469-3178 . DOI: 10.1038 / embor.2009.224 . PMID 19851332 . PMC 2775177 (полный текст).
- ^ У. Шуберт, Л. К. Антон и др.: Быстрая деградация большой фракции вновь синтезированных белков протеасомами. В кн . : Природа . Volume 404, Number 6779, April 2000, pp. 770-774, ISSN 0028-0836 . DOI: 10,1038 / 35008096 . PMID 10783891 .
- ↑ С.Б. Цянь, Дж. Р. Беннинк, Дж. У. Юделл: Определение количества дефектных рибосомных продуктов. В кн . : Методы молекулярной биологии. Том 301, 2005 г., стр. 271-281, ISSN 1064-3745 . DOI: 10.1385 / 1-59259-895-1: 271 . PMID 15917638 .
- ↑ JW Yewdell, LC Antón, JR Bennink: Дефектные рибосомные продукты (DRiP): основной источник антигенных пептидов для молекул MHC класса I? В: Журнал иммунологии. Том 157, номер 5, сентябрь 1996 г., стр. 1823-1826, ISSN 0022-1767 . PMID 8757297 . (Рассмотрение).
- ↑ Рэйчел Энн Данлоп, Пол Алан Кокс и др.: Небелковая аминокислота BMAA неправильно включена в человеческие белки вместо l-серина, вызывающего неправильную укладку и агрегацию белков. В: PLoS ONE. 8, 2013, стр. E75376, DOI : 10.1371 / journal.pone.0075376 .
- ↑ К.Ф. Винкльхофер, Дж. Татцельт, К. Хаасс: Две стороны неправильного свертывания белков: усиление и потеря функции при нейродегенеративных заболеваниях. В: Журнал EMBO. Том 27, номер 2, январь 2008 г., стр. 336-349, ISSN 1460-2075 . DOI: 10.1038 / sj.emboj.7601930 . PMID 18216876 . PMC 2234348 (полный текст). (Рассмотрение).
- ↑ Р. Кисилевский: амилоид: надгробия или триггеры? В кн . : Природная медицина . Том 6, номер 6, июнь 2000 г., стр. 633-634, ISSN 1078-8956 . DOI: 10,1038 / 76203 . PMID 10835676 . (Рассмотрение).
- ↑ a b c Ю. Л. Любченко, Б. Х. Ким и др.: Наноимиджинг для болезней неправильной укладки белков. В: Междисциплинарные обзоры Wiley. Наномедицина и нанобиотехнология. Том 2, номер 5, сентябрь-октябрь 2010 г., стр. 526-543, ISSN 1939-0041 . DOI: 10.1002 / wnan.102 . PMID 20665728 . (Рассмотрение).
- ↑ L. Schöls, O. Riess, T. Schmidt: Аутосомно-доминантная наследственная спиноцеребеллярная атаксия: Клиника, генетика и патогенез. В: Dtsch Arztebl. Volume 98, Number 23, 2001, pp. A-1546 / B-1319 / C-1233.
- ^ В. Тарлак, Э. Стори: Роль протеолиза в нарушениях полиглутамина. В: Journal of Neuroscience Research. Том 74, номер 3, ноябрь 2003 г., стр. 406-416, ISSN 0360-4012 . DOI: 10.1002 / jnr.10746 . PMID 14598317 . (Рассмотрение).
- ↑ M. Ramírez-Alvarado, JN Buxbaum: Systemic Amyloidose. В: M. Ramírez-Alvarado, JW Kelly, CM Dobson (Eds.): Protein Misfolding Diseases. Джон Вили и сыновья, 2010, ISBN 0-471-79928-9 , стр. 325-346. ограниченный предварительный просмотр в поиске книг Google
- ^ VL Sim, B. Caughey: Терапия прионной болезни: испытания и невзгоды. В: M. Ramírez-Alvarado, JW Kelly, CM Dobson (Eds.): Protein Misfolding Diseases. Издатель John Wiley and Sons, 2010, ISBN 0-471-79928-9 , стр. 259-304. ограниченный предварительный просмотр в поиске книг Google
- ↑ Дж. Ван, Дж. А. Кинг: Катаракта как заболевание агрегации белков. В: M. Ramírez-Alvarado, JW Kelly, CM Dobson (Eds.): Protein Misfolding Diseases. Издатель John Wiley and Sons, 2010 г., ISBN 0-471-79928-9 , стр. 487-516. ограниченный предварительный просмотр в поиске книг Google
- ↑ PB Stathopulos, JA Rumfeldt et al.: Cu / Zn-мутанты супероксиддисмутазы, ассоциированные с боковым амиотрофическим склерозом, демонстрируют усиленное образование агрегатов in vitro. В: Известия Национальной академии наук . Volume 100, Number 12, June 2003, pp. 7021-7026, ISSN 0027-8424 . DOI: 10.1073 / pnas.1237797100 . PMID 12773627 . PMC 165823 (полный текст).
- ↑ Л. Ван, К. Дж. Колоднер, М. Б. Фини: Неправильная укладка белков и окислительный стресс способствуют глиальной нейродегенерации в модели болезни Александера. В: Журнал неврологии. Том 31, номер 8, февраль 2011 г., стр. 2868-2877, ISSN 1529-2401 . DOI: 10.1523 / JNEUROSCI.3410-10.2011 . PMID 21414908 . PMC 3082397 (полный текст).
- ↑ Д. Эрве, Х. Шабриат: КАДАСИЛ . В кн . : Журнал гериатрической психиатрии и неврологии. Том 23, номер 4, декабрь 2010 г., стр. 269-276, ISSN 0891-9887 . DOI: 10.1177 / 0891988710383570 . PMID 21045164 . (Рассмотрение).
- ↑ AA Amato, RJ Barohn: Миозит с включенными тельцами: старые и новые концепции. В: Журнал неврологии, нейрохирургии и психиатрии. Том 80, номер 11, ноябрь 2009 г., стр. 1186-1193, ISSN 1468-330X . DOI: 10.1136 / jnnp.2009.173823 . PMID 19864656 . (Рассмотрение).
- ↑ L. Skora: Характеристика с высоким разрешением структурных изменений, связанных с прионными заболеваниями и амилоидозом, связанным с диализом. (PDF; 4,6 МБ) Диссертация, Георг-Август-Гёттингенский университет, 2009 г., стр. Iii.
- ↑ PJ Waters: Деградация мутантных белков, лежащая в основе фенотипов «потери функции», играет важную роль в генетических заболеваниях. (PDF; 537 kB) В: Актуальные вопросы молекулярной биологии. Volume 3, Number 3, July 2001, pp. 57-65, ISSN 1467-3037 . PMID 11488412 . (Рассмотрение).
- ^ A b Д. Н. Хеберт, М. Молинари: В и из ER: сворачивание белка, контроль качества, деградация и связанные с ним заболевания человека. В кн . : Физиологические обзоры . Том 87, номер 4, октябрь 2007 г., стр. 1377-1408, ISSN 0031-9333 . DOI: 10.1152 / Physrev.00050.2006 . PMID 17928587 . (Рассмотрение).
- ↑ RR Kopito: Биосинтез и деградация CFTR. В кн . : Физиологические обзоры. Volume 79, Number 1, 1999, pp. S167-S173, ISSN 0031-9333 . PMID 9922380 . (Рассмотрение).
- ↑ Ф. Мельхиор: Распад внутриклеточного белка. ( Memento из в оригинале с 23 мая 2014 года в Internet Archive ) Info: архив ссылка была вставлена автоматически и еще не была проверена. Проверьте исходную и архивную ссылку в соответствии с инструкциями, а затем удалите это уведомление. (PDF; 3,5 МБ) Центр молекулярной биологии, WS 2009/2010, стр.30.
- ↑ Л. Аль-Бхалал, М. Ахтар: Молекулярные основы аутосомно-доминантной поликистозной болезни почек. В кн . : Успехи анатомической патологии. Том 12, номер 3, май 2005 г., стр. 126-133, ISSN 1072-4109 . PMID 15900113 . (Рассмотрение).
- ↑ HM McLaughlin, R. Sakaguchi и др.: Повторяющаяся мутация потери функции аланил-тРНК синтетазы (AARS) у пациентов с болезнью Шарко-Мари-Зуба типа 2N (CMT2N). В: Мутация человека. [электронная публикация перед печатью] октябрь 2011 г., ISSN 1098-1004 . DOI: 10.1002 / humu.21635 . PMID 22009580 .
- ↑ C. Li, C. Iosef et al.: Мутанты SAP, вызывающие заболевание, дефектны в связывании лиганда и сворачивании белка. В кн . : Биохимия . Том 42, номер 50, декабрь 2003 г., стр. 14885-14892, ISSN 0006-2960 . DOI: 10.1021 / bi034798l . PMID 14674764 .
- ↑ С. Кьяр, К. Ф. Ибаньес: Внутренняя предрасположенность к неправильному свертыванию горячей точки для мутаций болезни Гиршпрунга в эктодомене RET. В кн . : Молекулярная генетика человека . Том 12, номер 17, сентябрь 2003 г., стр. 2133-2144, ISSN 0964-6906 . DOI: 10,1093 / hmg / ddg227 . PMID 12915470 .
- ↑ JP Lerner-Ellis, JC Tirone et al.: Идентификация гена, ответственного за метилмалоновую ацидурию и гомоцистинурию, тип cblC. В кн . : Генетика природы . Том 38, номер 1, январь 2006 г., стр. 93-100, ISSN 1061-4036 . DOI: 10,1038 / нг1683 . PMID 16311595 .
- ↑ EM Bongers, PH Duijf et al.: Мутации в гене TBX4 человека вызывают синдром маленькой надколенника. В: Американский журнал генетики человека . Том 74, номер 6, июнь 2004 г., стр. 1239-1248, ISSN 0002-9297 . DOI: 10,1086 / 421331 . PMID 15106123 . PMC 1182087 (полный текст).
- ↑ E. Piters, C. Culha et al.: Первая миссенс-мутация в гене SOST, вызывающая склеростеоз из-за потери функции склеростина. В: Мутация человека. Том 31, номер 7, июль 2010 г., стр. E1526-E1543, ISSN 1098-1004 . DOI: 10.1002 / humu.21274 . PMID 20583295 .
- ^ WE Балч, И. Браакман и др.: Складная биология кистозного фиброза: подход к заболеванию на основе консорциума. В: M. Ramírez-Alvarado, JW Kelly, CM Dobson (Eds.): Protein Misfolding Diseases. Издатель John Wiley and Sons, 2010 г., ISBN 0-471-79928-9 , стр. 403-424. ограниченный предварительный просмотр в поиске книг Google
- ↑ DM Hutt, D. Herman et al.: Снижение активности гистондеацетилазы 7 восстанавливает функцию неправильно свернутого CFTR при муковисцидозе. В кн . : Природа, химическая биология . Том 6, номер 1, январь 2010 г., стр. 25-33, ISSN 1552-4469 . DOI: 10.1038 / nchembio.275 . PMID 19966789 . PMC 2901172 (полный текст).
- ↑ SW Gersting, KF Kemter et al.: Потеря функции при фенилкетонурии вызвана нарушением молекулярных движений и конформационной нестабильностью. В: Американский журнал генетики человека . Volume 83, Number 1, July 2008, pp. 5-17, ISSN 1537-6605 . DOI: 10.1016 / j.ajhg.2008.05.013 . PMID 18538294 . PMC 2443833 (полный текст).
- ↑ B. Utsch, CD McCabe et al.: Молекулярная характеристика белков экспансии полиаланина HOXA13 при синдроме ладонно-стопно-генитального синдрома. В: Американский журнал медицинской генетики. Том 143A, номер 24, декабрь 2007 г., стр. 3161-3168, ISSN 1552-4833 . DOI: 10.1002 / ajmg.a.31967 . PMID 17935235 .
- ↑ F. Wang, W. Song et al.: Ингибирование ER-ассоциированной деградации спасает естественный фолдинг при заболеваниях, связанных с нарушением фолдинга белков. В кн . : Журнал биологической химии . [электронная публикация перед отправкой в печать] Октябрь 2011 г., ISSN 1083-351X . DOI: 10.1074 / jbc.M111.274332 . PMID 22006919 .
- ^ Т. Эдмундс и др.: Болезнь Гоше. В: M. Ramírez-Alvarado, JW Kelly, CM Dobson (Eds.): Protein Misfolding Diseases. Издатель John Wiley and Sons, 2010 г., ISBN 0-471-79928-9 , стр. 403-424. ограниченный предварительный просмотр в поиске книг Google
- ↑ Г. Хин-Фай Ям и др.: Болезнь Фабри: о молекулярном патогенезе лизосомальной болезни накопления и использовании химического шаперона для терапевтического вмешательства. ( Памятка от 20 февраля 2007 г. в Интернет-архиве ) Цюрихский университет, 2 апреля 2007 г.
- ↑ F. Wang, W. Song et al.: Ингибирование ER-ассоциированной деградации спасает естественный фолдинг при заболеваниях, связанных с нарушением фолдинга белков. В кн . : Журнал биологической химии. [электронная публикация перед отправкой в печать] Октябрь 2011 г., ISSN 1083-351X . DOI: 10.1074 / jbc.M111.274332 . PMID 22006919 .
- ↑ Д.А. Вунгер: Болезнь Краббе. В: Р. А. Пагон, Т. Д. Берд и др.: (Ред.): GeneReviews. PMID 20301416
- ^ VE Walker, MJ Wong et al.: Шапероны Hsp40 способствуют деградации калиевого канала HERG. В: Журнал биологической химии. Том 285, номер 5, январь 2010 г., стр. 3319-3329, ISSN 1083-351X . DOI: 10.1074 / jbc.M109.024000 . PMID 19940115 . PMC 2823420 (полный текст).
- ↑ Р.С. Уильямс, Д.И. Часман и др.: Обнаружение дефектов сворачивания белков, вызванных укорочением BRCA1-BRCT и миссенс-мутациями. В: Журнал биологической химии. Том 278, номер 52, декабрь 2003 г., стр. 53007-53016, ISSN 0021-9258 . DOI: 10.1074 / jbc.M310182200 . PMID 14534301 .
- ↑ Д.А. Ломас, Д.Х. Перлмуттер: Дефицит альфа-1-антитрипсина. В: M. Ramírez-Alvarado, JW Kelly, CM Dobson (Eds.): Protein Misfolding Diseases. Издатель John Wiley and Sons, 2010 г., ISBN 0-471-79928-9 , стр. 403-424. ограниченный предварительный просмотр в поиске книг Google
- ↑ CM Greene, SD Miller et al.: Дефицит антитрипсина альфа-1: конформационное заболевание, связанное с проявлениями легких и печени. В: Журнал наследственных метаболических заболеваний. Том 31, номер 1, февраль 2008 г., стр. 21-34, ISSN 1573-2665 . DOI: 10.1007 / s10545-007-0748-у . PMID 18193338 . (Рассмотрение).
- ^ FE Коэн, JW Келли: Терапевтические подходы к заболеваниям, связанным с неправильной укладкой белка. В кн . : Природа. Том 426, номер 6968, декабрь 2003 г., стр. 905-909, ISSN 1476-4687 . DOI: 10,1038 / природа02265 . PMID 14685252 . (Рассмотрение).
- ↑ Т.К. Чаудхури, С. Пол: Заболевания, связанные с неправильной упаковкой белков, и терапевтические подходы на основе шаперонов. В: The FEBS Journal . Volume 273, Number 7, April 2006, pp. 1331-1349, ISSN 1742-464X . DOI: 10.1111 / j.1742-4658.2006.05181.x . PMID 16689923 . (Рассмотрение).
- ↑ Клиническое исследование (фаза III): Изучение эффектов перорального AT1001 (мигаластата гидрохлорида) у пациентов с болезнью Фабри на сайте Clinicaltrials.gov Национального института здоровья.
- ^ BE Робертс, Дж. Шортер: Избегая судьбы амилоида. В: Структурная и молекулярная биология природы . Том 15, номер 6, июнь 2008 г., стр. 544-546, ISSN 1545-9985 . DOI: 10.1038 / nsmb0608-544 . PMID 18523464 .
- ↑ DE Ehrnhoefer, M. Duennwald et al.: Зеленый чай (-) - эпигаллокатехин-галлат модулирует ранние события неправильной укладки хантингтина и снижает токсичность на моделях болезни Хантингтона. В кн . : Молекулярная генетика человека . Том 15, номер 18, сентябрь 2006 г., стр. 2743-2751, ISSN 0964-6906 . DOI: 10,1093 / hmg / ddl210 . PMID 16893904 .
- ↑ a b D. E. Ehrnhoefer, J. Bieschke et al.: EGCG перенаправляет амилоидогенные полипептиды в неструктурированные олигомеры , не участвующие в метаболизме . В кн . : Структурная и молекулярная биология природы. Том 15, номер 6, июнь 2008 г., стр. 558-566, ISSN 1545-9985 . DOI: 10.1038 / nsmb.1437 . PMID 18511942 .
- ↑ J. Bieschke, J. Russ et al.: EGCG ремоделирует зрелые альфа-синуклеин и бета-амилоидные фибриллы и снижает клеточную токсичность. В: Известия Национальной академии наук . Volume 107, Number 17, April 2010, pp. 7710-7715, ISSN 1091-6490 . DOI: 10.1073 / pnas.0910723107 . PMID 20385841 . PMC 2867908 (полный текст).
- ↑ Вещество EGCG в зеленом чае предотвращает образование фатальных бляшек при болезнях Паркинсона и Альцгеймера - первые результаты в пробирке. ( Memento из с оригинала от 7 апреля 2012 года в Internet Archive ) Info: архив ссылка была вставлена автоматически и еще не была проверена. Проверьте исходную и архивную ссылку в соответствии с инструкциями, а затем удалите это уведомление. Пресс-релиз Центра молекулярной медицины Макса Дельбрюка от 30 мая 2008 г.
- ↑ K. Rezai-Zadeh, GW Arendash et al.: Зеленый чай эпигаллокатехин-3-галлат (EGCG) снижает когнитивные нарушения, опосредованные бета-амилоидом, и модулирует тау-патологию у трансгенных мышей с болезнью Альцгеймера. В кн . : Исследования мозга. Том 1214, июнь 2008 г., стр. 177-187, ISSN 0006-8993 . DOI: 10.1016 / j.brainres.2008.02.107 . PMID 18457818 .
- ^ А. Шнайдер, М. Саймонс: Экзосомы: везикулярные носители для межклеточной коммуникации при нейродегенеративных расстройствах. В кн . : Клеточные и тканевые исследования. Том 352, номер 1, апрель 2013 г., стр. 33-47, DOI: 10.1007 / s00441-012-1428-2 , PMID 22610588 , PMC 3602607 (полный текст) (обзор).
- ^ Н. А. Джессен, А. С. Мунк, И. Лундгаард, М. Недергаард: Глимфатическая система: Руководство для начинающих. В кн . : Нейрохимические исследования. Том 40, номер 12, декабрь 2015 г., стр. 2583-2599, doi: 10.1007 / s11064-015-1581-6 , PMID 25947369 , PMC 4636982 (полный текст) (обзор).
веб ссылки
- Л. Уокер: Протеопатии: конформационные заболевания белков. ( Памятка от 14 апреля 2010 г. в Интернет-архиве ) 18 сентября 2008 г.