Ионная жидкость

Ионные жидкости ( англ. Ionic Liquids ( IL ), а также Room Temperature Ionic Liquids (RTIL) ) представляют собой соли с температурой плавления менее 100 ° C. Формированию стабильной кристаллической решетки препятствуют делокализация заряда и стерические эффекты. Поэтому даже небольшого количества тепловой энергии достаточно, чтобы преодолеть энергию решетки и разрушить твердую кристаллическую структуру.
Изменяя катион и анион, физико-химические свойства ионной жидкости можно варьировать в широких пределах и оптимизировать в соответствии с техническими требованиями. Помимо точки плавления, таким образом можно влиять на растворимость, например, гомогенных катализаторов , продуктов или исходных материалов в ионной жидкости.
Ароматические гетероциклы, такие как имидазолий или пиридиний , часто используются в качестве катионов, которые можно алкилировать . Подходящие алифатические соединения представляют собой, например, пирролидините , гуанидин , урониевое , тиоурониевое , пиперидиния , морфолинии , аммоний и фосфонию . В качестве анионов используются галогениды и слабо координирующие ионы, такие как тетрафторбораты , гексафторфосфат или сульфонамиды, а также рассматриваемые трифторацетаты , трифлаты , фосфинаты и тозилаты .
история
Новую историю ионных жидкостей можно разделить на три поколения, границы которых являются жидкими. Публикации, четко знаменующие начало поколения, можно найти только для первого и второго поколения. Подсчет генерации начинается только в 1980-х годах, когда ионные жидкости были специально произведены и исследованы на основе их свойств. Первые описания солей, соответствующих определению ионных жидкостей, были опубликованы еще в 1876 году.
Первые описания (1876–1929)
Уильям Рэмси описал пиколин и его производные в 1876 году , включая трибромид пиколиния и трийодид пиколиния. Его получают путем смешивания галогенов с соответствующими галогенидами пиколиния. Температура плавления 85 ° C дана для трибромида пиколиния и 79 ° C для трийодида пиколиния. Путем алкилирования пиколина в 1899 году можно было получить другие ионные жидкости. Например, известная температура плавления 1-пропил-2-пиколиния иодида составляет 77 ° C. Гомологичный иодид 1-бутил-2-пиколиния также является ионной жидкостью с температурой плавления 98 ° C. Аналогичное соединение с изобутильным радикалом имеет температуру плавления ниже -15 ° C и, таким образом, является первой ионной жидкостью, которая является жидкой при комнатной температуре.
Еще одно вещество, точная структура которого и, следовательно, классификация как ионная жидкость оставалась неизвестной более 100 лет, - это так называемое «красное масло». Это происходит как побочный продукт при алкилировании Фриделя-Крафтса , которое было впервые описано в 1877 году. Структурно «красное масло» представляет собой катионный промежуточный продукт Веланда и анион гептахлорида диалюминия.
Синтез и описание нитрата этаноламмония с температурой плавления 52 ° C Габриэлем и Вайнером последовали в 1888 году.
Несмотря на предыдущие описания, нитрат этиламмония (EAN) часто описывается как первая ионная жидкость в литературе . В 1914 году Пол Уолден синтезировал EAN с температурой плавления 12 ° C в результате реакции этиламина и азотной кислоты . Хотя Уолдену также удалось измерить проводимость EAN, потенциал ионных жидкостей остался нераскрытым. Только одно исследование парахора (мера молярного объема с одинаковым поверхностным натяжением ) некоторых солей в 1929 г. исследовало особенности ионных жидкостей.
Дальнейшее развитие (1950–1972 гг.)
В 1951 году было описано первое применение ионной жидкости. Херли и Виер смешали бромид этилпиридиния с хлоридом алюминия для получения ионных жидкостей различного состава. Варьируя соотношения в смеси хлорида алюминия и этилпиридиния бромида, они обнаружили две эвтектики : одну в соотношении 1: 2 с температурой плавления 45 ° C, а другую в соотношении 2: 1 с температурой плавления -40 °. С. Смесь 1: 1 плавится при 88 ° C и, следовательно, также является ионной жидкостью. Эти ионные жидкости могут быть использованы для электрохимического осаждения алюминия на различные металлы.
В 1963 году Йок описал реакцию гидрохлорида триэтиламмония с хлоридом меди (I) , в результате которой получился жидкий продукт. Однако, поскольку соединение не является устойчивым на воздухе из-за окисления Cu (I), его дальнейшие исследования не проводились.
Первая ионная жидкость с тетрафторборат-анионом была описана Корнблюмом и Коффи в 1966 году. При взаимодействии натриевой соли 2-пиридон с триэтилоксонией тетрафторборат , N - этил-2-ethoxypyridinium тетрафторборат может быть получено, который плавится при 47.5-48.5 ° С
Впервые использование ионных жидкостей в качестве растворителей было показано в 1972 году. Паршаллу удалось получить две ионные жидкости на основе тетраэтиламмония. В качестве анионов использовали трихлоростаннат и трихлорогерманат. В частности, станнат тетраэтиламмония можно использовать в качестве растворителя, поскольку он может растворять до 7 процентов по массе хлорида платины (II) . Этот раствор может служить каталитически активной реакционной средой для олефинов, которые можно гидрогенизировать , гидроформилировать или карбоалкоксилировать .
Первое поколение ионных жидкостей (с 1978 г.)
Галоалюминаты известны как первое поколение ионных жидкостей. Они уже были описаны Херли и Вайером в 1951 году, но не попали в центр исследований до 1970-х годов. Академии ВВС США были исследования легкоплавких электролитов для использования в аккумуляторных батареях с началом 1960 - х лет, в сотрудничестве с Робертом Osteryoung, среди других. Публикации обеих исследовательских групп знаменуют начало современной эры ионных жидкостей: в 1978 году Остериунг впервые смог описать и исследовать систему хлорид алюминия: 1-бутилпиридиния хлорид (AlCl 3 -BPC). В том же году ВВС США подали заявку на патент «Электролиты на основе хлорида AlCl3 / 1-алкилпиридиния комнатной температуры». Хотя эти соли плавятся раньше, чем смеси хлорида алюминия и хлорида натрия, ранее использовавшиеся ВВС в качестве электролитов, смесь хлорид алюминия: 1-бутилпиридиния хлорид (1: 1) не является жидкой при комнатной температуре, а плавится только при 40 ° C. ° С. Другой недостаток - суженное электрохимическое окно катиона пиридиния, которое можно уменьшить. Затем группа Уилкса и Хасси приступила к поиску более подходящего катиона, устойчивого к восстановлению до алюминия. Используя полуэмпирические расчеты молекулярных орбиталей, они смогли идентифицировать и синтезировать катионы диалкилимидазолия в качестве подходящих кандидатов в 1982 году .
Как AlCl 3 -BPC, так и вариант 1-этил-3-метилимидазолия можно использовать в качестве неводных и полярных растворителей для комплексов переходных металлов . Так мог z. B. Анионы гексахлормолибдата (III) и гексахлормолибдата (IV) впервые получены и исследованы в ионных жидкостях. В последующие годы ионные жидкости все чаще исследовались как каталитически активные растворители. Применения включают нуклеофильные ароматические замещения в тетраалкилфосфониевых ИЖ или алкилирование и ацетилирование Фриделя-Крафтса в тетрахлоралюминате 1-этил-3-метилимидазолия.
Второе поколение ионных жидкостей (с 1992 г.)
Основным недостатком ионных жидкостей на основе хлоралюминатов является их чувствительность к воде. Помимо прочего, при гидролизе образуется агрессивная соляная кислота . Для первоначального применения в аккумуляторной технологии чувствительность к гидролизу была незначительной, так как батареи в любом случае должны были работать без влаги, но обращение в лаборатории было почти исключительно возможным в перчаточном ящике . В 1990 году Майк Заворотко начал работать в Военно-воздушной академии, а в 1992 году вместе с Уилксом опубликовал первую статью о стабильных в воздухе и воде ионных жидкостях. Эта повышенная стабильность может быть достигнута путем обмена на хлоралюминат-анион. Типичными анионами в ионных жидкостях второго поколения являются хлорид, бромид и иодид галогенидов, а также тетрафторборат, гексафторфосфат или бензоат. В 1996 году в ионных жидкостях на основе имидазолия впервые были использованы перфторированные анионы, такие как бис (трифторметилсульфонил) амид, трифлат или трифторацетат . Эти ионные жидкости характеризуются своей гидрофобностью , низкой температурой плавления, иногда ниже -30 ° C, и высокой проводимостью.
Третье поколение ионных жидкостей (примерно с 2000 г. по настоящее время)
После того, как новые анионы второго поколения расширили область ионных жидкостей, третье поколение должно расширить спектр до примерно 10 18 возможных комбинаций. Так называемые «ионные жидкости для конкретных задач» или «дизайнерские растворители» были созданы из этого пула и адаптированы специально для конкретных приложений. Сюда также входят хиральные ионные жидкости и «глубокие эвтектические растворители». Ионные жидкости третьего поколения часто упоминаются в связи с «зеленой» химией, поскольку они являются альтернативой обычно используемым летучим, токсичным и легковоспламеняющимся растворителям.
Еще в 1996 году Eastman Chemical запустила первый крупномасштабный процесс с использованием ионной жидкости.
Производство
Синтез ионных жидкостей обычно происходит в два этапа: на первом этапе желаемый катион получают, обычно в результате реакции кватернизации, на втором этапе следует метатезис анионов.
Кватернизация
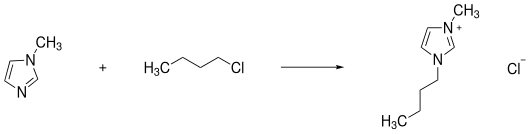
Реакция кватернизации - это нуклеофильное замещение. Алкилирующий агент, обычно галогеналкан, реагирует с азотсодержащим гетероароматическим веществом, таким как производные пиридина или имидазола. Метод также может быть использован для других, достаточно нуклеофильных веществ, таких как амины. Если уходящая группа в алкилирующем агенте уже является желаемым анионом, синтез ионных жидкостей уже завершен. Это особенно актуально при безгалогенидном синтезе ионных жидкостей. Диметил и диэтилсульфат могут служить алкилирующими агентами . Другими примерами, в которых ионные жидкости получают реакцией кватернизации, являются алкилирование метилтрифлатом или синтез [BMIM] Cl из метилимидазола и хлорбутана .
Анионный метатезис
Чтобы получить желаемый анион, существует три основных способа обмена аниона:
При взаимодействии с солью металла или аммония M + [A] - используется поведение растворимости ионных жидкостей и получаемой в результате нежелательной соли. Либо он осаждается непосредственно из растворителя, как в случае со многими солями серебра, либо используются двухфазные смеси.
Вместо соли металла можно также использовать кислоту Бренстеда аниона. Преимущество этого метода состоит в том, что очистка легко осуществляется путем испарения кислоты нежелательного аниона.
Третий вариант - использовать обменную смолу .
Кислоты Льюиса
Другой подход заключается в реакции аниона с кислотой Льюиса. Например, хлоридная соль может быть смешана с трихлоридом алюминия. Затем на месте образуется тетрахлоралюминат.
Этот метод используется для синтеза ионных жидкостей первого поколения.
Протонные ионные жидкости
Протонные ионные жидкости могут быть получены кислотно-щелочной реакцией . Это равновесная реакция, которая зависит от силы кислоты или основания.
- Кислота + основание находится в равновесии с конъюгированной (соответствующей) основанием + конъюгированной (соответствующей) кислотой.
Благодаря равновесной реакции многие протонные ионные жидкости имеют соответствующее давление пара и могут быть очищены дистилляцией. Примером протонной ионной жидкости на основе третичного амина является нитрат этиламмония.
характеристики
| характерная черта | органический растворитель | ионная жидкость |
| количество | > 1000 | > 10 6 |
| специфическая для процесса функция | однофункциональный | многофункциональный |
| расходы | небольшое количество | В 2–100 раз выше орг. растворитель |
| Давление газа | иметь давление пара (ЛОС) | нет значительного давления пара |
| Воспламеняемость | в основном легковоспламеняющийся | не горючий |
| приспособляемость | ограниченное количество | дизайнерские растворители |
| Хиральность | Редкий | общий и настраиваемый |
| Каталитическая активность | Редкий | общий и настраиваемый |
| Вязкость [мПас] | 0,2-100 | 20-97000 |
| Плотность [г · см -3 ] | 0,6–1,7 | 0,8–3,3 |
| электрическая проводимость [мСм · см -1 ] | в основном изоляторы | до 120 |
| теплопроводность [Вт · м −1 · K −1 ] | 0,1-0,6 | 0,1-0,3 |
Ионные жидкости обладают рядом интересных свойств. Однако из-за большого количества возможностей эти свойства можно обобщить лишь частично, а некоторые ионные жидкости значительно отличаются друг от друга. Большинство ионных жидкостей сравнительно термически стабильны, трудно воспламеняются, имеют очень низкое, трудно поддающееся измерению давление пара и очень хорошие свойства растворимости многих веществ. Благодаря своей чисто ионной структуре они также обладают интересными электрохимическими свойствами, такими как Б. Электропроводность, которая часто сопровождается высокой электрохимической устойчивостью к окислению и восстановлению. Электростатические взаимодействия между ионами можно описать уравнением Пуассона-Больцмана . Сравнение с обычными органическими растворителями показывает некоторые особые свойства ионных жидкостей и существенные различия. Одно из свойств, которое имеет решающее значение для использования ионных жидкостей в качестве растворителей, - это низкое, обычно незначительное давление пара. Хотя летучие органические соединения представляют собой проблему для окружающей среды и безопасности труда, ионные жидкости в этом отношении безвредны и даже могут использоваться для космических приложений. Исключение составляют протонные ионные жидкости (PIL), которые имеют более высокое давление пара из-за кислотно-щелочного равновесия. Воспламеняемость - еще одно важное свойство безопасности. Ионные жидкости обычно негорючие, хотя это свойство также можно целенаправленно изменить, например Б. для топлива. Выдающееся свойство ионных жидкостей - это электрическая проводимость. Только благодаря этому свойству ионные жидкости подходят для электрохимических применений, таких как накопление и преобразование энергии. Например, их можно использовать в аккумуляторных технологиях и солнечных элементах. Варьируя боковые цепи катиона и выбирая подходящие анионы, например, растворимость в воде или органических растворителях можно в значительной степени свободно определять. То же самое относится к температуре плавления и вязкости. Их можно синтезировать в виде кислот , оснований или лигандов с помощью соответствующих функциональных групп . В приложениях они могут не только выполнять роль растворителя, но также действовать как катализатор или вводить стереоинформацию в реакцию.
Температура плавления
Определяющим свойством ионных жидкостей является температура плавления. Точное определение температуры плавления часто бывает нетривиальным, поскольку стеклование может происходить при остывании ионных жидкостей .
Температура плавления в основном определяется кулоновским взаимодействием аниона и катиона. Это взаимодействие можно описать следующим уравнением:
Уравнение показывает, что на размер взаимодействия влияют три фактора:
- Заряд ионов и : Для небольшого взаимодействия и, следовательно, низкой температуры плавления, и анион, и катион должны быть заряжены только один раз.
- Расстояние между ионами : более крупные ионы приводят к более высоким расстояниям и, следовательно, к более низким температурам плавления.
- Эффективность упаковки ионов, определяемая константой Маделунга : на нее влияет степень асимметрии ионов. Более высокая асимметрия обычно приводит к более низким температурам плавления.
Другими факторами являются ван-дер-ваальсовы взаимодействия , π-π взаимодействия и водородные связи .
Отсюда выводятся тренды, которые, помимо влияния на кулоновские силы, помогают предсказать точку плавления ионной жидкости:
- высокая конформационная гибкость и хиральные центры приводят к более низкой температуре плавления
- менее эффективная упаковка приводит к более низкой температуре плавления
- высокая симметрия приводит к более высокой температуре плавления
- Количество и протяженность водородных связей, причем анионы с высокой тенденцией к образованию водородных связей (CH 3 COO - ), а также анионы, которые не могут образовывать водородные связи ([(CF 3 SO 2 ) N] - ), имеют низкие температуры плавления.
- функциональные группы, такие как Б. Функции эфира приводят к более низким температурам плавления
Электрохимическое окно
Электрохимическое окно ( электрохимическое окно , EW) указывает размер области, в которой вещество не окисляется и не восстанавливается. Он описывает разницу между предельными потенциалами на аноде и катоде:
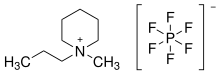
Чем больше электрохимическое окно, тем более устойчиво вещество к окислению и восстановлению. Ионные жидкости характеризуются очень большим электрохимическим окном. Катион в основном отвечает за ограничивающий потенциал восстановления на катоде, а анион - за потенциал окисления на аноде. Гептахлоралюминатный анион Al 2 Cl 7 - исключение . Типичные электрохимические окна находятся в диапазоне от 3 до 6 В. По сравнению с водой, которая имеет относительно небольшое окно 1,2 В, преимущество ионных здесь очевидно. электрохимические приложения. Например, [BMIM] [BF 4 ] имеет электрохимическое окно 4,1 В, [BMIM] [PF 6 ] одно из 4,15 В, а [BMPyrr] [NTf 2 ] имеет окно 5,5 В. Ярким примером является гексафторфосфат 1-метил-1-пропилпиперидиния с электрохимическим окном 7,2 В, которое ограничено катодным потенциалом -3,25 В и потенциалом анода 3,95 В. Однако из-за его температуры плавления 100 ° C он почти не подпадает под определение ионной жидкости. Чтобы можно было полностью использовать большое электрохимическое окно ионных жидкостей, важно синтезировать их как без воды, так и без галогенидов. 3 мас.% Воды уже приводят к падению электрохимического окна [BMIM] [BF 4 ] с 4,1 до 1,95 В.
использовать
В принципе, молекулярное разнообразие ионных жидкостей позволяет использовать их в большом количестве технических областей. Их использование в крупномасштабных процессах показывает их актуальность в химической технологии процессов и реакционной технике . Также известны применения в биотехнологии . Одна из основных областей применения ионных жидкостей - это электролит в топливных элементах, конденсаторах, батареях, красителях солнечных элементов и отделке металлов. Кроме того, в качестве модельных систем для поверхностей раздела электрод-электролит. Другими приложениями являются перенос тепла, использование в качестве охлаждающей жидкости и ионного компрессора, а также в специальных анализах в качестве матричных материалов для свободного пространства ГХ и MALDI-TOF-MS, растворителей для процесса Карла Фишера , сред для кристаллизации белков и электрофореза . При синтезе ионные жидкости могут действовать как катализатор и как растворитель. Охватывается как органический, так и неорганический синтез, а также полимеры и наночастицы.
электролит
Покрасьте солнечные элементы
С помощью солнечных элементов на основе красителей можно использовать более широкий диапазон светового спектра по сравнению с солнечными элементами из кристаллического кремния , что также позволяет использовать рассеянный свет или более низкую интенсивность света. Ионные жидкости можно использовать в качестве нового электролитического материала. Преимущество здесь заключается в их проводимости, которая обеспечивает необходимый перенос заряда. В сочетании со свойствами низкой температуры плавления и очень низкого давления пара может использоваться при температурах от −20 до +80 ° C. Также они обладают высокой электрохимической стабильностью. Одно приложение нацелено на использование этих ячеек, например. Б. в качестве зарядного устройства для мобильных телефонов в регионах без общегосударственного электроснабжения.
Аккумуляторы
Во многих коммерческих литий-ионных аккумуляторах часто используются органические растворители , например. Б. Карбонаты используются в качестве электролита . Однако у них есть ряд недостатков. По сравнению с ионными жидкостями, органические карбонатные растворители обладают ограниченной устойчивостью к окислению при высоких положительных потенциалах (примерно 4,3-4,9 В по сравнению с Li + / Li) в зависимости от используемого электрода. Это приводит к возрастающему разложению электролита с постепенным циклированием при этих потенциалах. Из-за связанной с этим потери эффективности органические растворители подходят только для небольшого потенциального окна. Еще одно преимущество - термическая стабильность и низкая летучесть ионных жидкостей. Между электролитом и другими компонентами батареи могут возникать нежелательные экзотермические реакции из-за местного перегрева или короткого замыкания. Быстро увеличивающаяся температура ячейки может вызвать воспламенение органического растворителя. Основным недостатком использования ионных жидкостей в качестве электролитов является их низкая ионная проводимость, поскольку они имеют низкую плотность заряда и высокие стерические затруднения .
Отделка целлюлозой
Целлюлоза, объем которой составляет около 700 миллиардов тонн, является крупнейшим природным органическим химическим веществом на Земле с точки зрения количества и имеет большое значение как возобновляемое сырье . Из 40 миллиардов тонн, воспроизводимых ежегодно природой, только около 0,2 миллиарда тонн используются в качестве сырья для дальнейшей переработки. Расширенное использование целлюлозы в качестве сырья препятствует отсутствию подходящего растворителя. Робин Роджерс и его коллеги из Университета Алабамы обнаружили, что использование ионных жидкостей может обеспечить получение растворов целлюлозы в технически пригодных концентрациях. Например, при производстве синтетических целлюлозных волокон (например, вискозы ) из так называемой химической целлюлозы различные вспомогательные химические вещества, особенно сероуглерод (CS 2 ), в настоящее время необходимо использовать в больших количествах, а затем перерабатывать или утилизировать. Кроме того, из-за характера процесса необходимо обрабатывать значительные объемы сточных вод. Эти процессы можно упростить за счет использования ионных жидкостей, поскольку они могут использоваться в качестве растворителей и почти полностью рециркулируются. Институт текстильной химии и искусственных волокон (ITCF) в Денкендорфе и BASF совместно исследуют свойства волокон, которые прядут на пилотной установке из целлюлозы, растворенной с помощью ионных жидкостей.
Хорошая растворимость целлюлозы в ионных жидкостях открывает широкие возможности для производства материалов на основе возобновляемого сырья. В одностадийном синтезе целлюлозу можно превратить в 5-гидроксиметилфурфурол (HMF) в присутствии связанных катализаторов хлорид меди (II) / хлорид хрома (II) в растворителе 1-этил-3-метилимидазолийхлорид при 80-120 ° С. ° C - возможный строительный блок для пластмасс на основе биомассы.
Фармацевтические препараты
Более 50% имеющихся в продаже фармацевтических препаратов имеют форму солей. Однако, как правило, только один из ионов имеет органическую природу; наиболее популярными противоионами являются натрий и хлорид. Фармацевтически активные вещества обычно имеют функциональные группы, которые могут превращаться в ионы. Например, амины могут образовывать катионы, кислотные функциональные группы могут образовывать анионы.
Исходя из этого, можно придерживаться двух подходов. Путем объединения двух фармацевтически активных ионов получают продукт, обладающий активностью аниона и катиона. Синергетический эффект между ионами, вызывающий усиление желаемого эффекта, является оптимальным . Другой подход «разжижает» фармацевтически активный ион путем выбора инертного или биосовместимого противоиона. Это позволяет избежать проблем, вызванных полиморфизмом многих солей.
Кроме того, ионные жидкости можно использовать в синтезе лекарств, а также в качестве растворителей, эмульгаторов или систем доставки лекарств .
Уже известны фармацевтически активные ионные жидкости. Разрешены цетилпиридиния хлорид , антисептик и бретилий , антиаритмическое средство .
биотехнология
Ионные жидкости расширяют репертуар биотрансформаций, поскольку в них также могут протекать водочувствительные реакции. Группа Роджера А. Шелдона провела новаторскую работу по биотрансформации в ионных жидкостях в 2000 году посредством катализируемых липазой реакций алкоголиза , аммонолиза и пергидролиза. Кандида Antarctica липаза В (CALB) был использован в ионных жидкостях [BMIM] [PF 6 ] и [BMIM] [BF 4 ] . С тех пор во многих процессах была показана высокая селективность и активность ферментов в ионных жидкостях. Кроме того, ионные жидкости также могут влиять на стабильность, энантиоселективность и каталитическую активность. Классы ферментов, активных в ионных жидкостях, включают протеазы , липазы, эстеразы , гликозидазы и оксидоредуктазы . Для преобразований можно использовать как однофазную, так и двухфазную систему. Помимо ферментов, также можно использовать целые клетки. Для использования в двухфазной системе с водой фермент может быть иммобилизован в ионной жидкости. Изменяя растворимость ионной жидкости, можно также использовать смеси с водой.
Крупномасштабные приложения
2,5-дигидрофуран
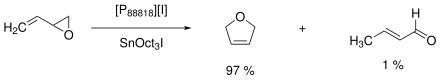
Первым крупномасштабным применением ионной жидкости был процесс изомеризации от Eastman Chemical . Процесс проходил с 1996 по 2004 год с производительностью до 1400 тонн в год . Это был 2,5-дигидрофуран из бутена, 3,4-эпокси-1, полученный основным Льюисом, в качестве катализатора служил йодид триоктилолова в качестве кислоты Льюиса и ионная жидкость на основе тетраалкилфосфония ([P 88818 ] [I]). В непрерывном процессе каталитическая смесь может быть отделена от продукта и переработана. Получаются как побочные продукты кротоновый альдегид (1%) и олигомеры (2%).
БАЗИЛИЙСКИЙ процесс
В случае метилимидазолия хлорида компания BASF использует ионную жидкость в процессе BASIL ( удаление двухфазной кислоты с использованием ионных жидкостей ). В этом случае 1-метилимидазол используют в качестве вспомогательного основания для нейтрализации образующейся соляной кислоты. В процессе образуется ионная жидкость, которая выделяется как вторая фаза и, таким образом, может быть легко отделена. Производительность процесса может быть увеличена в 80 000 раз. Ранее вместо метилимидазола добавляли третичный амин, но он образовывал соль с соляной кислотой, которую было трудно отделить. Диэтоксифенилфосфин получают в процессе BASIL.
ISOALKY процесс
Процесс ISOALKY используется для производства алкилата, который используется в топливе из-за его высокого октанового числа. Ионная жидкость заменяет обычные кислотные катализаторы серную кислоту и плавиковую кислоту . Ионные жидкости представляют собой хлоридную соль, к которой добавлены трихлорид алюминия и небольшое количество хлористого водорода . Так образуется каталитически активная суперкислота . Точный состав не разглашается. Катионы представляют собой запатентованные структуры пиридиния и имидазолия . Возможным катализатором может быть, например, B. Тетрахлоралюминат 1-бутил-3-метилимидазолия , который может быть получен из хлорида 1-бутил-3-метилимидазолия и трихлорида алюминия.
Ионные компрессоры
Ионные компрессоры - это компрессоры прямого вытеснения, основной областью применения которых является сжатие водорода. Ионные жидкости заменяют неподвижный поршень, что означает необходимость использования меньшего количества движущихся частей, что в конечном итоге приводит к экономии энергии. Кроме того, конструкция компрессора упрощена из-за низкой растворимости водорода в используемых ионных жидкостях. Linde Group является пионером в этой области , и был в состоянии спроектировать ионный компрессор , который достигает давления между 45 и 90 МП и емкостью 8-30 кг · ч -1 . В частности, в этой области исследуются ионные жидкости на основе имидазолия.
Энергетические ионные жидкости
Энергетические ионные жидкости (ЭИЖ) рассматриваются как альтернатива топливу и взрывчатым веществам. Объединяются высокоэнергетические анионы и катионы. В высокоэнергетических ионных жидкостях в качестве катионов используются соединения имидазолия, триазолия, тетразолия и четвертичного аммония, например азиды, третразолаты, пикраты, нитраты или азолаты в качестве анионов. Гиперголические ионные жидкости содержат z. B. дицианамид, нитроцианамид, комплексные анионы алюминия, гипофосфит и ионы на основе бора, особенно те, которые богаты связями BH. Первые ионные жидкости с гиперголическими свойствами были опубликованы в 2008 году. Для этого использовали анионы дицианамида.
Экологический баланс и токсикология
Ионные жидкости часто называют «зеленой» альтернативой органическим растворителям. В основном это связано с их высокой термической стабильностью и низким давлением пара. В результате они не могут попасть в атмосферу, где образуют смог, атакуют озоновый слой и способствуют изменению климата. Также исключено воздействие на человека и окружающую среду через воздух. Еще одна опасность, которую представляют органические растворители, - образование взрывоопасных смесей воздуха. Этого риска для безопасности нет и с ионными жидкостями.
Хотя испарение ионных жидкостей представляет небольшую опасность, необходимо учитывать растворимость в воде и, следовательно, ее загрязнение, поэтому долгосрочное воздействие ионных жидкостей на окружающую среду все еще исследуется. Токсикология ионных жидкостей также все чаще исследуется. Особое внимание уделяется водным организмам, но также были исследованы микроорганизмы, нематода Caenorhabditis elegans , улитка с кончиками мочевого пузыря ( Physella acuta ), крысы и рыбки данио ( Danio rerio ). Отсутствие фоторазлагаемых ионных жидкостей на основе имидазолия означает, что они могут накапливаться в водоемах, поскольку их способность к биологическому разложению также очень низкая. Системные исследования были проведены, например, Б. выступил на дафнии . Можно было заметить, что более длинные алкильные цепи в катионе приводят к более высокой токсичности. Эта тенденция была обнаружена для ионных жидкостей имидазолия, пиридиния, аммония и фосфония. Воздействие анионов на дафний не имеет четкой тенденции, но по сравнению с натриевой солью соответствующего аниона ионная жидкость всегда более токсична. Бактерия Lactobacillus проявляет меньшую активность в производстве молочной кислоты в присутствии ионных жидкостей [BMIM] [PF 6 ] , [HMIM] [PF 6 ] и [OMIM] [PF 6 ] . Здесь также можно увидеть тенденцию к тому, что более длинные алкильные цепи имеют большее отрицательное влияние.
Ионные жидкости, содержащие галогены, также вредны для окружающей среды, как и галогенированные органические вещества, поскольку они существуют в окружающей среде в течение длительного времени и за счет небольшого количества энергии (свет, тепло, ферменты и т. Д.) Образуют реактивные промежуточные стадии, такие как радикалы, которые можно найти как в атмосфере, так и в телах, одинаково вредны. Даже если нет риска ингаляционного отравления из-за нелетучести соединений, сточные воды могут быть проблематичными. Однако из-за большого количества возможных комбинаций ожидается достижение желаемых физико-химических свойств с минимально возможной токсичностью в среднесрочной перспективе.
веб ссылки
литература
- Томас Вальдманн, Синь-Хуэй Хуанг, Гарри Э. Хостер, Оливер Хёффт, Франк Эндрес, Р. Юрген Бем: визуализация адсорбционного слоя ионной жидкости с помощью сканирующей туннельной микроскопии на границе твердое тело | вакуум. В кн . : ChemPhysChem. 12, 2011, стр. 2565-2567, DOI : 10.1002 / cphc.201100413 . (Адсорбированные монослои ионной жидкости, полученные с помощью сканирующего туннельного микроскопа)
- Граница раздела жидкость / твердое тело ультратонких пленок ионной жидкости. В: Langmuir . 27, 2011, стр. 3662-3671, DOI : 10.1021 / la105007c .
Индивидуальные доказательства
- ↑ Кристофер П. Фредлейк, Джейкоб М. Кростуэйт, Дэниел Г. Херт, Судхир Н.В.К. Аки, Джоан Ф. Бреннеке: Теплофизические свойства ионных жидкостей на основе имидазолия . В: Journal of Chemical & Engineering Data . Лента 49 , нет. 4 , июль 2004 г., ISSN 0021-9568 , стр. 954-964 , DOI : 10.1021 / je034261a .
- ^ Даниэль, Клаус., Безенхард, Юрген О.: Справочник материалов для батарей . 2-й, полностью перераб. и дополненное издание. Wiley-VCH Verlag, Weinheim 2011, ISBN 978-3-527-63720-1 .
- ↑ a b c Ана П. М. Таварес, Оскар Родригес, Юджиния А. Маседо: Новые поколения ионных жидкостей, применяемые для ферментативного биокатализа . В: Ионные жидкости - новые перспективы будущего . InTech, 2013, ISBN 978-953-510-937-2 , DOI : 10,5772 / 51897 .
- ^ А б Уильям Рамзи: XXXIV. О пиколине и его производных . В: Лондонский, Эдинбургский и Дублинский философский журнал и научный журнал . Лента 2 , вып. 11 октября 1876 г., ISSN 1941-5982 , с. 269-281 , DOI : 10,1080 / 14786447608639105 .
- ↑ а б в г Пол. Муррилл : ГАЛИДЫ И ПЕРГАЛИДЫ ПИКОЛИН. В: Журнал Американского химического общества . Лента 21 , нет. 10 октября 1899 г., ISSN 0002-7863 , стр. 828-854 , DOI : 10.1021 / ja02060a002 .
- ↑ Герхард Лаус, Джино Бентивольо, Хервиг Шоттенбергер, Фолькер Каленберг, Хольге Копака, Томас Рёдер, Герберт Сикста: Ионные жидкости: текущие разработки, потенциал и недостатки для промышленного применения . В: Репортаж Ленцингера . Лента 84 , 2005, стр. 71-85 .
- ↑ a b c d Юлиуш Пернак, Томаш Рземенецкий, Катаржина Матерна: Ионные жидкости «в двух словах» (история, свойства и развитие) . В кн . : ХИМИЯ . Лента 70 , нет. 9 , 2016, стр. 471-480 .
- ^ A b c d Джон С. Уилкс: Краткая история ионных жидкостей - от расплавленных солей до неотерических растворителей . В кн . : Зеленая химия . Лента 4 , вып. 2 , 16 апреля 2002 г., с. 73-80 , DOI : 10.1039 / b110838g .
- ↑ Friedel, C .; Crafts, JM (1877) "Sur une nouvelle méthode générale de synthèse d'hydrocarbures, d'acétones, и т. Д." Compt. Ренд. , 84 : 1392 и 1450 .
- ^ С. Габриэль, Дж. Вайнер: О виниламине и бромэтиламине . В: Отчеты Немецкого химического общества . Лента 21 , нет. 2 , июль 1888 г., стр. 2664-2669 , DOI : 10.1002 / cber.18880210287 .
- ↑ Том Велтон: Ионные жидкости: краткая история . В: Биофизические обзоры . Лента 10 , вып. 3 , июнь 2018, ISSN 1867-2450 , стр. 691-706 , DOI : 10.1007 / s12551-018-0419-2 , PMID 29700779 , PMC 5988633 (бесплатно полный текст).
- ↑ а б Уолден П. В: Бюл. Акад. Sci. Санкт-Петербург . 1914, с. 405-422.
- ↑ Сэмюэл Сагден, Генри Уилкинс: CLXVII - Паракор и химическая конституция. Часть XII. Плавленые металлы и соли . В: J. Chem. Soc. Лента 0 , нет. 0 , 1929, ISSN 0368-1769 , с. 1291-1298 , DOI : 10.1039 / JR9290001291 .
- ^ А б Фрэнк Х. Херли, Томас П. Виер: Электроосаждение металлов из плавленых солей четвертичного аммония . В: Журнал Электрохимического общества . Лента 98 , нет. 5 , 1951, стр. 203 , DOI : 10,1149 / 1,2778132 .
- ↑ Джон Т. Йок, Джозеф Ф. Вайс, Гордон Толлин: Реакции триэтиламина с галогенидами меди (I) и меди (II) . В кн . : Неорганическая химия . Лента 2 , вып. 6 декабря 1963 г., ISSN 0020-1669 , стр. 1210-1216 , DOI : 10.1021 / ic50010a028 .
- ^ Натан Корнблюм, Джеральд П. Коффи: Реакция фторбората триэтилоксония с натриевой солью α-пиридона 1 . В: Журнал органической химии . Лента 31 , нет. 10 октября 1966 г., ISSN 0022-3263 , с. 3449-3451 , DOI : 10.1021 / jo01348a536 .
- ↑ Джордж У. Паршалл: Катализ в расплавленных солевых средах . В: Журнал Американского химического общества . Лента 94 , нет. 25 декабря 1972 г., ISSN 0002-7863 , стр. 8716-8719 , DOI : 10.1021 / ja00780a013 .
- ↑ a b Майкл Фримантл: Введение в ионные жидкости . RSC Pub, Кембридж, Великобритания, 2010 г., ISBN 978-1-84755-161-0 , стр. 8-10 .
- ^ RJ Gale, B. Gilbert, RA Osteryoung: Рамановские спектры расплавленных систем хлорида алюминия: 1-бутилпиридиния хлорида при температуре окружающей среды . В кн . : Неорганическая химия . Лента 17 , нет. 10 , 1 октября 1978 г., ISSN 0020-1669 , с. 2728-2729 , DOI : 10.1021 / ic50188a008 .
- ↑ Патент US4122245A : Электролиты хлорида AlCl3 / 1- алкилпиридиния при комнатной температуре. Опубликовано 24 октября 1978 г. Изобретатели: Джон К. Нарди, Чарльз Л. Хасси, Лоуэлл А. Кинг.
- ↑ Джон С. Уилкс, Джозеф А. Левиски, Роберт А. Уилсон, Чарльз Л. Хасси: Расплавы хлоралюмината диалкилимидазолия: новый класс ионных жидкостей при комнатной температуре для электрохимии, спектроскопии и синтеза . В кн . : Неорганическая химия . Лента 21 , нет. 3 , март 1982 г., ISSN 0020-1669 , стр. 1263-1264 , DOI : 10.1021 / ic00133a078 .
- ↑ Towner B. Scheffler, Charles L. Hussey, Kenneth R. Seddon, Christopher M. Kear, Phillip D. Armitage: Хлорокомплексы молибдена в хлоралюминатных ионных жидкостях при комнатной температуре: стабилизация гексахлормолибдата (2-) и гексахлормолибдата (3-) . В кн . : Неорганическая химия . Лента 22 , нет. 15 июля 1983 г., ISSN 0020-1669 , стр. 2099-2100 , DOI : 10.1021 / ic00157a001 .
- ^ Слэтон Э. Фрай, Норберт Дж. Пиента: Влияние расплавленных солей на реакции. Нуклеофильное ароматическое замещение галогенид-ионами в расплавленных солях додецилтрибутилфосфония . В: Журнал Американского химического общества . Лента 107 , нет. 22 октября 1985 г., ISSN 0002-7863 , стр. 6399-6400 , DOI : 10.1021 / ja00308a045 .
- ↑ Джеффри А. Бун, Джозеф А. Левиски, Дж. Ллойд Пфлуг, Джон С. Уилкс: реакции Фриделя-Крафтса в расплавленных солях при температуре окружающей среды . В: Журнал органической химии . Лента 51 , нет. 4 , февраль 1986 г., ISSN 0022-3263 , стр. 480-483 , DOI : 10.1021 / jo00354a013 .
- ^ A b Джон С. Уилкс, Майкл Дж. Заворотко: Ионные жидкости на основе 1-этил-3-метилимидазолия, устойчивые к воздуху и воде . В: Журнал химического общества, химические коммуникации . Нет. 13 , 1992, ISSN 0022-4936 , стр. 965 , DOI : 10.1039 / c39920000965 .
- ↑ Пьер Бонхот, Ана-Паула Диас, Николас Папагеоргиу, Куппусвами Кальянасундарам, Майкл Гретцель: гидрофобные, высокопроводящие расплавленные соли при температуре окружающей среды † . В кн . : Неорганическая химия . Лента 35 , нет. 5 , январь 1996 г., ISSN 0020-1669 , стр. 1168-1178 , DOI : 10.1021 / ic951325x .
- ↑ б с д е е G. Wytze Meindersma, Matthias Мааса, Андре Б. De Haan: Ионные жидкости . В: Энциклопедия промышленной химии Ульмана . Wiley-VCH Verlag GmbH & Co. KGaA, Вайнхайм, Германия 2007, ISBN 978-3-527-30673-2 , стр. 547-575 , DOI : 10.1002 / 14356007.l14_l01 .
- ^ A b c d Питер Вассершайд, Вильгельм Кейм: Ионные жидкости - новые «решения» для катализа переходных металлов . В: Angewandte Chemie International Edition . Лента 39 , нет. 21 , 2000, ISSN 1521-3773 , с. 3772-3789 , DOI : 10.1002 / 1521-3773 (20001103) 39: 213.0.CO; 2-5 .
- ↑ a b c d e Питер Вассершайд, Т. Велтон: Ионные жидкости в синтезе . Wiley-VCH, Weinheim 2003, ISBN 3-527-60544-4 , стр. 7-21 .
- ↑ Технический паспорт 1-бутил-3-метилимидазолийхлорид (PDF) от Карла Рота , по состоянию на 21 марта 2021 г.
- ^ Джоан Фуллер, Ричард Т. Карлин, Хью К. Де Лонг, Дастин Хаворт: Структура гексафторфосфата 1-этил-3-метилимидазолия: модель для расплавленных солей при комнатной температуре . В: Журнал химического общества, химические коммуникации . Нет. 3 , 1994, ISSN 0022-4936 , стр. 299 , DOI : 10.1039 / c39940000299 .
- ↑ б Тамар Л. Гривз, Калум Дж Драммонд: Протич Ионные жидкости: свойства и применение . В: Химические обзоры . Лента 108 , нет. 1 , январь 2008 г., ISSN 0009-2665 , стр. 206-237 , DOI : 10.1021 / cr068040u .
- ^ A b c d Адам Дж. Грир, Йохан Жакмен, Кристофер Хардакр: Промышленное применение ионных жидкостей . В кн . : Молекулы . Лента 25 , нет. 21 , 9 ноября 2020 г., ISSN 1420-3049 , стр. 5207 , DOI : 10,3390 / molecules25215207 , PMID 33182328 , PMC 7664896 (бесплатно полный текст).
- ^ Пол Нанкарроу, Ханин Мохаммед: Ионные жидкости в космической технологии - текущие и будущие тенденции . В: ChemBioEng Reviews . Лента 4 , вып. 2 , апрель 2017, стр. 106-119 , DOI : 10.1002 / cben.201600021 .
- ↑ Цинхуа Чжан, Жанна М. Шрив: Энергетические ионные жидкости в качестве взрывчатых веществ и горючего: новое путешествие в химии ионных жидкостей . В: Химические обзоры . Лента 114 , нет. 20 , 22 октября 2014 г., ISSN 0009-2665 , стр. 10527-10574 , DOI : 10.1021 / cr500364t .
- ↑ Масаёси Ватанабэ, Морган Л. Томас, Шигуо Чжан, Кадзухидэ Уэно, Томохиро Ясуда: Применение ионных жидкостей в материалах и устройствах для хранения и преобразования энергии . В: Химические обзоры . Лента 117 , нет. 10 , 24 мая 2017 г., ISSN 0009-2665 , стр. 7190-7239 , DOI : 10.1021 / acs.chemrev.6b00504 .
- ↑ Янсонг Чжао, Тобиас Бостром: Применение ионных жидкостей в солнечных элементах и батареях: обзор . В кн . : Современная органическая химия . Лента 19 , нет. 6 , 17 апреля 2015 г., стр. 556-566 , DOI : 10,2174 / 1385272819666150127002529 .
- ↑ a b c Питер Вассершайд, Т. Велтон: Ионные жидкости в синтезе . Wiley-VCH, Weinheim 2003, ISBN 3-527-60544-4 , стр. 41-55 .
- ↑ a b Памела М. Дин, Дженнифер М. Прингл, Дуглас Р. Макфарлейн: Структурный анализ низкоплавких органических солей: перспективы ионных жидкостей . В кн . : Физическая химия Химическая физика . Лента 12 , вып. 32 , 2010, ISSN 1463-9076 , с. 9144 , DOI : 10.1039 / c003519j .
- ↑ a b c Шанкаран Муругесан, Оливер А. Кинтеро, Брендан П. Чоу, Пэнхао Сяо, Кюсунг Парк: ионная соль с широким электрохимическим окном для использования в электроосаждении электроположительных металлов и твердотельных литий-ионных батареях . В: J. Mater. Chem. , . Лента 2 , вып. 7 , 2014, ISSN 2050-7488 , стр. 2194-2201 , DOI : 10.1039 / C3TA15010K .
- ↑ a b c Питер Вассершайд, Т. Велтон: Ионные жидкости в синтезе . Wiley-VCH, Weinheim 2003, ISBN 3-527-60544-4 , стр. 103-126 .
- ↑ a b Фред ван Рантвейк, Роджер А. Шелдон: Биокатализ в ионных жидкостях . В: Химические обзоры . Лента 107 , нет. 6 июня 2007 г., ISSN 0009-2665 , стр. 2757-2785 , DOI : 10.1021 / cr050946x .
- ↑ a b Кристоф Роозен, Пиа Мюллер, Лассе Грайнер: Ионные жидкости в биотехнологии: приложения и перспективы биотрансформации . В кн . : Прикладная микробиология и биотехнология . Лента 81 , нет. 4 , декабрь 2008 г., ISSN 0175-7598 , стр. 607-614 , DOI : 10.1007 / s00253-008-1730-9 , PMID 18979095 , PMC 7419490 (бесплатно полный текст).
- ↑ Томас Вальдманн, Синь-Хуэй Хуанг, Гарри Э. Хостер, Оливер Хёффт, Фрэнк Эндрес: Визуализация ионного жидкого адслоя с помощью сканирующей туннельной микроскопии на границе твердое тело | вакуум . В кн . : ChemPhysChem . Лента 12 , вып. 14 , 4 октября 2011 г., стр. 2565-2567 , DOI : 10.1002 / cphc.201100413 .
- ↑ Мартина Б. Ханель, Андреас Фильцвизер, Ирис Фильцвизер, Стефан Рухс : ILTEC - РЕВОЛЮЦИОННОЕ РЕШЕНИЕ ПО ОХЛАЖДЕНИЮ ДЛЯ МЕТАЛЛИЧЕСКОЙ ПРОМЫШЛЕННОСТИ. Проверено 9 апреля 2019 года .
- ↑ а б У. Вагт: Ионные жидкости - уникальные материалы с разнообразными возможностями. В: CHEManager. 22/2008, с. 19.
- ↑ Ву Сюй, Xilin Чен, Фэй Дин, Джи Сяо, Deyu Ван: повторное расследование на состоянии из самых современных неводных электролитов карбоната для 5 V применений литий-ионных батарей . В: Журнал источников энергии . Лента 213 , сентябрь 2012 г., стр. 304-316 , DOI : 10.1016 / j.jpowsour.2012.04.031 .
- ↑ Мишель Арман , Фрэнк Эндрес , Дуглас Р. Макфарлейн, Хироюки Оно, Бруно Скросати: Ионно-жидкие материалы для электрохимических задач будущего . В кн . : Материалы природы . Лента 8 , вып. 8 августа 2009 г., ISSN 1476-1122 , с. 621-629 , DOI : 10.1038 / nmat2448 .
- ↑ А. Герфи, М. Донтиньи, П. Шарест, М. Петитклерк, М. Лагасе: Улучшенные электролиты для литий-ионных батарей: смеси ионной жидкости и органического электролита с повышенной безопасностью и электрохимическими характеристиками . В: Журнал источников энергии . Лента 195 , нет. 3 , февраль 2010 г., стр. 845-852 , DOI : 10.1016 / j.jpowsour.2009.08.056 .
- ↑ Ричард П. Сватлоски, Скотт К. Спир, Джон Д. Холбри, Робин Д. Роджерс: Растворение целлюлозы ионными жидкостями . В: Журнал Американского химического общества . Лента 124/18 , 2002, стр. 4974-4975 , DOI : 10.1021 / ja025790m .
- ↑ Хао Чжан, Цзинь Ву, Цзюнь Чжан, Цзясонг Хэ: 1-Аллил-3-метилимидазолий хлорид , ионная жидкость комнатной температуры: новый и мощный недериватизирующий растворитель для целлюлозы . В кн . : Макромолекулы . Лента 38 , 2005, с. 8272-8277 , DOI : 10.1021 / ma0505676 .
- ↑ Бинь Чжао, Лассе Грейнер, Вальтер Лейтнер: Растворимость целлюлозы в ионных жидкостях на основе карбоксилатов . В кн . : RSC Advances . Лента 2 , 2012, с. 2476-2479 , DOI : 10.1039 / C2RA01224C .
- ↑ Франк Херманутц, Франк Гер, Клеменс Массон, Эрик Юрдинген: Устная презентация на 45-й конференции по искусственному волокну . Дорнбирн, Австрия, 20-22 сентября 2006 г.
- ^ Y. Su, HM Brown, X. Huang, X. Zhou, JE Amonette, ZC Zhang: Одностадийное преобразование целлюлозы в 5-гидроксиметилфурфурол (HMF), универсальный химический платформенный химикат. В: Прил. Катализ . А 361, 2009 г., стр. 117-122. DOI: 10.1016 / j.apcata.2009.04.002
- ^ Форум: Chem. Ing. Tech. 6/2009 . В: Инженер-химик Технология . Лента 81 , нет. 6 , 2009, ISSN 1522-2640 , с. 679 , DOI : 10.1002 / cite.200990045 .
- ↑ а б в И. Марручо, Л. К. Бранко, LPN Ребело: Ионные жидкости в фармацевтических приложениях . В: Ежегодный обзор химической и биомолекулярной инженерии . Лента 5 , вып. 1 , 7 июня 2014 г., ISSN 1947-5438 , стр. 527-546 , DOI : 10,1146 / annurev-chembioeng-060713-040024 .
- ↑ Елена Стойменовски, Дуглас Р. Макфарлейн, Катарина Бика, Робин Д. Роджерс: Кристаллические и ионные жидкие солевые формы активных фармацевтических ингредиентов: документ с изложением позиции . В кн . : Фармацевтические исследования . Лента 27 , нет. 4 , апрель 2010 г., ISSN 0724-8741 , стр. 521-526 , DOI : 10.1007 / s11095-009-0030-0 .
- ^ А б Сония Н. Педро, Кармен С. Р. Фрейре, Армандо Дж. Д. Сильвестр, Мара Г. Фрейре: Роль ионных жидкостей в фармацевтической области: Обзор соответствующих приложений . В: Международный журнал молекулярных наук . Лента 21 , нет. 21 , 5 ноября 2020 г., ISSN 1422-0067 , стр. 8298 , doi : 10.3390 / ijms21218298 , PMID 33167474 , PMC 7663996 (полный текст).
- ^ Уитни Л. Хаф, Марчин Смиглак, Эктор Родригес, Ричард П. Сватлоски, Скотт К. Спир: Третья эволюция ионных жидкостей: активные фармацевтические ингредиенты . В: Новый химический журнал . Лента 31 , нет. 8 , 27 июля 2007 г., ISSN 1369-9261 , с. 1429-1436 , DOI : 10.1039 / B706677P .
- ↑ Дж. Стойменовски, Д. Р. Макфарлейн, К. Бика, Р. Д. Роджерс: Кристаллические и ионные жидкие солевые формы активных фармацевтических ингредиентов: документ с изложением позиции . В кн . : Фармацевтические исследования . Лента 27 , 2010, стр. 521-526 , DOI : 10.1007 / s11095-009-0030-0 .
- ↑ a b c d Кэролайн Эмили Пол, Висенте Готор Фернандес: Биокатализ и биотрансформация в ионных жидкостях . В: Ионные жидкости в обработке и анализе липидов . Elsevier, 2016, ISBN 978-1-63067-047-4 , стр. 11-58 , DOI : 10.1016 / b978-1-63067-047-4.00002-7 .
- ^ Р. Мадейра Лау, Ф. Ван Рантвейк, К. Р. Седдон, Р. А. Шелдон: Катализируемые липазой реакции в ионных жидкостях . В кн . : Органические письма . Лента 2 , вып. 26 декабря 2000 г., ISSN 1523-7060 , с. 4189-4191 , DOI : 10.1021 / ol006732d .
- ↑ Эдуардо Гарсия-Вердуго, Белен Альтава, М. Изабель Бургете, Педро Лозано, С.В. Луис: Ионные жидкости и процессы с непрерывным потоком: хорошее сочетание для разработки устойчивых процессов . В кн . : Зеленая химия . Лента 17 , нет. 5 , 2015, ISSN 1463-9262 , с. 2693-2713 , DOI : 10.1039 / C4GC02388A .
- ↑ Том Велтон: Растворители и устойчивая химия . В: Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences . Лента 471 , нет. 2183 , 8 ноября 2015 г., ISSN 1364-5021 , стр. 20150502 , doi : 10.1098 / rspa.2015.0502 , PMID 26730217 , PMC 4685879 (полный текст) - (английский).
- ↑ Патент US7432409B2 : Процесс алкилирования с использованием хлоралюминатных ионных жидких катализаторов. Опубликовано 21 декабря 2004 г. Изобретатели: С. Эломари, С. Трамбал, HKC Timken, Р. Клевердон.
- ↑ Хе Гён Тимкен, Хупинг Луо, Бонг-Гю Чанг, Элизабет Картер, Мэтью Коул: Технология ISOALKY ™ : Технология производства бензина алкилатов нового поколения с использованием ионно-жидкого катализатора . В: Коммерческое применение ионных жидкостей . Springer International Publishing, Cham 2020, ISBN 978-3-03035244-8 , стр. 33-47 , DOI : 10.1007 / 978-3-030-35245-5_2 .
- ↑ а б Цзексинь Цзоу, Нин Хан, Цзянъянь Ян, Ци Фэн, Яцзюнь Ван: Технологии электрохимического сжатия водорода высокого давления: текущее состояние, проблемы и перспективы . В: Обзоры электрохимической энергии . Лента 3 , вып. 4 декабря 2020 г., ISSN 2520-8489 , стр. 690-729 , DOI : 10.1007 / s41918-020-00077-0 .
- ↑ Марзена Дзида, Малгожата Мусял, Эдвард Зорембски, Сильвия Енжак, Юстина Сковронек: Сравнительное исследование теплофизических свойств при высоком давлении 1-этил-3-метилимидазолия и 1,3-диэтилимидазолия этилсульфатов для эффективного использования в качестве устойчивых гидравлических флюидов . В: ACS Sustainable Chemistry & Engineering . Лента 6 , вып. 8 , 6 августа 2018 г., ISSN 2168-0485 , стр. 10934-10943 , DOI : 10.1021 / acssuschemeng.8b02318 .
- ↑ Насрин Арджоманд Кермани, Ирина Петрушина, Алексей Никифоров, Йенс Олуф Йенсен, Масуд Рокни: Коррозионные свойства конструкционных материалов для ионно-жидкого водородного компрессора . В: Международный журнал водородной энергетики . Лента 41 , нет. 38 , октябрь 2016 г., стр. 16688-16695 , DOI : 10.1016 / j.ijhydene.2016.06.221 .
- ↑ Цю-Хань Линь, Ю-Чуан Ли, Я-Ю Ли, Чжу Ван, Вэй Лю: Энергетические соли на основе 1-амино-1,2,3-триазола и 3-метил-1-амино-1,2, 3-триазолы . В кн . : Журнал химии материалов . Лента 22 , нет. 2 , 8 декабря 2011 г., ISSN 1364-5501 , с. 666-674 , DOI : 10.1039 / C1JM14322K .
- ↑ Цинхуа Чжан, Жанна М. Шрив: Энергетические ионные жидкости в качестве взрывчатых веществ и горючего: новое путешествие в химии ионных жидкостей . В: Химические обзоры . Лента 114 , нет. 20 , 22 октября 2014 г., ISSN 0009-2665 , стр. 10527-10574 , DOI : 10.1021 / cr500364t .
- ↑ Стефан Шнайдер, Том Хокинс, Йонис Ахмед, Стефан Деплэйз, Джефф Миллс: Ионное жидкое топливо для химической тяги . В: Серия симпозиумов ACS . Лента 1117 . Американское химическое общество, Вашингтон, округ Колумбия, 2012 г., ISBN 978-0-8412-2763-7 , стр. 1-25 , DOI : 10.1021 / Б.К.-2012-1117.ch001 .
- ↑ Стефан Шнайдер, Томми Хокинс, Майкл Розандер, Ганшьям Вагджиани, Стивен Шамбро: Ионные жидкости как гиперголическое топливо . В: Энергия и топливо . Лента 22 , нет. 4 , 1 июля 2008 г., ISSN 0887-0624 , стр. 2871-2872 , DOI : 10.1021 / ef800286b .
- ↑ a b c Иоланта Флигер, Михал Флигер: Токсичность ионных жидкостей - преимущества и опасности . В: Международный журнал молекулярных наук . Лента 21 , нет. 17 , 29 августа 2020 г., ISSN 1422-0067 , стр. 6267 , DOI : 10,3390 / ijms21176267 , PMID 32872533 , PMC 7504185 (бесплатно полный текст).
- ↑ а б в г Дунбинь Чжао, Юнчэн Ляо, Цзидин Чжан: Токсичность ионных жидкостей . В: CLEAN - почва, воздух, вода . Лента 35 , нет. 1 , февраль 2007 г., стр. 42-48 , DOI : 10.1002 / clen.200600015 .
- ↑ Н. Гэзергуд, П.Дж. Скаммеллс: Разработка и приготовление ионных жидкостей при комнатной температуре, содержащих биоразлагаемые боковые цепи . В: Австралийский химический журнал . Лента 55 , нет. 9 , 2002, ISSN 0004-9425 , с. 557 , DOI : 10,1071 / CH02148 .
- ↑ Эндрю С. Уэллс, Вивиан Т. Кумб: О пресноводной экотоксичности и свойствах биоразложения некоторых распространенных ионных жидкостей . В: Исследования и разработки органических процессов . Лента 10 , вып. 4 , июль 2006 г., ISSN 1083-6160 , с. 794-798 , DOI : 10.1021 / op060048i .
- ^ Влияние взаимодействия минералов-органических-микроорганизмов на почву и пресноводную среду . Springer США, Бостон, Массачусетс, 1999, ISBN 978-1-4613-7120-5 , DOI : 10.1007 / 978-1-4615-4683-2 .
- ↑ Мичиаки Мацумото, Кенджи Мочидуки, Кей Фукуниси, Кадзуо Кондо: Экстракция органических кислот с использованием ионных жидкостей на основе имидазолия и их токсичность для Lactobacillus rhamnosus . В кн .: Технология разделения и очистки . Лента 40 , нет. 1 , ноябрь 2004 г., стр. 97-101 , DOI : 10.1016 / j.seppur.2004.01.009 .
- ↑ Ян К. Кушнероу: Использование ионных жидкостей в качестве катализатора в гомогенной реакционной дистилляции с учетом кинетических аспектов реакции . ГРИН Верлаг, 2011, ISBN 978-3-640-94255-8 , стр. 14 ( ограниченный предварительный просмотр в поиске Google Книг).
- ↑ Тхи Фуонг Туи Фам, Чул-Вунг Чо, Йонг-Сан Юн: Судьба и токсичность ионных жидкостей в окружающей среде: обзор. В: Исследования воды. 44, 2010 г., стр. 352, DOI: 10.1016 / j.watres.2009.09.030 .
- ^ Sónia PM Ventura, Carolina S. Marques, Andreia A. Rosatella, Carlos AM Afonso, Fernando Gonçalves: Оценка токсичности различных семейств ионных жидкостей по отношению к морским бактериям Vibrio fischeri . В кн . : Экотоксикология и экологическая безопасность . Лента 76 , февраль 2012 г., стр. 162-168 , DOI : 10.1016 / j.ecoenv.2011.10.006 .