Инфекционный перитонит кошек
В кошачьего инфекционного перитонита ( FIP ) является побочным кошачий коронавирус индуцированное инфекционное заболевание , единственные кошки (Felidae) атаки. Название происходит от наиболее частого клинического проявления - перитонита ( перитонит от). Однако может быть поражена только плевра , поэтому название кошачий инфекционный полисерозит используется редко . Кроме того, клиническая картина может быть без вовлечения серозной оболочки.(Выстилка полостей тела). Заболевание встречается во всем мире. Если есть клиническое проявление заболевания, оно обычно заканчивается летальным исходом. С 2016 и 2018 годов, соответственно, есть два новых экспериментальных активных вещества (GC376 и GS-441524), которые успешно использовались в нескольких исследованиях для лечения FIP. Поскольку эти активные ингредиенты не одобрены в ЕС, их импорт является уголовным преступлением в соответствии с разделом 96 № 4 AMG .
Причина и эпидемиология
Причина FIP - высоковирулентный коронавирус . Вирус, теперь известный как коронавирус кошек ( FCoV ), к концу 1990-х годов был разделен на два разных вируса: менее патогенный, так называемый « энтеральный коронавирус кошек » (FECV), и высокопатогенный « вирус инфекционного перитонита кошек ». (FIPV). Последний является только мутацией «FECV» у животного-носителя. Оба в настоящее время классифицируются как подтип или изолят вируса вида Alphacoronavirus 1 . FIPV имеет антигенетическое родство с человеческим коронавирусом 229E и коронавирусами свиней и собак. Это не связано с человеческим коронавирусом OC43 и коронавирусами крупного рогатого скота и мышей.
Мутация заключается в делеции вирусного гена 3C, которая, однако, не всегда происходит в одном и том же месте. Этому изменению способствует неточная работа вирусной РНК-полимеразы , которая приводит к одному неправильно встроенному нуклеотиду на 1000–10 000 нуклеотидов во время репликации . При общей длине вирусной РНК около 30 000 нуклеотидов три мутации в генетическом материале вируса на репликацию являются «нормальными».
FCoV встречается во всем мире, но только у 5–10 процентов серопозитивных (инфицированных) домашних кошек развивается инфекционный инфекционный перитонит кошек . По отношению ко всей популяции кошек частота ( распространенность ) инфекционного перитонита кошек составляет 1-2 процента. Серологически проводится различие между двумя типами вирусов, при этом тип 1, который встречается в основном в Европе и США, может воспроизводиться в культурах клеток , что невозможно для типа 2, который встречается в основном в Японии.
Инкубационный период , вероятно , до четырех месяцев. Уже на второй день после заражения животные выделяют вирус с фекалиями, выделениями из носа и слюной. Удаление вирусов может длиться всю жизнь. Первоначально безвредный вирус передается в основном при контакте с инфицированными фекалиями или зараженными предметами. Также возможна передача инфекции изо рта в рот или изо рта в нос. В окрестностях вирус заразен до недели. Кроме того, люди могут переносить вирус и передавать его кошкам. Мамы-кошки-носители вируса часто заражают свои плоды во время беременности . Передача уже мутировавшей формы, вероятно, не играет роли в распространении болезни.
В принципе, все виды и возрастные группы кошек восприимчивы к FIP. Болезнь чаще всего поражает животных в возрасте от шести месяцев до пяти лет и животных старше 14 лет. Поскольку кошки, живущие в дикой природе, в основном одиночные существа без постоянного помета, вероятность заражения диких животных значительно ниже. Выловленные одичавшие домашние кошки становятся серопозитивными примерно на 10 процентов, с другой стороны, после нескольких недель в приюте для животных - почти 90 процентов животных. В зоопарках особо уязвимы леопарды , особенно крупные кошки, находящиеся под угрозой исчезновения .
Патогенез и формы
Патогенез заболевания до сих пор не выяснен. Мутация изначально безвредного варианта FCoV в так называемые «вирусы FIP» происходит в кишечнике и может произойти через годы после заражения. При мутации вирус приобретает способность связываться с рибосомами фагоцитов иммунной системы ( моноциты и макрофаги ) и размножаться в них ( репликация ). Репликация вируса вызывает разложение фагоцитов, и высвобождающиеся вирусные частицы поглощаются другими фагоцитами, что приводит к распространению вируса по организму. Высвобождение веществ-посыльных клеток активирует клетки, выстилающие кровеносные сосуды ( эндотелиальные клетки ), и, таким образом, приводит к воспалению . Некоторые клеточные мессенджеры также приводят к гибели других иммунных клеток, таких как лимфоциты . Немутантный вариант, с другой стороны, воспроизводит преимущественно в кишечных эпителиальных клеток в тощей кишке .
Сегодня считается, что возникновение заболевания и в какой форме зависит от иммунного статуса отдельного животного.
У некоторых животных болезнь не развивается, несмотря на мутацию вируса из-за сильной клеточной иммунной реакции . Это позволяет иммунной системе держать под контролем инфицированные клетки крови. Эти животные остаются без клинических симптомов , но продолжают выделять их как скрытые вирусоносители. У некоторых животных подозревается полная элиминация вируса, но это снова делает их восприимчивыми к новым инфекциям.
FIP, вероятно, проявляется клинически только при нарушении иммунной системы , например. Б. стрессом или другими заболеваниями, которые приводят к усилению репликации вируса в кишечнике. Образование антител влияет на патогенез, потому что они не могут нейтрализовать вирус . При повышенном образовании антител активируется больше макрофагов, в которых происходит дальнейшее размножение вируса. Парадокс , что антитела фактически сформированные для борьбы с патогенов привести к обострению болезни ( « антитело-зависимого повышение вирусной инфекции » ) также наблюдается при вирусных заболеваниях у человека (например , СПИД , лихорадки денге ). Однако это зависимое от антител усиление, вероятно, играет роль только в экспериментальных инфекциях.
Раньше болезнь подразделялась на две основные формы («влажная» и «сухая»). Однако границы между двумя основными формами плавные, почти у каждого больного животного наблюдаются компоненты обоих проявлений, одно из которых может временно доминировать. Таким образом, это подразделение все чаще рассматривается как устаревшее в новейшей литературе.
«Мокрая форма»
В случае слабого клеточно-опосредованного иммунного ответа вирус продолжает размножаться в крови ( виремия ) и массовое образование иммунных комплексов, активация системы комплемента и фагоцитов ( макрофагов ). Это приводит к воспалению кровеносных сосудов ( васкулиту ) и лимфоплазмоклеточному периваскулиту ( воспалению вблизи кровеносных сосудов, характеризующемуся лимфоцитами и плазматическими клетками ) серозных оболочек , что приводит к разрушению тканей ( некрозу ). Однако некоторые авторы придерживаются мнения, что настоящие изменения представляют собой гранулематозный васкулит и периваскулит, то есть воспаление сосудов и их окружения с преобладанием фагоцитов. В этом случае лимфоплазматический периваскулит представляет собой позднюю стадию. Макроскопически эти очаги воспаления выглядят как беловатые узелки. Воспаление также вызывает утечку сыворотки и белков в полости тела и отложение фибрина на внутренних органах .
«Сухая форма»
В «сухой форме» преобладают более крупные узлы, которые в основном возникают внутри органов. Это сросшиеся очаги воспаления, которые, как и влажная форма, возникают при васкулите / периваскулите. Иногда их называют «гранулематозными» изменениями, но это не настоящее гранулематозное воспаление . Выходы для жидкости в таком виде отсутствуют. Предполагается, что эта форма развивается с менее сильно ослабленным клеточно-опосредованным иммунным ответом и представляет собой более мягкую и длительную форму. На его долю приходится около 17 процентов случаев FIP, но из-за трудной возможности диагностики (см. Ниже) следует ожидать значительного количества незарегистрированных случаев.
Симптомы
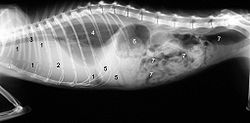
Клинически проявленный FIP начинается со сниженного потребления корма ( анорексия ), исхудания и рецидивирующей, резистентной к терапии лихорадки . Остальные симптомы зависят от формы выражения, при этом могут происходить плавные переходы между двумя формами. Разделение на влажные и сухие формы, строго говоря, является описанием макроскопических результатов. Под микроскопом обе формы обычно образуют идентичное изображение.
«Мокрая форма»
Классическая «влажная форма» проявляется скоплением жидкости в брюшной полости ( асцит , асцит ) или в грудной полости ( плевральный выпот ). Скопление жидкости в брюшной полости обычно клинически диагностируется как увеличение окружности с колебаниями. Скопление жидкости в грудной полости может вызвать сильную одышку . Прокола обеспечивает желтоватую, тягучую, вязкую жидкость. Тот факт, что это довольно типичный по внешнему виду богатый белком экссудат , является важным диагностическим критерием.
«Сухая форма»
«Сухая форма» проявляется узловыми изменениями, особенно в области живота . Мозг , в глаза , то органы в грудной полости или только кожи также могут быть затронуты. В зависимости от расположения органа, желтуха , заболевания глаз ( увеит , изменения роговицы [«осаждение бараньего жира»], кровотечение или скопление фибрина в передней камере, ретинит ), анемия или неврологические симптомы (судороги, судороги, дезориентация, тремор глаз. , паралич ).
диагноз
Первоначальное клиническое подозрение возникает при любой лихорадке у молодой кошки (младше шести лет), которая не реагирует на антибиотики .
Накопление жидкости в полостях тела («влажная форма») и повышенное содержание глобулинов в крови ( гиперглобулинемия ) - уже явные признаки. Определенные изменения в анализе крови ( анемия от умеренной до тяжелой , нейтрофилия и лейкопения ) являются дополнительными подозрительными факторами.
Золотым стандартом обнаружения FIP является иммуногистохимическое обнаружение коронавируса в тканевых макрофагах . Все остальные процедуры менее инвазивны, но в некоторых случаях значительно менее информативны. Возможны следующие методы лабораторной диагностики:
- Образец Ривальты : прокол удаляет жидкость из пораженной полости тела. К дистиллированной воде в пробирке добавляют каплю ледяной уксусной кислоты и добавляют каплю точечного раствора. При заражении FIP капля не растворяется и опускается на дно. Отрицательный результат теста почти наверняка исключает FIP ( специфичность 98 процентов), тогда как положительный результат делает его вероятным, но не доказывает. Согласно последним исследованиям, чувствительность составляет всего 52 процента. Положительный результат Ривалтапроба может также возникнуть в случае гнойного серозита и излияний, вызванных опухолями. Чувствительность выше у молодых кошек, если еще обследовать более старых животных, она падает до 65,5 процента.
- Обнаружение антител в пункции : обнаружение антител в пункции с помощью окрашивания антителами имеет чувствительность и специфичность около 85 процентов.
- Обнаружение антигена в макрофагах : во влажной форме мазок может быть сделан из центрифугата прокола и смешан с анти-коронавирусным конъюгатом . Чувствительность этого метода обнаружения составляет 68–95 процентов, в зависимости от исследования. Специфичность уже давно указывается в литературе как 100 процентов, но недавнее исследование предоставило три ложноположительных результата у кошек с сердечным выпотом (специфичность 93 процента).
- Альбумин-глобулин фактор : Определение частного от альбумина и глобулина концентрации в крови может также обеспечивать индикацию заболевания. Если коэффициент меньше 1, подозревается FIP; значения ниже 0,6 считаются почти диагностическими. Однако существуют значительные колебания в отношении чувствительности и специфичности в зависимости от размера коэффициента. При коэффициенте 0,9 чувствительность составляет 89 процентов, а специфичность - 76 процентов. Если значение ниже 0,6, чувствительность составляет всего 48 процентов, а специфичность - 99 процентов.
- Высокий уровень кислого гликопротеина альфа1 , белка острой фазы , свидетельствует о FIP.
- Обнаружение антител в крови : непрямое определение антител в крови неясно. Это говорит лишь о том, что кошка контактировала с коронавирусом, даже если это был только безобидный вариант. Чувствительность составляет 85 процентов, а специфичность - всего 57 процентов. Положительный тест с титром менее 1: 1600 увеличивает специфичность примерно до 98 процентов, но снижает чувствительность до 33 процентов.
- Обнаружение комплекса антиген-антитело в крови : обнаружение комплексов антиген-антитело с помощью ELISA имеет чувствительность только около 50 процентов, специфичность составляет 91 процент.
- FCoV-RT-PCR : РНК коронавируса и, следовательно, виремию можно обнаружить с помощью метода RT-PCR . При исследовании крови чувствительность составляет около 15 процентов, а при исследовании мононуклеарных клеток - 29 процентов. Специфичность 86–100%. Обнаружение вирусной РНК не позволяет отличить безвредные коронавирусы от мутантных. Напротив, при RT-PCR из эффузионной жидкости чувствительность и специфичность высоки (> 90 процентов). Обнаружение в кале используется только для выявления выделителей коронавируса, оно не подходит для диагностики заболевания.
Сочетание различных процедур увеличивает диагностическую значимость. Определение лактатдегидрогеназы ( фермента , превращающего лактат в пируват ), высвобождаемого в результате гемолиза, может предоставить дополнительную информацию о заболевании, так же как и определение повышения уровня панкреатического фермента альфа-амилазы у кошек, которое обычно вызывается FIP .
В то время как обнаружение антигена в выпоте считается окончательным, «сухую форму» обнаружить трудно. Методы обнаружения 4–8 также возможны, но пока только патогистологическое обнаружение является окончательным для определения наличия FIP. Иммуногистохимическое определение антигена на фиксированной формалином ткани более чувствительно, чем на свежей ткани. Есть кошки с FIP без каких-либо изменений этих параметров, а также животные, у которых нет FIP, несмотря на заметные отклонения в этих параметрах. Обнаружение антител в образцах тканей ( биоптат ) из легких , печени , почек и лимфатических узлов считается убедительным, но есть перекрестные реакции с безвредным вариантом FCoV и другими коронавирусами ( коронавирус собак , вирус TGE ), к которым кошки относятся. в принципе восприимчивы, но это не вызывает FIP. ПЦР -Virusnachweis в тканях также имеется в продаже.
С 2012 года существует метод обнаружения, который обещает четкую молекулярно-биологическую характеристику двух вариантов коронавируса. Мутации в двух белках-шипах, которые непосредственно связаны с мутированным вариантом и, таким образом, FIP обнаруживаются с помощью ПЦР. Этот тест также коммерчески доступен с 2013 года и может выполняться на аспиратах из выпота, спинномозговой жидкости и водянистой влаги, а также на крови с ЭДТА.
Дифференциальная диагностика
При довольно типичной влажной форме необходимо исключить другие причины асцита и / или плеврального выпота. К ним относятся, прежде всего, сердечные заболевания , недостаток белка в крови ( гипопротеинемия ), застойные излияния из-за опухолевых заболеваний , кровотечения или бактериальный плеврит или перитонит; реже стрептотрихоз (гнойный бактериальный плеврит, ранее считавшийся грибковым заболеванием, но жидкость здесь коричневато-мутная) или разрыв грудного протока ( хилоторакс ). Большую часть этих заболеваний можно довольно легко исключить из- за относительно низкого содержания белка в выпоте ( транссудате ), вызванного этим, и отсутствия опухолевых клеток или бактерий.
Кошачья лейкемия , кошачий синдром иммунодефицита , panleucopenia , лимфосаркома , иерсиниоз, и болезнь Tyzzer должны быть рассмотрены , если лихорадка является устойчивой к терапии или узелковым изменениям .
Терапия и профилактика
Клинически проявленный FIP обычно приводит к смерти в течение нескольких недель, особенно молодые животные с «влажной формой» имеют короткое время выживания. Среднее время выживания составляет девять дней, 95 процентов инфицированных животных умирают в течение года. Таким образом, одна из 20 кошек может прожить дольше года, поэтому эвтаназия сразу не показана.
FIP излечим. В исследовании 2018 года, проведенном Нильсом К. Педерсеном, 31 кошку лечили противовирусным GS-441524, родительским нуклеозидом GS-5734, который, как было установлено, является противовирусным средством с низкой молекулярной массой для предотвращения лихорадки Эбола у макак-резусов и ингибирования оба коронавируса доказали свою эффективность как на тканевых культурах, так и на моделях инфицирования мышей. Этот полевой тест показал, что химически менее сложный GS-441524 был высокоэффективен и показал многообещающие результаты лечения кошек с естественным FIP. Эти результаты были опубликованы в Журнале кошачьей медицины и хирургии (JFMS) 13 февраля 2019 года.
В исследовании 2016 года излечение с помощью GC376, ингибитора вирусной 3C-подобной протеазы (3CLpro), также могло быть достигнуто экспериментально в нескольких случаях . Однако этот активный ингредиент пока недоступен, поэтому в настоящее время возможна только симптоматическая терапия в сочетании с иммуносупрессией . Показания того, что лечение кошачьим интерфероном в дополнение к иммуносупрессивной терапии может иметь положительный эффект на время выживания, не были подтверждены в исследовании 2006 года. Можно попробовать терапию высокими дозами глюкокортикоидов , возможно, в сочетании с ингибитором тромбоксансинтазы озагрелом . Антибиотик показан против вторичных бактериальных инфекций .
Вакцинация против FIP является спорной. Основная проблема здесь заключается в том, что системно применяемая вакцина (вакцина) с используемыми штаммами несет в себе риск развития FIP из-за вакцинного вируса, вакцинный вирус может быть смешан с полевым вирусом и образуются усиливающие инфекцию антитела . Таким образом, цель доступной вакцины - вызвать местный иммунный ответ на клеточном уровне, основанный на локальном IgA в области входа вирусов в носоглотку. Поэтому вакцину закапывают в нос. Гарантирован только местный эффект вакцины, поскольку вакцинный штамм может размножаться только при температуре 31 ° C. В случае животных, которые уже являются FCoV-положительными (также из-за безвредного варианта), принцип вакцинации не работает. Поэтому его можно рекомендовать только в ограниченной степени. Это полезно для серонегативных кошек в больших стадах, а также для животных, содержащихся в индивидуальном содержании, чей иммунный ответ будет подавлен случайным контактом с введенным вирусным материалом (например, экскрементами на обуви владельца) из-за огромной «вирусной нагрузки». Защитный эффект вакцины ( Primucell FIP ® ) дал очень разные результаты в клинических исследованиях . В зависимости от исследования была заявлена эффективность от 0 (отсутствие защитного эффекта) до 75 процентов.
Чтобы предотвратить распространение безобидного начального варианта вируса, была представлена концепция «стремления к раннему отлучению » (англ., Early отлучение ), которую в 1992 году представили Адди и Джарретт . Беременная мать кошки изолирован от других кошек за две недели до родов и рождения и воспитания молодых кошек подвергаются строгим гигиеническим условиям. Когда котятам исполняется пять-шесть недель, их отнимают от груди и разлучают с матерью, потому что до этого момента они защищены только материнскими антителами, а затем могут передавать вирус от нее. В отличие от успехов в Великобритании , где все котята впоследствии были FCoV-серонегативными, этот результат не удалось воспроизвести в немецком исследовании.
Более практичная стратегия - снизить инфекционное давление в популяции кошек. Принцип состоит в том, чтобы максимально уменьшить количество потенциально вызывающих болезнь вирусов FCoV, и это уже может быть выполнено простыми гигиеническими методами. Рекомендуются возможные меры:
- Установите как можно больше ящиков для экскрементов, которые следует чистить несколько раз в день.
- по возможности всегда используйте одни и те же сосуды для питья и кормления и очищайте их ежедневно
- Держите кошек небольшими группами от 3 до 4 животных.
- Удаление сильных вирусоносителей из группы
- Удалите самок из группы за 2 недели до помета и выращивайте молодняк отдельно.
история
Начиная с 1954 г., FIP все чаще наблюдался в США, хотя отдельные сообщения о предполагаемых случаях FIP можно найти уже в 1914 г. В 1963 году Джин Хольцуорт впервые написала более подробную статью, в 1966 году Вулф и Гриземер продемонстрировали инфекционную природу болезни и дали более подробное описание. В 1968 году Зук и др. у кошек, экспериментально зараженных этим заболеванием, вирус был впервые обнаружен с помощью электронного микроскопа. Тот факт, что возбудителем является коронавирус, подозревали с 1970 года, но только в 1976 году возбудитель был обнаружен ( Osterhaus et al. ) И его воспроизводство в культуре клеток ( Pedersen ). С 1977 г. патоген первоначально назывался «вирус FIP» (FIPV). В 1979 году был разработан первый тест ELISA для обнаружения антител. В 1981 году Педерсен и др. впервые широкое распространение энтерального коронавируса кошек (FECV) и показало большое сходство с FIPV. В 1987 году Педерсен выдвинул гипотезу, что FECV и FIPV представляют собой общий спектр вирусов и отличаются только своей вирулентностью. В 1998 году его рабочей группе ( Vennema et al. ) Удалось доказать, что FIPV - это всего лишь мутация FECV. С 2000 года название возбудителя стало названием коронавируса кошек (FCoV).
Первые экспериментальные попытки разработать вакцины относятся к началу 1980-х годов. Эксперименты с различными штаммами вакцин ( гетерологичный вирус, 1979, 1984, 1988; гомологичный вирулентный вирус, 1983; гомологичный аттенуированный вирус, 1983; вирус осповакцины - рекомбинанты , 1990, 1992) не дали заметного защитного эффекта и даже привели к вакцинационным заболеваниям. Некоторые из них имели в виду проявленное антитело-зависимое усиление иммунитета (см. ниже). Первая безопасная коммерческая вакцина была произведена компанией Pfizer в 1991 году .
С появлением тяжелого острого респираторного синдрома (SARS) и открытием, сделанным в 2003 году, патогеном является коронавирус, подозревали, что FCoV и другие коронавирусы животных являются ответственными за это серьезное респираторное заболевание у людей. FCoV показывает большое сходство с вирусом SARS по нуклеотидной последовательности. Однако эти предположения не подтвердились.
литература
- Д.Д. Адди, Дж. О. Джарретт: Исследование естественных кошачьих коронавирусных инфекций у котят. В: Ветеринарный журнал. Том 130, 1992, ISSN 0042-4900 , стр. 133-137, DOI: 10.1136 / vr.130.7.133 .
- Кристина Биндер: Сравнение различных параметров для диагностики инфекционного перитонита кошек. Мюнхен 2001 (Мюнхен, университет, диссертация, 2001).
- Ивонн Фишер: Исследования по диагностике и терапии инфекционного перитонита у кошек. Диссертация на ветеринарном факультете LMU в Мюнхене , 2012 г. ( PDF; 4,7 МБ )
- Катрин Хартманн: Инфекционный перитонит у кошек. В: Ветеринарные клиники Северной Америки. Практика мелких животных. Том 35, № 1, 2005 г., ISSN 0195-5616 , стр. 39-79, DOI : 10.1016 / j.cvsm.2004.10.011 .
- Катрин Хартманн: Инфекционный перитонит кошек - диагностика, лечение и профилактика. В: Практика мелких животных. Том 55, 2010, ISSN 1434-9132 , с. 561-572.
- Нильс К. Педерсен: Вирусологические и иммунологические аспекты инфекции вируса инфекционного перитонита кошек. В кн . : Успехи экспериментальной медицины и биологии. Том 218, 1987, ISSN 0065-2598 , С. 529-550,. DOI : 10.1007 / 978-1-4684-1280-2_69 .
- Friederike Riemer: Клинические симптомы и изменения лабораторных параметров у кошек с инфекционным перитонитом кошек. Диссертация на ветеринарном факультете LMU Мюнхен , 2018 ( PDF; 3,8 МБ )
- Гарри Веннема, Эми Поланд, Джанет Фоли, Нильс К. Педерсен: Вирусы инфекционного перитонита кошек возникают в результате мутации эндемичных кишечных коронавирусов кошек. В кн . : Вирусология. Том 30, № 1, 1998 г., стр. 150-157, DOI : 10.1006 / viro.1998.9045 .
веб ссылки
Индивидуальные доказательства
- ^ MA Кеннеди: Инфекционный перитонит кошек: обновленная информация о патогенезе, диагностике и лечении. В кн . : Ветеринарные клиники Северной Америки. Практика мелких животных. Том 50, номер 5, сентябрь 2020 г., стр. 1001-1011, doi : 10.1016 / j.cvsm.2020.05.002 , PMID 32563530 (обзор).
- ↑ Роберт Герцш и Анжелика Фишер: GS-441524 для лечения FIP в настоящее время незаконно! В: Dt. TÄBl. Том 69, номер 7, с. 810.
- ↑ Вильфрид Крафт, Ульрих М. Дюрр: Болезни кошек . Ред .: В. Крафт. 4-е издание. M&H Schaper, Ганновер 1996, ISBN 3-7944-0178-6 , стр. 138 .
- ↑ а б в г д Сюзанна Хелд, Рето Нейгер: Этиология, эпидемиология и диагностика инфекционного перитонита кошек (FIP). В: Практика мелких животных . Том 58, 2013, с. 80-96.
- ↑ a b c d Юрген Кремендаль: Инфекционный перитонит кошек - текущий обзор. В: в частности, зверюга. Том 17, № 2, 2014 г., стр. 10-14, DOI: 10.1055 / s-0033-1361536
- ↑ А. Кипар, Х. Мэй, С. Менгер, М. Вебер, В. Лейкерт, М. Райнахер: Морфологические особенности и развитие гранулематозного васкулита при инфекционном перитоните кошек. В кн . : Ветеринарная патология. Том 42, № 3, 2005 г., ISSN 0300-9858 , с. 321-330. PMID 15872378 , DOI : 10.1354 / вп.42-3-321 .
- ^ Ю. Фишер, К. Заутер-Луи, К. Хартманн: диагностическая точность теста Ривальта для инфекционного перитонита кошек. В: Ветеринарная клиническая патология / Американское общество ветеринарной клинической патологии. Том 41, номер 4, декабрь 2012 г., стр. 558-567, DOI : 10.1111 / j.1939-165X.2012.00464.x , PMID 22913882 .
- ↑ Катрин Хартманн и др.: Сравнение различных тестов для диагностики инфекционного перитонита у кошек. В кн . : Журнал внутренней ветеринарии. Том 17, номер 6, ноябрь-декабрь 2003 г., стр. 781-790, doi : 10.1111 / j.1939-1676.2003.tb02515.x , PMID 14658713 , PMC 7197515 (полный текст).
- ↑ Сюзанна Хелд: Точность диагностических тестов на инфекционный перитонит кошек (FIP) у кошек с выпотом в полость тела. Ветеринарная диссертация Гиссен 2013; Немецкое ветеринарное медицинское общество, Гиссен 2014, ISBN 978-3-86345-201-8 . ( Оцифрованная версия ).
- ^ SJ Doenges, K. Weber, R. Dorsch, R. Fux, K. Hartmann: Сравнение полимеразной цепной реакции обратной транскриптазы в реальном времени мононуклеарных клеток периферической крови, сыворотки и бесклеточного выпота из полости тела для диагностики кошачьих инфекционных заболеваний. перитонит. В кн . : Журнал кошачьей медицины и хирургии. Том 19, № 4, апрель 2017 г., стр. 344-350, DOI : 10.1177 / 1098612X15625354 , PMID 26787293 .
- ^ DR Rissi: ретроспективное исследование невропатологии и диагностики естественного инфекционного перитонита кошек. В: Журнал ветеринарных диагностических исследований: официальная публикация Американской ассоциации ветеринарных лабораторных диагностов, Inc. Том 30, номер 3, май 2018 г., стр. 392-399, DOI : 10.1177 / 1040638718755833 , PMID 29411701 .
- ↑ Хуэй-Вен Чанг, Герман Ф. Эгберинк, Ребекка Халпин, Дэвид Дж. Спиро, Питер Дж. М. Роттьер: пептид слияния шипованного белка и вирулентность коронавируса кошек. В кн . : Новые инфекционные заболевания . Volume 18, No. 7, July 2012, ISSN 1080-6059 , pp. 1089-1095, doi: 10.3201 / eid1807.120143 , PMID 22709821 , PMC 3376813 (полный текст).
- ↑ Deutsches Tierärzteblatt. Том 61, 2013, с. 281.
- ↑ Иоахим Фрей : Заболевания органов дыхания. В: Людвиг Хейльмейер (ред.): Учебник внутренней медицины. Шпрингер-Верлаг, Берлин / Геттинген / Гейдельберг, 1955; 2-е издание, там же, 1961, стр. 599-746, здесь: стр. 694 ( стрептотрихоз ).
- ↑ Мариан К. Хорзинек : Можно ли контролировать кошачий инфекционный перитонит (FIP)? В кн . : Клейнтиермедизин , 2016, № 5, с. 210–217.
- ↑ Педерсен NC, Перрон М., Баннаш М. и др.: Эффективность и безопасность аналога нуклеозидов GS-441524 для лечения кошек с естественным инфекционным перитонитом кошек. В: J Feline Med Surg. Том 21, No. 4, 2019, стр. 271-281. DOI: 10.1177 / 1098612X19825701
- ↑ Ким Юнджон и др.: Обратное развитие фатальной коронавирусной инфекции у кошек с помощью ингибитора протеазы коронавируса широкого спектра действия. В: Патогены PLOS 2016, DOI: 10.1371 / journal.ppat.1005531
- ↑ Сюзанна Ритц, Герман Эгберинк, Катрин Хартманн: Влияние кошачьего интерферона-омега на время выживания и качество жизни кошек с кошачьим инфекционным перитонитом. В: Журнал внутренней ветеринарной медицины. Том 21, № 6, 2006 г., ISSN 0891-6640 , стр. 1193-1197, DOI: 10.1111 / j.1939-1676.2007.tb01937.x .
- ↑ DD Addie, JO Jarrett: Исследование естественных кошачьих коронавирусных инфекций у котят. В: Ветеринарный журнал. Том 130, 1992, стр. 133-137, DOI: 10.1136 / vr.130.7.133 .
- ^ Джон Ставринидес, Дэвид С. Гуттман: Мозаичная эволюция тяжелого острого респираторного синдрома коронавируса. В: Журнал вирусологии. Том 78, № 1, 2004 г., ISSN 0022-538X , стр. 76-82. PMID 14671089 , DOI : 10.1128 / JVI.78.1.76-82.2004 .








