Периодическая таблица
Периодическая таблица (длинная версия периодическая таблица элементов , сокращенно PSE или PSdE ) представляет собой список всех химических элементов , расположенный в соответствии с увеличением заряда ядра ( атомный номер ). Список разделен на строки (точки), так что элементы с аналогичными химическими свойствами находятся в каждом столбце (основной группе / подгруппе) итоговой таблицы . Название периодическая система (от греч. Περίοδος períodos , нем. «Обработка, обращение, цикл» ) указывает на то, что многие свойства элементов периодически повторяются с увеличением атомного номера.
Таблица Менделеева была представлена в 1869 году независимо и почти идентично двумя химиками, сначала русским Дмитрием Менделеевым (1834–1907), а несколько месяцев спустя немцем Лотаром Мейером (1830–1895). Исторически периодическая таблица имела особое значение для предсказания еще неоткрытых элементов и их свойств, поскольку свойства элемента можно приблизительно предсказать, если известны свойства окружающих элементов в периодической таблице. Сегодня он в основном используется как четкая схема организации элементов и для определения возможных химических реакций .
Периодическая таблица
Обоснование
Периодическая таблица - это систематический табличный сборник химических элементов, в котором элементы расположены в соответствии с двумя принципами: с одной стороны, они расположены в соответствии с возрастающим атомным номером (то есть числом протонов в атомном ядре, которое является уникальным. и характеристика для каждого элемента ). С другой стороны, представление выбрано таким образом, чтобы элементы с похожим химическим поведением находились близко друг к другу. При увеличении атомного номера свойства элементов напоминают друг друга через регулярные, хотя и по-разному длинные периодические интервалы. Термин «периодическая таблица» указывает на то, что эти периодичности представлены выбранным расположением элементов.
описание
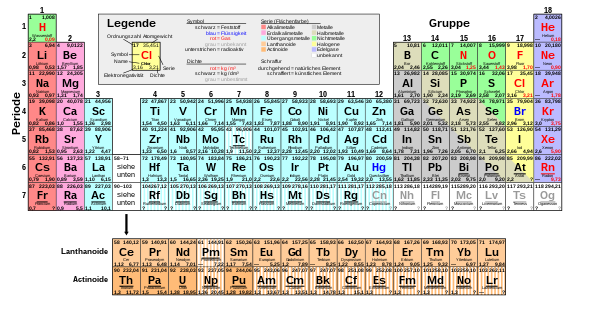
Существуют разные варианты периодических таблиц. Наиболее известное представление упорядочивает элементы в двумерной табличной сетке с учетом периодичности, в которой каждому элементу соответствует ячейка сетки. Горизонтальные линии дисплея называются периодами , вертикальные столбцы - группами .
В течение каждого периода атомный номер элементов увеличивается слева направо. Разрывы строк выбираются таким образом, чтобы химически похожие элементы находились в одном столбце (группе). Таким образом, элементы группы демонстрируют сходное химическое поведение. Например, это группа химически инертных благородных газов или группа реактивных галогенов .
Периоды имеют разную длину. Первый период состоит всего из 2 элементов . Далее следуют два периода по 8 элементов каждый , два следующих периода по 18 элементов каждый и, наконец, два периода по 32 элемента в каждом .
Длинная форма периодической таблицы, в которых последние два периода отображаются в виде сплошных линий, часто является неблагоприятным из-за необходимой ширины дисплея. В наиболее часто используемой форме средней длины группы элементов, вырезанные из этих периодов, показаны под основной системой для экономии места. В этой форме периодическая таблица состоит из 7 периодов и 18 групп. Существует также еще более компактная, но редко используемая краткая форма таблицы Менделеева .
Информационное содержание
Обычно элементы перечислены с их атомным номером и символом элемента . В зависимости от области применения может быть предоставлена дополнительная информация об элементе, такая как полное название, масса, температура плавления, плотность и физическое состояние. Любая информация о «оболочках» относится к оболочечной модели атомной физики . Цветовая кодировка часто используется для обозначения различных свойств, например принадлежности к металлам, полуметаллам или неметаллам.
Однако особенность периодической таблицы по сравнению с простым табличным перечислением свойств элементов заключается в информации о взаимосвязях между элементами, которая возникает в результате размещения рассматриваемых элементов. Тот факт, что элемент принадлежит к определенной группе, сразу показывает основные химические характеристики элемента, такие как его реакционная способность или предпочтительные партнеры по связыванию. Расположение в общей системе позволяет делать выводы относительно тех свойств, которые показывают систематический тренд в периодической таблице, например, энергии ионизации .
сфера
С последним расширением периодической таблицы в 2015 году элементы с 1 ( водород ) до 118 ( оганессон ) были полностью открыты или созданы и описаны. Элементы с атомными номерами от 1 до 94 встречаются в природе, при этом технеций (атомный номер 43), прометий (61), астат (85), нептуний (93) и плутоний (94) встречаются в природе в таких небольших количествах, что они изначально искусственно созданный и описанный. Из этих 94 природных элементов 83 являются изначальными , что означает, что они существовали с момента образования Земли. Первоначальные запасы оставшихся 11 давно распались из-за их более короткого периода полураспада, но они постоянно восстанавливаются в результате радиоактивного распада в естественной серии распада первичных элементов.
Элементы порядковых номеров с 95 по 118 созданы исключительно искусственно. Последние обнаруженные элементы 113, 115, 117 и 118 были подтверждены ИЮПАК 30 декабря 2015 года , и этим завершился седьмой период периодической таблицы.
Изображения соответствующих элементов можно найти в таблице химических элементов .
атомная структура
Строение атома
Все вещества состоят из атомов . Атом состоит из протонов и нейтронов , которые образуют атомное ядро , и электронов , которые окружают атомное ядро как « электронную оболочку ». Каждый протон несут положительный, а электроны - отрицательный элементарный заряд , поэтому количество электронов в электронной оболочке должно быть равно количеству протонов в ядре атома, чтобы атом был электрически нейтральным. Число протонов или электронов электрически нейтрального атома называется его атомным номером .
Химические соединения - это вещества, состоящие из двух или более типов атомов. Атомы объединяются, образуя молекулы . В связывающие силы, удерживающие атомы вместе в молекуле опосредованы взаимодействием между электронами. Решающим фактором для свойств сил связи в основном являются свойства электронов во внешней области оболочки, валентных электронов .
Химическое поведение атома - например, его склонность преимущественно образовывать соединения с некоторыми другими типами атомов - поэтому в значительной степени определяется структурой электронной оболочки и особенно валентными электронами. Эта структура всегда одинакова для данного числа электронов, так что атомный номер определяет химическое поведение атома.
Атомы с одинаковым атомным номером и, следовательно, одинаковым поведением в химических реакциях, называются химическими элементами . В периодической таблице все существующие элементы расположены таким образом, чтобы можно было распознать законы, вытекающие из структуры атомов в химических и атомно-физических свойствах элементов.
Строение электронной оболочки

Электронная оболочка атома имеет структуры, которые исследуются и описываются квантовой механикой . Его можно разделить на основные оболочки. Каждая основная оболочка, в свою очередь, может быть разделена на подоболочки, которые состоят из орбиталей . Квантовое состояние, в котором данный электрон описывается четырьмя квантовыми числами : главным квантовым числом , квантовым числом , магнитным квантовым числом и спиновым квантовым числом .
Основное квантовое число n = 1, 2, 3,… нумерует основные оболочки. В качестве альтернативы эти оболочки могут называться K- оболочкой (для n = 1), L- оболочкой (для n = 2), M- оболочкой (для n = 3) и т. Д. Диаметр основных оболочек увеличивается с увеличением основного квантового числа.
Основная оболочка с основным квантовым числом n имеет n подоболочек, которые различаются своим вторичным квантовым числом. Нижние оболочки обозначаются буквами s , p , d , f и так далее (выбор этих букв обусловлен историческими причинами). Данная подоболочка в определенной основной оболочке идентифицируется ее буквой, которой предшествует основное квантовое число, например 2p для подоболочки p в L- оболочке ( n = 2).
Отдельные подоболочки делятся на орбитали, которые различаются магнитным квантовым числом. Каждая подоболочка s содержит одну орбиталь, каждая подоболочка p содержит три орбитали, каждая подоболочка d содержит пять орбиталей, а каждая подоболочка f содержит семь орбиталей.
Спиновое квантовое число описывает две возможные ориентации спина электрона.
Принцип исключения Паули гласит, что никакие два электрона не могут согласовать атом во всех четырех квантовых числах. Два электрона, которые находятся на одной орбитали, уже согласуются в трех квантовых числах (а именно тех, которые описывают эту орбиталь). Следовательно, два электрона должны различаться четвертым квантовым числом, их ориентацией спина. Это исчерпывает возможные вариации квантовых чисел на этой орбитали, поэтому каждая отдельная орбиталь может быть занята максимум двумя электронами. Следующее максимальное количество электронов получается для различных оболочек:
- К оболочки ( п = 1) имеет только одну нижнюю оболочку ( 1s ) , и это имеет только одну орбитальную. Поскольку она может быть занята максимум двумя электронами , оболочка K принимает максимум два электрона.
- Л -оболочка ( п = 2) имеет два подоболочки 2s и 2р , которые состоят из одного или трех орбиталей. Он может удерживать максимум восемь электронов на своих четырех орбиталях.
- М -оболочкой ( п = 3) имеет три подоболочек 3s , 3p и 3d , так что он может держать максимум 18 электронов в девяти орбиталей.
- Н оболочка ( п = 4) может провести максимум 32 электронов в своих четырех подоболочек 4s к 4f и так далее.
В общем, оболочка с главным квантовым числом n может содержать максимум 2 · n 2 электронов.
Систематическая структура периодической таблицы
В общем, электроны, находящиеся на более высокой основной оболочке, более энергичны, чем электроны на более глубокой внутренней оболочке. Однако основные оболочки могут перекрываться энергетически, так как внутри основной оболочки энергия подоболочек увеличивается в смысле s → p → d → f, и подоболочки с более высокой энергией данной основной оболочки могут иметь более высокую энергию, чем наименьшая энергия. подоболочки следующей основной оболочки. Это имеет последствия для систематической структуры периодической таблицы.
На диаграмме напротив показано схематическое изображение, не в масштабе, уровней энергии в электронной оболочке. Линии слева символизируют основные оболочки, линии справа - их нижние оболочки. Прямоугольники представляют собой орбитали в каждой подоболочке, каждой из которых может быть назначено два электрона («со спином вверх» и «со спином вниз»). Начиная с основной оболочки n = 3, подоболочки следующих друг за другом основных оболочек энергетически перекрываются.
Если представить себе, что атомы различных элементов генерируются один за другим таким образом, что протон в ядре и электрон в оболочке (а также необходимые нейтроны, если применимо) добавляются к атому предыдущий элемент, то добавленный электрон всегда занимает самую низкую энергию свободных орбиталей остальных элементов (« принцип построения »). Поскольку картина заполнения отдельных орбиталей повторяется с началом каждой новой оболочки, когда она последовательно заполняется, структуры валентных электронов также повторяются и, как следствие, химические свойства атомов.
Для ясности в следующем тексте каждому имени элемента предшествует его порядковый номер в качестве индекса. Цвет рамок элементов указывает на наполняемую в данный момент оболочку.
Первый период: 1 водород на 2 гелия
| 1 H. |
|
2 Он |
| 1s нижняя оболочка | ||
Самый простой атом - это 1 атом водорода, у которого есть протон в ядре и электрон в оболочке (также есть изотопы с одним или двумя нейтронами). Электрон находится в s -оболочке K -оболочки.
Далее следует 2 атома гелия с двумя протонами (а также одним или двумя нейтронами) и двумя электронами. Добавлен электрон занимает свободное пространство в единственной орбитали с нижней оболочкой. Таким образом, K- оболочка исчерпана и первый период таблицы Менделеева заполнен.
Второй период: 3 лития на 10 неоновых
| 3 ли |
4 Be |
|
5 млрд |
6 С |
7 Н. |
8 O |
9 F. |
10 Ne |
| 2 с - | 2p нижняя оболочка | |||||||
L- оболочка начинает заполняться следующим электроном : 3 Литий имеет один электрон на 2s- орбитали, 4 Бериллий имеет второй электрон на 2s- орбитали, который полностью им заполнен.
Теперь заполнение 2 р орбиталей начинается : 5 боры имеет электрон в 2ре орбитального в дополнении к заполненным 2s орбитальным. Далее следуют 6 атомов углерода, 7 атомов азота, 8 атомов кислорода, 9 атомов углерода и 10 атомов неона. L- оболочка полностью заполняется этими восемью элементами, и второй период заканчивается.
Третий период: от 11 натрия до 18 аргона.
| 11 хорошо |
12 мг |
|
13 Al |
14 Si |
15 п. |
16 п. |
17 сл |
18 соток |
| 3 с - | 3p нижняя оболочка | |||||||
Заполнение М -оболочка начинается с той же схемой. При рассмотрении соответствующих конфигураций валентных электронов уже ясно, что, например, первый элемент этого периода ( 11 натрия, с одним валентным электроном) будет иметь химическое сходство с первым элементом предыдущего периода ( 3 литий, также с одним валентным электроном).
Четвертый период: 19 калия до 36 криптона
| 19 К |
Около 20 |
|
21 сбн |
22 Ti |
23 В |
24 Кр |
25 мин |
26 футов |
27 Co |
28 Ni |
29 Cu |
30 заметок |
|
31 Га |
32 Гэ |
33 As |
34 Se |
35 руб. |
36 крон |
| 4 с - | 3d нижняя оболочка | 4p подоболочка | |||||||||||||||||
Однако после восьмого элемента третьего периода, 18 аргона, регулярность будет нарушена. К тому времени, 3s и 3p нижние оболочки на М оболочек были заполнены, есть еще десять пробелов , доступные в 3d нижней части корпуса . Однако, поскольку 4s- орбиталь следующей более высокой оболочки ( N , n = 4) имеет более низкую энергию, чем 3d- орбитали M- оболочки, эта 4s- орбиталь сначала заполняется двумя электронами ( 19 калия, 20 кальция). 19 калий имеет валентный электрон и, следовательно , химически подобен 11 натрия и 3 литий. Поскольку предполагается, что периодическая таблица Менделеева подчеркивает эти и другие сходства, новый период начинается с 19 калия.
Только после того, как 19 калия и 20 кальция является 3d нижней оболочки в М оболочки заполнены, это происходит от 21 скандия до 30 цинка. Все эти элементы, «вставленные» в периодическую таблицу, имеют заполненную нижнюю оболочку на 4 секунды и отличаются только степенью заполнения нижней оболочки М. Следовательно, они показывают лишь относительно небольшие химические различия, они относятся к «переходным металлам». С 30 цинка , который является М в настоящее время -оболочки полностью заполнены, сопровождаются дальнейшим заполнением оставшейся N -оболочки с элементами 31 Галлия до 36 криптона.
Пятый период: 37 рубидия на 54 ксенона
| 37 руб. |
38 Sr |
|
39 Y |
40 Zr |
41 Nb |
42 Пн |
43 Тс |
44 руб. |
45 Rh |
46 Pd |
47 Ag |
48 кд |
|
49 в |
50 Sn |
51 Сб |
52 te |
53 И. |
54 Xe |
| 5 с - | 4d нижняя оболочка | 5p нижняя оболочка | |||||||||||||||||
Однако заполнение N- оболочки снова прерывается после 36 криптона. 4p нижняя оболочка завершается с 36 криптона, а нижняя оболочки 4d и 4е еще нужно заполнить. Еще раз, однако, s -оболочка следующей более высокой оболочки ( O , n = 5 ) имеет более низкую энергию и предпочтительно заполнена ( 37 рубидий, 38 стронций), что также позволяет новому периоду начаться снова. Далее следуют десять переходных металлов от 39 иттрия к кадмию 48 , которыми заполнена оставшаяся нижняя оболочка 4d , а затем шесть элементов от 49 индия к 54 ксенону, которыми заполняется нижняя оболочка 5p .
Шестой период: от 55 цезия до 86 радона
| 55 Cs |
56 Ba |
|
57 Ла |
|
72 Hf |
73 дня |
74 Вт. |
75 Re |
76 Ос |
77 Ir |
78 Пт |
79 Au |
80 изд |
|
81 тл |
82 Pb |
83 би |
84 По |
85 в |
86 пункт |
| 6 с - | 5д - | 5d нижняя оболочка | 6p нижняя оболочка | |||||||||||||||||
| 58 CE |
59 Пр |
60 Nd |
61 вечера |
62 см |
63 Eu |
64 Gd |
65 с. |
66 Дн |
67 Ho |
68 он |
69 тм |
70 Yb |
71 Лю |
|||||||
| 4f нижняя оболочка | ||||||||||||||||||||
Эта схема, которая определяется энергетическим положением соответствующих нижних оболочек, повторяется в следующие периоды. В шестом периоде одна за другой заполняются следующие подоболочки : 6s ( 55 цезий и 56 барий), 5d ( 57 лантан), 4f ( 58 церий до 71 лютеция), 5d ( 72 гафния до 80 ртути) и 6p ( 81 таллий против 86 радона).
На диаграмме выше заполнение нижней оболочки 4f показано как вставка, чтобы ограничить ширину диаграммы.
Седьмой период: от 87 франков до 118 Оганессона.
| 87 Пт |
88 Ra |
|
89 Ас |
|
104 Rf |
105 Дб |
106 Сг |
107 часов |
108 часов |
109 кв.м. |
110 Ds |
111 Rg |
112 cn |
|
113 Nh |
114 бутылок |
115 мк |
116 Ур. |
117 Цс |
118 выше |
| 7 с - | 6д - | 6d нижняя оболочка | Нижняя оболочка 7p | |||||||||||||||||
| 90 чт |
91 Па |
92 U |
93 Np |
94 Pu |
95 утра |
96 см |
97 Bk |
98 Кф |
99 это |
100 м |
101 мкр |
102 Нет. |
103 Лр |
|||||||
| 5f нижняя оболочка | ||||||||||||||||||||
В седьмом периоде заполняются следующие элементы: 7s ( 87 франций и 88 радий), 6d ( 89 актиний), 5f ( 90 торий на 103 лоуренсий), 6d ( 104 резерфордия на 112 коперниций) и 7p (от 113 никоний к 118 оганессону). .
Для простоты некоторые неровности при заполнении отдельных нижних оболочек здесь не показаны. Например, при заполнении 4d- оболочки один из s- электронов некоторых элементов мигрирует в d- нижнюю оболочку . Например, серебро 47-го типа не имеет двух электронов в нижней оболочке 5s и девяти электронов в нижней оболочке 4d , как ожидалось , а только один электрон 5s и десять электронов 4d . Список этих исключений можно найти в статье о принципе построения .
Таким образом, получается следующий образец заполнения (показанный в длинной форме таблицы Менделеева):
Наполнение оболочки 1 ЧАС Привет К ( п = 1) 2 Ли Быть Б. С. N О Ф. Нет L ( п = 2) 3 N / A Mg Al Si П. С. Cl Ar M ( n = 3) 4-й K Приблизительно Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge В качестве Se Br Kr N ( n = 4) 5 Руб. Sr Y Zr Nb Пн Tc RU Rh Pd Ag CD В Sn Sb Te Я. Xe О ( п = 5) Шестой CS Ба Ла Ce Pr Nd Вечера См ЕС Б-г Tb Dy Хо Он Тм Yb Лу Hf Та W. повторно Операционные системы Ir Pt Au Эд Tl Pb Би По В Марг P ( n = 6) 7-е Пт. Ра Ac Чт Па U Np Пух На См Bk Cf Это FM Мкр Нет Lr Rf Db Sg Бюстгальтер Hs Mt Ds Rg Cn Nh Fl Mc Ур. Ц Выше Q ( n = 7)
В представлениях периодической таблицы периоды обычно нумеруются последовательно арабскими цифрами от одного до семи. Число периода также является основным квантовым числом самой внешней основной оболочки, покрытой электронами.
Основная оболочка , хотя и самая внешняя, может содержать до восьми электронов ( K- оболочка: до двух). Следующий добавленный электрон создает новую главную оболочку, которая теперь становится новой самой внешней оболочкой. Основной рассматриваемой оболочкой является только вторая внешняя, третья внешняя и так далее при ее дальнейшем заполнении. Независимо от емкости внешней оболочки, каждый элемент имеет от одного до восьми валентных электронов.
Блочная структура таблицы Менделеева
Систематическая структура периодической таблицы, описанная выше, была построена таким образом, что элементы были расположены в порядке возрастания порядковых номеров, а новая строка («период») начиналась с определенных элементов. Критерием начала нового периода служил не физический критерий степени заполнения соответствующей основной оболочки, а химическое сходство с элементами над ней из предыдущего периода, то есть такое же количество валентных электронов. Из этого следует структура периодической таблицы, которая призвана сделать эти отношения видимыми. Следующее разделение таблицы Менделеева приводит к различным блокам :
Основные группы
В первых двух столбцах («группах») периодической таблицы заполнены две орбитали подоболочки s текущей основной оболочки ( блок s ). В последних шести группах заполнены шесть p -подоболочек текущей основной оболочки ( p -блок). Эти восемь групп являются основными группами периодической таблицы. Число валентных электронов увеличивается от одной основной группы к другой. Для 50 элементов основной группы количество их валентных электронов и, следовательно, их химическое поведение в основных чертах сразу видно из их принадлежности к группе. Если материальные свойства элементов определяются валентными электронами, у элементов одной и той же группы есть много общего. Номер группы, обычно записываемый римскими цифрами, также является числом электронов в соответствующей самой внешней основной оболочке (за исключением 2 гелия, который является благородным газом в основной группе VIII, но имеет только два электрона).
Каждый из элементов первой основной группы имеет валентный электрон. За исключением 1 водорода, они мягкие, серебристо-белые и очень реактивные металлы, щелочные металлы . Примером химического сходства щелочных металлов является тот факт, что все они реагируют с хлором 17 с образованием бесцветных солей, которые кристаллизуются в форме куба. Формулы этих соединений также соответствуют друг другу: LiCl, NaCl, KCl, RbCl, CsCl и FrCl.
Щелочноземельные металлы следуют за второй основной группой. Группа бора является третьей основной группой, группа углерода - четвертой, а группа азота - пятой. В халькогенах представляют шестую основную группу , а галогены седьмой.
Как можно обосновать квантово-механически, не только закрытые основные оболочки, но и закрытые нижние оболочки особенно устойчивы. Все элементы восьмой основной группы имеют закрытую основную или подоболочку: в случае гелия 2 завершается первая основная оболочка и, следовательно, ее единственная подоболочка 1s . Для других элементов 10 неон, 18 аргон, 36 криптон, 54 ксенон и 86 радон - если основная оболочка еще не завершена - p -подоболочка завершена; эти элементы имеют восемь валентных электронов (один октет ). Из-за стабильности их валентных электронных структур эти элементы почти не образуют химических связей. Все они газообразные и называются благородными газами .
Другие элементы также могут достигать оболочек из благородных газов и, следовательно, особенно стабильных состояний, высвобождая или поглощая электроны. Таким образом, щелочные металлы легко отдают свой одиночный валентный электрон, а затем появляются в виде одновалентных катионов , например, 3 Li + , 11 Na + и т. Д. Щелочноземельные металлы достигают конфигурации благородного газа, высвобождая свои два валентных электрона, а затем образуют двухвалентные катионы, например 4 Be ++ , 12 Mg ++ и т. Д. У галогенов, с другой стороны, отсутствует электрон для завершения октета. Поэтому они предпочтительно принимают один электрон, в результате чего образуются одновалентные анионы 9 F - , 17 Cl - и т. Д.
Между основными группами вставляется блок с подгруппами :
Подгруппы: внешние переходные металлы
В последние четыре периода заполнение соответствующей самой внешней основной оболочки было прервано, чтобы заполнить d -подоболочку второй самой внешней основной оболочки. Д подоболочки каждый трюм 10 электронов, так что дополнительный блок с 10 группами в этих четырех периодов. Все 40 элементов в этом d- блоке - металлы, их называют «внешними переходными металлами». Все они имеют два валентных электрона во внешней оболочке (исключения см. → принцип построения ) и поэтому имеют меньше различий в своем химическом поведении, чем элементы основной группы. Существующие различия связаны с различной электронной структурой следующей более низкой основной оболочки. В соответствии с повторяющимся рисунком заполнения, элементы в этом блоке также демонстрируют явное сходство по своим химическим свойствам.
Подгруппы: внутренние переходные металлы
В последние два периода заполнение d подоболочки второй самой внешней основной оболочки также прерывалось заполнением f подоболочек третьей самой внешней основной оболочки. Е подоболочки каждый трюм четырнадцать электронов, так что дополнительный блок с 14 группами в этих двух периодах. 28 элементов в этом f- блоке называются внутренними переходными элементами . У них есть два валентных электрона во внешней основной оболочке, один электрон в d -подоболочке предпоследней основной оболочки и различаются только степенью заполнения третьей от последней основной оболочки (исключения см. → принцип построения ). Соответственно, их химические различия невелики.
В 14 внутренние переходные металлы из 58 церия до 71 лютеция в шестом периоде после 57 лантана также называются лантаноиды . 14 внутренних переходных металлов, следующих за 89 актинием от 90 тория до 103 лоренсия в седьмом периоде, также называются актинидами .
Периодичность и тенденции
Некоторые свойства элементов систематически меняются в зависимости от их положения в периодической таблице. Если вы переходите от одной основной группы к другой в течение определенного периода («слева направо»), физические и химические свойства изменяются систематическим характерным образом, потому что количество валентных электронов увеличивается по одному за раз. В следующий период, если свойства определяются количеством валентных электронов, они повторяются аналогичным образом, потому что количество валентных электронов снова увеличивается таким же образом.
Если вы переходите от одного периода к другому в пределах основной группы («сверху вниз»), рассматриваемые свойства обычно похожи (одинаковое количество валентных электронов), но различаются по степени (разные основные оболочки как самая внешняя оболочка) .
Радиус атома
Атомный радиус обычно уменьшается в течение периода слева направо, потому что электроны втягиваются ближе и ближе к ядру , в связи с увеличением атомного номера . При переходе к следующему периоду радиус атома снова резко увеличивается, поскольку начинается заселение следующей внешней основной оболочки.
Внутри группы радиус обычно увеличивается сверху вниз, потому что в каждом случае добавляется основная оболочка.
Первая энергия ионизации
«Первая энергия ионизации » - это энергия, которая должна быть затрачена на удаление электрона из электронной оболочки, так что нейтральный атом становится просто положительно заряженным ионом . Отдельный валентный электрон щелочных металлов особенно слабо связан и легко отделяется. По мере того, как атомный номер увеличивается в течение периода, необходимо расходовать все большую энергию ионизации, пока она не достигнет максимального значения периода в случае благородного газа с его особенно стабильной конфигурацией октетов.
Электронное сродство
Сродство к электрону является энергией связи , которая высвобождается , когда атом связывает дополнительный электрон к себе, так что нейтральный атом становится просто отрицательно заряженными ионами. Галогены имеют особенно высокое сродство к электрону, потому что они могут завершить свой электронный октет, приняв электрон.
Электроотрицательность
Если два атома разных элементов химически связаны друг с другом, один из них обычно сильнее притягивает электроны общей электронной оболочки, так что центр тяжести электронной оболочки смещается в сторону этого атома. Способность атома притягивать электроны в связи измеряется его электроотрицательностью .
Электроотрицательность элементов основной группы увеличивается слева направо в течение периода, потому что заряд ядра увеличивается. Внутри группы он обычно растет снизу вверх, потому что в этом направлении уменьшается количество занятых основных оболочек, а вместе с ним и экранирование заряда ядра внутренними электронами. Элемент с наименьшей электроотрицательностью (0,7 по Полингу) - это цезий 55 , который расположен в нижнем левом углу периодической таблицы . Элемент с наибольшей электроотрицательностью (4,0 по Полингу) - это 9 фтор в правом верхнем углу , за ним следует его левый сосед, 8 кислорода (3,5). 1 Водород и полуметаллы занимают среднее положение со значениями около 2. Большинство металлов имеют значения около 1,7 или меньше.
Смещение центра тяжести заряда в молекуле зависит от разницы в электроотрицательности двух атомов. Чем больше смещается центр тяжести заряда, тем больше ионная часть связи, потому что электростатическое притяжение двух разнородных частичных зарядов вносит вклад в связь тем сильнее. Характер ионной связи особенно ярко выражен из-за описанной тенденции к электроотрицательности в связях, в которых один связывающий партнер находится слева, а другой - справа в периодической таблице. Примером этого является хлорид натрия .
Связи, в которых оба партнера происходят из левой половины таблицы Менделеева и, следовательно, оба принадлежат к металлам ( см. Ниже ), являются металлическими связями . Связи, в которых оба партнера происходят с правой стороны, в основном являются ковалентными связями .
Валентность
Одной из наиболее характерных черт элемента является его ценность , то есть его свойство объединяться с определенным предпочтительным числом атомов различных элементов- партнеров при образовании химического соединения.
Атом, у которого все еще отсутствует электрон для завершения октета валентного электрона, может связываться с одним атомом водорода 1 , чтобы использовать единственный валентный электрон водорода в общей электронной оболочке для завершения своего собственного октета. Атом, у которого все еще отсутствуют два электрона, будет иметь тенденцию связываться с двумя 1 атомами водорода. Как показывают эти примеры, обычно следует ожидать связи между предпочтительным количеством партнеров по связыванию и структурой валентной электронной оболочки, то есть группой, к которой она принадлежит в периодической таблице. Однако отношения часто намного сложнее, чем в приведенных здесь примерах.
Простая мера валентности элемента является числом 1 атомов водорода , что элемент связывается с собой в бинарном гидриде . Другая возможная мера - это удвоение числа 8 атомов кислорода, которые элемент связывает в своем оксиде .
Элементы первой и предпоследней основной группы (щелочные металлы или галогены) имеют валентность 1, поэтому их гидриды имеют формулы
- .
Элементы второй и третьей из последней основной группы (щелочноземельные металлы и кислородная группа) обычно имеют валентность 2, поэтому их гидриды имеют
- .
В других основных группах возможности связывания более разнообразны (существует бесчисленное множество углеводородных соединений), но встречаются также, например, в группе азота или группе углерода .
8 кислорода двухвалентные типичные оксиды одновалентных щелочных металлов, таким образом ,
и являются типичными оксидами двухвалентных щелочноземельных металлов
- ,
но есть и другие степени окисления . Последние три упомянутых оксида были отправной точкой для системы триад Доберейнера (см. Ниже).
Основность
Основность с оксидами и гидроксидами элементами возрастает от верха до низа , и уменьшается слева направо. Оксиды и гидроксиды металлов, растворенные в воде (см. Ниже), образуют щелочи , а оксиды и гидроксиды неметаллов, растворенные в воде, образуют кислоты .
Оксид кальция, растворенный в воде , например, образует известковую воду . Тот же результат получается при растворении гидроксида кальция в воде. Оба оксида натрия и гидроксид натрия результат раствора гидроксида натрия , растворенный в воде . Оба оксида калия и гидроксид калия результат раствора гидроксида калия , растворенный в воде .
Металлы из первой основной группы даже растворяются как элементы в воде и образуются в основных («щелочных») растворах. Поэтому их называют щелочными металлами. Например, растворенный в воде натрий 11 дает раствор гидроксида натрия 19, растворенный в воде калий дает раствор гидроксида калия.
Диоксид углерода является примером оксида неметалла, который при растворении в воде дает кислоту, а именно угольную кислоту . Другой пример - триоксид серы , водный раствор которого представляет собой серную кислоту .
Примеры дальнейших закономерностей
Наиболее реактивные элементы находятся в основных группах I и VII (щелочные металлы или галогены), потому что эти элементы имеют особенно сильную тенденцию отдавать (с щелочными металлами) или поглощать (с галогенами) электрон на полный октет электроны получить.
Энтальпия атомизации, то есть энергия, необходимая для разрушения молекулы E x, образованной из элемента E , демонстрирует четкую периодичность для элементов основной группы в зависимости от также периодической связности элементов, поскольку количество x связанных атомов зависит от этого. Энтальпия атомизации показывает минимумы для 0-валентных благородных газов и максимумы для четырехвалентных элементов основной группы IV.
Плотность основных элементов группы показывает тот же курс , потому что она тесно связана с связи соответствующего элемента: Щелочные металлы имеют особенно небольшие облигации и плотность, наибольшие значения для элементов средних групп.
Аналогичную картину можно увидеть в энтальпиях диссоциации молекул E 2 : минимумы снова относятся к благородным газам, максимумы теперь относятся к элементам основной группы V (N 2 , P 2 и т. Д.), Что соответствует возможным связям. с двухатомными молекулами.
Температуры плавления и кипения, теплоты плавления и испарения являются дополнительными примерами физических свойств элементов, которые демонстрируют периодическое поведение. Это касается даже соответствующих свойств простых бинарных соединений, например температуры плавления или теплоты плавления гидридов , фторидов , хлоридов , бромидов , йодидов , оксидов , сульфидов и так далее.
Металлы, полуметаллы и неметаллы
| H, C, N, P, O, S, Se, F, Cl, Br, I | Он, Ne, Ar, Kr, Xe, Rn | ||
| H, C, N, P, O, S, (Se) | F, Cl, Br, I, At | Он, Ne, Ar, Kr, Xe, Rn | |
| C, P, S, Se, I, At | Br | H, N, O, F, Cl, He, Ne, Ar, Kr, Xe, Rn | |
| H, C, P, S, Se, I | N, O, F, Cl, Br | Он, Ne, Ar, Kr, Xe, Rn | |
| C, P, S, Se | H, N, O, F, Cl, Br, I | Он, Ne, Ar, Kr, Xe, Rn | |
Подавляющее большинство элементов - металлы . Обычно они серебристые, блестящие, податливые, не очень летучие и проводят электричество и тепло. Металлический характер наиболее ярко выражен в элементах в нижнем левом углу таблицы Менделеева и уменьшается к верхнему правому углу. В этом направлении соединяются полуметаллы (матово-серые, блестящие, хрупкие, легколетучие, умеренно проводящие и теплопроводные). В правом верхнем углу таблицы Менделеева находятся неметаллы (цветные, не блестящие, хрупкие, в основном летучие, непроводящие и только с плохой теплопроводностью).
Таким образом, первые две основные группы (щелочные и щелочноземельные металлы) содержат только металлы, две последние основные группы (галогены и благородные газы) - только неметаллы. Граница между металлами и неметаллами, отмеченная полуметаллами, проходит по диагонали через средние основные группы, так что они обычно содержат неметаллы в верхней части, полуметаллы внизу и металлы в нижней части. Типичные полуметаллы содержат примерно 5 бор, 14 кремний или 32 германия. Элементы, расположенные на границе, могут даже менять свою принадлежность в зависимости от модификации : олово 50, лежащее на границе между металлами и полуметаллами, представляет собой металл как белое β-олово , а полуметалл как серый α-олово . Лежащий на границе между полуметаллами и неметаллами 6 углерод, чем графит , полуметалл, как алмаз , неметалл.
В V. и VI. Основная группа, переход, который происходит внутри группы, можно четко наблюдать: элементы 7 азот, 8 кислород и 16 сера в вышеперечисленных группах являются разными неметаллами. Второстепенные элементы 15 фосфор, 33 мышьяк и 34 селен встречаются как в неметаллических модификациях ( белый , красный и фиолетовый фосфор , желтый мышьяк , красный селен ), так и в полупроводниковых модификациях ( черный фосфор , серый мышьяк , серый селен ). Элементы 51 сурьма, 52 теллур, 83 висмут и 84 полоний в нижеследующих группах встречаются преимущественно в полуметаллической или металлической форме.
Типичные представители металлов в левой части таблицы Менделеева всегда имеют лишь небольшое количество валентных электронов и охотно от них отказываются (низкая энергия ионизации, см. Выше ), чтобы получить октет валентных электронов. Когда атомы металла объединяются, образуя металлическую решетку посредством химических связей, высвободившиеся валентные электроны образуют «электронный газ», который вмещает положительно заряженные атомы металла и удерживает их вместе. Это так называемая металлическая связь . Из свойств этого типа связки вытекают характерные свойства металлов, такие как их блеск или легкость деформируемости. В частности, большое количество свободно движущихся электронов приводит к высокой электропроводности.
Более сложные отношения
Особое положение элементов головы
В периодической таблице элементы расположены таким образом, что элементы, принадлежащие к группе, химически и физически похожи друг на друга. Степень сходства варьируется от случая к случаю, но заметно, что первые члены каждой основной группы («главные элементы» Li, Be, B, C, N, O, F) имеют меньшее сходство с остальными членами группы. члены их группы имеют чем эти соответственно между собой. Причины этого, помимо прочего, заключаются в том, что из-за малых атомных радиусов валентные электроны этих атомов особенно сильно связаны с ядрами, и что головные элементы, в отличие от других членов группы во внешней оболочке, не могут превышать электронный октет.
Пример этого особого положения является газообразной формой из 7 азота и 8 кислорода в отличии от других представителей соответствующей группы. Другим примером является тот факт, что элементы головки не могут иметь более высокую степень окисления, чем соответствует их валентная электронная структура. Таким образом, кислород 8 может принимать самое большее степень окисления +2, в то время как другие члены кислородной группы часто имеют степени окисления +4 и +6, которых они достигают за счет участия d- орбиталей, отсутствующих в кислороде в кислороде. соответствующая облигация.
Особое положение элемента головки особенно ярко выражено в блоке s периодической таблицы (особенно если считать 1 водород вместо 3 лития в качестве элемента головки), менее выраженное в блоке p , хотя оно присутствует, но только немного в блоке d и еще меньше в блоке f .
Косые отношения
Названные элементы заголовка больше похожи на элементы основной группы справа под ними в периодической таблице, чем на собственные члены группы, и поэтому являются примерами наклонных отношений . В частности, это относится к сходству между 3 литием и 12 магнием, 4 бериллием и 13 алюминием, 5 бором и 14 кремнием. Причина этого в том, что некоторые важные тенденции в свойствах элементов, таких как электроотрицательность, энергия ионизации или атомные радиусы, проходят снизу слева направо и, таким образом, «наклонно» в периодической таблице. Например, если вы переместитесь вниз по таблице Менделеева, то электроотрицательность уменьшится. Если двигаться вправо, он увеличивается. При движении вниз вправо эти две тенденции приблизительно нейтрализуют друг друга, а электроотрицательность изменяется лишь незначительно.
Еще одна косвенная связь - это теорема Гримма о сдвиге гидрида .
Рыцарские отношения
Необычные отношения между элементами являются отношениями рыцаря согласно Michael Laing , который характеризуется по аналогии с шахматным куском на рыцаре в том , что некоторые металлические элементы из четвертого периода в некоторых характеристиках (например , с температурой плавления точки и точкой кипения ) , имеют свойство , аналогичные свойства металлический. Имейте элемент на один период ниже и две группы справа. Примерами являются 30 цинка и 50 олова, которые имеют одинаковые свойства в сплаве с медью, в покрытии стали и в их биологической значимости в качестве микроэлементов . Другими примерами являются 48 кадмия и 82 свинца, 47 серебра и 81 таллий, 31 галлий и 51 сурьма.
Отношения между основной и подгруппами
Есть много общего между данной группой n и группой n + 10 на десять столбцов справа . Ярким примером являются 12 магния из второй и 30 цинка из двенадцатой группы, сульфаты, гидроксиды, карбонаты и хлориды которых ведут себя очень похоже. Другими отличными примерами являются 21 скандий из третьей группы и 13 алюминия из тринадцатой группы, а также 22 титана из четвертой группы и 50 олова из четырнадцатой группы. Только между щелочными металлами в первой группе и драгоценными металлами ( 29 медь, 47 серебра, 79 золота) в одиннадцатой группе нет никакого сходства.
В средней форме таблицы Менделеева, которая используется сегодня, эти отношения не очень очевидны. Однако они были хорошо известны пионерам периодической таблицы Менделеева, которые могли ориентироваться только на химическое сходство. Соотношения приводят к тому, что «длинные» периоды с четвертого по седьмой (без отдельно представленных лантаноидов и актинидов) имеют двойную периодичность: как их левая половина (до благородных металлов), так и их правая половина (до благородных газов). ) имеют Свойства, которые имеют тенденцию работать параллельно с основными группами в короткие периоды два и три.
Так называемая система коротких периодов принимает во внимание эти сходства, представляя два коротких периода второй и третий как закрытый блок (не разделенный на два, как в противном случае), в то время как она разделяет четыре длинных периода и перечисляет их левый и правый половинки в виде отдельных линий одна под другой. Для этого элементы групп железа, кобальта и никеля объединены в одну группу в каждом из длительных периодов, содержащих 18 элементов . Эти периоды затем можно разделить на две половины по восемь групп в каждой (одна из которых представляет собой группу из трех), которые расположены одна под другой в системе с коротким периодом. Таким образом, в короткопериодной системе всего 8 столбцов. Однако из-за наличия группы из трех человек, несмотря на восемь столбцов, переход к элементу на одну строку ниже соответствует переходу к элементам, расположенным на десять групп вправо в длинной форме . Исходные основные группы и подгруппы можно отличить по разному отступу.
Краткая форма периодической таблицы показывает, в частности, параллельный ход валентностей (точнее: максимальные степени окисления ) между вторичными и основными группами , который был утерян в длинных формах и сохранился только в форме групповой нумерации (см. следующий раздел). С другой стороны, краткая форма менее ясна, чем длинные формы, и также подчеркивает сходство между основной и подгруппами больше, чем они есть на самом деле.
Экскурс: нумерация групп
| 1 | 2 | 3 | 4-й | 5 | Шестой | 7-е | 8-е | 9 | 10 | 11 | 12-е | 13-е | 14-е | 15-е | 16 | 17-е | 18-е |
| да | IIa | IIIb | IVb | Vb | VIb | VIIb | VIIIb | Ib | IIb | IIIa | IVa | Ва | С помощью | VIIa | VIIIa | ||
| да | IIa | IIIa | IVa | Ва | С помощью | VIIa | VIIIa | Ib | IIb | IIIb | IVb | Vb | VIb | VIIb | VIIIb | ||
| ЧАС | Привет | ||||||||||||||||
| Ли | Быть | Б. | С. | N | О | Ф. | Нет | ||||||||||
| N / A | Mg | Al | Si | П. | С. | Cl | Ar | ||||||||||
| K | Приблизительно | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | В качестве | Se | Br | Kr |
| Руб. | Sr | Y | Zr | Nb | Пн | Tc | RU | Rh | Pd | Ag | CD | В | Sn | Sb | Te | Я. | Xe |
| CS | Ба | * | Hf | Та | W. | повторно | Операционные системы | Ir | Pt | Au | Эд | Tl | Pb | Би | По | В | Марг |
| Пт. | Ра | * | Rf | Db | Sg | Бюстгальтер | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Ур. | Ц | Выше |
Две из трех общих систем нумерации для групп восходят к групповому расположению в только что описанной системе коротких периодов.
Восемь групп короткопериодной системы пронумерованы римскими цифрами от I до VIII. Если снова разделить короткопериодную систему на длинную форму, главные элементы и элементы подгруппы, объединенные в группу краткой формы, должны быть снова разделены на две отдельные группы в длинной форме. Если вы хотите сохранить нумерацию групп в краткой форме, номер каждой группы удваивается. Чтобы различать, добавьте a или b к номеру группы.
В соглашении, которое в основном используется в США, элементы основной группы получают a, а элементы подгруппы - a b. Результатом является последовательность нумерации (основные группы выделены жирным шрифтом):
- Ia IIa IIIb IVb Vb VIb VIb VIIIb Ib IIb IIIa IVa Va VIa VIIa VIIIa
В конвенции, которая в основном используется в Европе, первой серии от I до VIII последовательно присваивается a, а второй - b. В результате получается последовательность нумерации
- Ia IIa IIIa IVa Va VIa VIIa VIIIa Ib IIb IIIb IVb Vb VIb VIIb VIIIb
Преимущество двух систем нумерации, полученных из краткой формы, состоит в том, что номер группы для основных групп идентичен количеству валентных электронов. Поэтому сразу очевидно, что, например, элементы основной группы IV имеют четыре валентных электрона.
ИЮПАК рекомендует номер группы последовательно арабскими цифрами от 1 до 18 Хотя эта нумерация прозрачна и однозначна, связь между номером группы и количеством валентных электронов теряется. Например, элементы с четырьмя валентными электронами находятся в группе 14.
Дополнительные влияния
Свойства неизвестных элементов можно приблизительно предсказать, если известны свойства окружающих элементов в периодической таблице. Однако регулярное изменение свойств внутри групп и периодов прерывается многочисленными исключениями, которые усложняют область химии. Чем выше атомный номер, тем менее подходящая систематика периодической таблицы для предсказания свойств материала, потому что более высокий заряд атомного ядра увеличивает скорость электронов вблизи ядра и, следовательно, релятивистские эффекты . В элементах, начиная с четвертого периода и далее, электроны самых внутренних оболочек (особенно s- орбиталей) перемещаются ближе к ядру атома из-за увеличения числа положительных зарядов в атомном ядре, что означает, что скорость этих электронов почти достигает скорость света . В результате, вопреки общей тенденции, радиус иона уменьшается, а энергия ионизации этих электронов увеличивается ( влияние пары инертных электронов ).
Радиоактивные элементы
Радиоактивные элементы отмечены как дополнительная информация, не имеющая ничего общего с электронной конфигурацией и, следовательно, с положением в PSE:
Элемент 82 (свинец) - последний элемент, в котором существуют стабильные, то есть нерадиоактивные изотопы. Все следующие (атомный номер 83 и выше) имеют только нестабильные и, следовательно, радиоактивные изотопы. 83 (висмут) - пограничный случай. В нем есть только нестабильные изотопы, в том числе один с чрезвычайно длинным периодом полураспада ( 209 Bi с a ). Также под элементом 82 находятся два элемента с исключительно нестабильными изотопами: 43 (технеций) и 61 (прометий).
Фактически остается только 80 стабильных элементов, которые встречаются в природе - все остальные радиоактивные элементы. Из радиоактивных элементов только висмут, торий и уран встречаются в природе в больших количествах, так как эти элементы имеют период полураспада порядка возраста Земли или дольше. За исключением одного изотопа плутония, все другие радиоактивные элементы являются либо, как и радий, промежуточными продуктами распада одной из трех естественных серий радиоактивных распадов, либо возникают в результате редких естественных ядерных реакций или спонтанного расщепления урана и тория. Элементы с порядковыми номерами выше 94 могут быть изготовлены только искусственно; Хотя они также образуются во время синтеза элементов в сверхновой , из-за их короткого периода полураспада, никаких следов их еще не было обнаружено в природе. Последним обнаруженным элементом является Оганессон с порядковым номером 118, но его период полураспада составляет всего 0,89 мс. Предположительно существует остров стабильности с более высокими порядковыми номерами .
Атомные массы
Поскольку количество протонов в атомном ядре идентично атомному номеру , атомная масса увеличивается с атомным номером. В то время как атомный номер увеличивается на одну единицу от одного элемента к другому, увеличение атомной массы происходит гораздо более неравномерно.
Масса протона составляет 1,0073 атомных единиц массы (1 u = 1,66 · 10 −27 кг), масса нейтрона 1,0087 u. По сравнению с этим , масса электрона 0,0005 u в основном незначительна. Масса атома водорода, состоящего из одного протона и одного электрона, равна 1,0078 ед. хорошее приближение, которое соответствует округленному числу протонов и нейтронов, содержащихся в ядре (атомные массы обычно немного меньше целого числа, « дефект массы » соответствует энергии связи, выделяющейся при образовании ядра). Однако в явном противоречии с этим некоторые массовые характеристики в периодической таблице значительно отличаются от целых чисел. Например, для хлора указано значение 35,45 ед.
| Эле- Мент |
Массовое число (изотоп) |
Природное изобилие |
Атомная масса (u) |
Средняя атомная масса (u) |
|---|---|---|---|---|
| ... | ... | ... | ... | ... |
| 15 п. | 31 год | 100% | 30,97 | 30,97 |
| 16 п. | 32 | 95,02% | 31,97 | 32.06 |
| 33 | 0,75% | 32,97 | ||
| 34 | 4,21% | 33,97 | ||
| 36 | 0,02% | 35,97 | ||
| 17 сл | 35 год | 75,77% | 34,97 | 35,45 |
| 37 | 24,23% | 36,97 | ||
| 18 соток | 36 | 0,337% | 35,97 | 39,95 |
| 38 | 0,063% | 37,96 | ||
| 40 | 99,600% | 39,96 | ||
| ... | ... | ... | ... | ... |
Причина этого в том, что два атома с одинаковым количеством протонов могут иметь разное количество нейтронов. Такие атомы имеют одинаковый атомный номер и, следовательно, одинаковое химическое поведение, поэтому по определению принадлежат к одному и тому же химическому элементу и, следовательно, находятся в одном месте в периодической таблице. Но поскольку у них разное количество нейтронов, они являются разными « изотопами » этого элемента (от древнегреческого ἴσος ísos «равный» и τόπος topos «место, место»).
20 элементов
состоят только из одного встречающегося в природе изотопа, они являются чистыми элементами . Остальные элементы - это смешанные элементы ; в их естественном возникновении они состоят из смеси различных изотопов. Для этих смешанных элементов средняя атомная масса смеси изотопов природного происхождения вводится в периодическую таблицу . Встречающийся в природе хлор, например, состоит из 75,77% изотопа хлора с массовым числом 35 (с 17 протонами и 18 нейтронами в ядре) и 24,23% изотопа хлора 37 (17 протонов и 20 нейтронов). Его средняя атомная масса - это средневзвешенная частота (почти целых) атомных масс 34,97 мкм и 36,97 мкм, то есть вышеупомянутые 35,45 мкм.
Если изотопы двух последовательных элементов в периодической таблице имеют очень разные распределения частот, может случиться так, что средняя атомная масса уменьшается от одного элемента к другому. Таким образом, калий 19, следующий за 18 аргоном, имеет более высокий атомный номер, но меньшую среднюю атомную массу. То же самое относится к 27 кобальту и 28 никелю, 52 теллуру и 53 йоду, а также 90 торию и 91 протактинию.
Поскольку атомная масса (за исключением упомянутых исключений) довольно регулярно растет вместе с порядковым номером, в 19 веке их можно было успешно использовать в качестве основы для поиска закономерностей вместо фактического принципа порядка, пока неизвестного порядкового числа. .
история

элементы
В Древней Греции и Древнем Китае более 2000 лет назад предполагалось, что множество явлений в природе можно проследить до небольшого числа «элементов». В Греции Эмпедокл представлял на учение о четырех элементов с элементами огня , воды , земли и воздуха . В Китае в учении пяти элементов присутствовали элементы дерева , огня, земли, металла и воды.
Современное представление об элементе как о субстанции, которая не может быть далее разбита, восходит к Иоахиму Юнгиусу и Роберту Бойлю . В 1789 году Антуан Лоран де Лавуазье представил первую систематическую таблицу, содержащую 33 записи с предполагаемыми «простыми веществами», из которых 21 фактически уже были элементами в сегодняшнем смысле. Однако по-прежнему существовала полная неуверенность в отношении внутренней структуры элементов и, следовательно, всего значения в целом. Согласно атомной гипотезе Джона Дальтона (1808 г.), все вещества состоят из мельчайших неделимых «атомов», при этом атомы одного химического элемента идентичны друг другу, но отличаются по форме и весу от атомов другого элемента. Согласно этой гипотезе, химические реакции следует рассматривать как перегруппировку неразрушимых атомов, и законы постоянных пропорций и множественных пропорций также могут быть легко объяснены. Хотя многие химики приняли атомы в качестве рабочей гипотезы, доказательств их существования не было.
Атомные массы
Хотя плотность различных элементов была известна в течение длительного времени, отсутствие знаний о количестве и размере атомов сделало невозможным определение их абсолютных масс. Дальтон уже составил 14-элементный и все еще довольно неточный список соотношений между атомными массами, основанный на постоянных пропорциях.
Уильям Праут заметил, что многие атомные массы примерно кратны атомной массе водорода, и в 1815 году он выдвинул гипотезу, что все элементы состоят из соответствующих количеств водорода как «исходного вещества». Атомные массы, ранее указанные как нецелые числа, оказались бы целыми числами, если бы были проведены более точные измерения. Гипотеза Праута привела к более точным определениям массы, в основном Йенсом Якобом Берцелиусом и Жаном Серве Стасом , которые подтвердили нецелочисленную природу многих атомных масс и, таким образом, опровергли гипотезу Праута, но также послужили основой для более надежных исследований, поскольку они значительно улучшились. точность. Причина поразительно большого числа элементов с приблизительно целыми атомными массами оставалась неясной.
В 1850 - х годах нападения Канниццары от Амедео Авогадро составлено в 1811 году, но до сих пор остается незамеченной гипотеза еще раз , что равные объемы различных газов содержат при той же температуре и давлении, то же число частиц. Эта гипотеза позволила систематически сравнивать массы равных (хотя и неизвестных) чисел атомов в газообразных соединениях и определять относительные атомные массы элементов относительно эталонного элемента. С их помощью можно было скорректировать и многочисленные ранее неправильно принятые пропорции в химических соединениях. На этой основе Канниццаро опубликовал более надежные и последовательные атомные массы между 1858 и 1860 годами в рамках подготовки к Конгрессу в Карлсруэ (на котором также присутствовали Мейер и Менделеев), который позволил быстро развить периодические системы в 1860-х годах.
Предшественник периодической таблицы
В начале XIX века искали закономерности во взаимоотношениях элементов. Препятствиями были, среди прочего, неопределенность атомной массы и тот факт, что многие элементы даже не были известны. Дёберейнер впервые установил связь между атомной массой и химическими свойствами отдельных элементов. В 1824 году Фалькнер опубликовал систему семейств природных элементов. В 1843 году Гмелин создал табличную сортировку элементов. Другими пионерами, которые также знали Менделеева, были Петтенкофер (1850 г.), Одлинг (1857 г.), Дюма (1858 г.) и Ленсен (1857 г.). В 1862 году Шанкуртуа разработал трехмерное изображение, в котором он расположил элементы по спирали на цилиндре в соответствии с возрастающими атомными массами. Были сделаны также попытки по Hinrichs (1864), Baumhauer (1867 г.) и Quaglio (1871 г.) , чтобы изобразить систему в виде спирали. В 1863/64 Ньюлендс составил таблицу элементов в группах по восемь (закон октав), упорядоченную в соответствии с атомной массой.
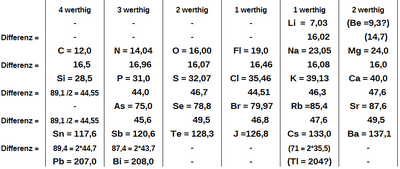
Иоганн Вольфганг Дёберейнер (Система триад)
Иоганн Вольфганг Дёберейнер сделал первую попытку организовать элементы в соответствии с признанными законами. В 1817 году он определил молекулярную массу оксида стронция и нашел (в используемой им системе масс) значение 50. Доберейнер заметил, что это в точности среднее арифметическое масс оксида кальция (27,5) и оксида бария (72,5):
Из этого он первоначально сделал подозрение, что стронций состоит из бария и кальция, которое он не нашел подтвержденным в соответствующих экспериментах.
С современной точки зрения, кальций, стронций и барий - три элемента из группы щелочноземельных металлов, которые находятся один под другим в периодической таблице, что объясняет их идентичные валентности и, следовательно, их сходство в образовании оксидов . Поскольку длина периода в этой области периодической таблицы составляет 18 элементов (период здесь включает восемь основных групп и десять подгрупп), они показывают одинаковую разницу в порядковых числах между собой (18, Доберейнер все еще неизвестен):
и, следовательно, примерно такая же разница в атомных массах (чуть меньше 50 u).
В 1827 году Леопольд Гмелин в своем «Handbuch der Theoretischen Chemie» (Справочник по теоретической химии) отметил «некоторые странные отношения с атомными массами, которые, несомненно, связаны с самой внутренней природой веществ». Среди прочего, он указал на еще одно. группа из трех, а именно литий, натрий и калий. Если взять среднее арифметическое атомных масс лития и калия, «можно получить довольно точно [атомную массу] натрия, который входит в химические отношения между двумя упомянутыми металлами».
| ЧАС | Привет | ||||||||||||||||
| Ли | Быть | Б. | С. | N | О | Ф. | Нет | ||||||||||
| N / A | Mg | Al | Si | П. | С. | Cl | Ar | ||||||||||
| K | Приблизительно | ... | Ga | Ge | В качестве | Se | Br | Kr | |||||||||
| Руб. | Sr | ... | В | Sn | Sb | Te | Я. | Xe | |||||||||
| CS | Ба | ... | Tl | Pb | Би | По | В | Марг | |||||||||
| Пт. | Ра | ... | Nh | Fl | Mc | Ур. | Ц | Выше | |||||||||
| Положение четырех триад в современной периодической таблице | |||||||||||||||||
В 1829 г. Дёберейнер опубликовал более подробную «попытку сгруппировать элементарные вещества по их аналогии». Недавно обнаруженная триада содержала «три солеобразователя» с хлором и йодом, а также бром, который был выделен только в прошлом году. Сравнение с использованием атомных масс, определенных Берцелиусом, дало
Другая недавно обнаруженная триада включала серу, селен и теллур, которые «соединяются с водородом с образованием своеобразных водородных кислот»:
В своих попытках упорядочить Доберейнер придавал большое значение тому факту, что элементы, объединенные в триаду, на самом деле демонстрировали химическое сходство: «Тот факт, что среднее арифметическое атомных весов кислорода = 16,026 и углерода = 12,256 выражает атомный вес азота = 14.138, здесь не может быть и речи, потому что между этими тремя субстанциями нет аналогии ». Он также настаивал на особом значении числа три. Элементы железо, марганец, никель, кобальт, цинк и медь, которые очень похожи друг на друга, представляли для него проблему, потому что «как они должны быть расположены, если триада принята как принцип группирования?»
| О | N | ЧАС | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ф. | Cl | Br | J | Л. | N / A | K | |||||||||||
| С. | Se | Te | Mg | Приблизительно | Sr | Ба | |||||||||||
| П. | В качестве | Sb | грамм | Y | Ce | Ла | |||||||||||
| С. | Б. | Si | Zr | Чт | Al | ||||||||||||
| Ti | Та | W. | Sn | CD | Zn | ||||||||||||
| Пн | V | Cr | U | Mn | Co | Ni | Fe | ||||||||||
| Bi Pb Ag Hg Cu | |||||||||||||||||
| Os Ir R Pt Pd Au | |||||||||||||||||
В 1827 году Гмелин показал известный тогда 51 элемент по отдельности в V-образном расположении, чтобы ясно показать их «взаимосвязь и различие», главным образом для того, чтобы суммировать три элемента, которые, в свою очередь, были расположены «в соответствии с их сходством» в V-образной форме. схема в порядке увеличения электроположительности. Сегодняшние основные группы можно распознать в некоторых группах Гмелина ( R = родий, сегодня Rh; L = литий, сегодня Li; G = глиций, сегодня бериллий Be).
В 1857 году Эрнст Ленсен смог разделить практически все известные в то время элементы на 20 триад (но был менее строг, чем Дёберейнер в отношении химического сходства). Он даже объединил группы из трех триад, чтобы сформировать «эннеады» (группы из девяти), в которых атомные массы соответствующих средних триад, в свою очередь, были связаны правилом среднего значения. Используя свою систему, он предсказал, среди прочего, атомные массы элементов эрбия и тербия, которые уже были открыты, но еще не изолированы, но ни одно из его предсказаний не было успешным. Он также попытался установить связь с другими физическими и химическими свойствами.
Джон А. Р. Ньюлендс (Закон октав)
Предыдущие попытки упорядочения в значительной степени ограничивались поиском изолированных групп со схожими элементами. В 1864 году Джон Александр Рейна Ньюлендс опубликовал таблицу с 24 элементами (и местом для якобы неоткрытого элемента), в которой элементы были расположены, как обычно, в порядке возрастания атомных масс, но в которой он не ссылался на закономерности в атомной структуре. массовые различия, но указали на повторяющиеся различия в позициях одинаковых элементов. Это была первая периодическая система , набор элементов, показывающий, что свойства элементов повторяются через определенные регулярные промежутки времени. Ньюлендс был также первым, кто поменял местами элементы йода и теллура на основе атомной массы и предпочел порядок, основанный на химических свойствах.
В 1865 году Ньюлендс разработал другую систему, которая теперь включала 65 элементов. Предполагалось, что химические свойства повторяются в каждой восьмой позиции, которую он сравнил с октавами в музыке. (Поскольку благородные газы еще не были открыты, длина периода в первых периодах таблицы Ньюленда составляла фактически семь элементов. Но поскольку он считал оба одинаковых элемента, точно так же, как октава в музыке, например, от C до отсчета следующего C включительно, дает длину периода 8.)
Ньюлендс назвал эту взаимосвязь между элементами «законом октав», что было первым случаем, когда повторение в свойствах элемента считалось законом природы. Закон октав можно полностью применить к первым двум периодам, но поскольку тогда (как мы знаем сегодня) периоды стали длиннее, закон был менее успешным в следующие периоды.
Первое точное предсказание еще не открытого элемента восходит к Ньюлендсу: из-за пробела в одной из своих таблиц он предсказал существование элемента с атомной массой 73 между кремнием и оловом в 1864 году. В заявленном положении и с атомной массой 72,61 это соответствует германию, который был открыт в 1886 году. Однако его предсказания относительно еще неизвестных элементов между родием и иридием, а также между палладием и платиной не оправдались.
Открытие периодичности иногда приписывают Александру-Эмилю Бегуе де Шанкуртуа , который в 1862 году расположил элементы в соответствии с возрастающей атомной массой вдоль трехмерного винта так, чтобы один оборот винта соответствовал 16 единицам, то есть элементам на расстоянии 16 единиц. встали вертикально друг на друга. Однако его система осталась незамеченной, и он не стал ее развивать.
Дмитрий Менделеев и Лотар Мейер (Периодическая таблица)
Современная таблица Менделеева была разработана Лотаром Мейером и Дмитрием Ивановичем Менделеевым . Оба опубликовали свои результаты в 1869 году и вместе получили медаль Дэви Британского королевского общества за свою работу в 1882 году .
Менделеев упоминается чаще, чем Мейер, как основатель современной таблицы Менделеева. С одной стороны, потому что периодическая таблица Мейера была опубликована несколькими месяцами позже, с другой стороны, потому что Менделеев сделал предсказания о свойствах еще не открытых элементов. В России таблица Менделеева до сих пор называется Таблиза Менделеева («таблица Менделеева»). Ни Менделеев, ни Мейер не знали друг друга о работе над периодической таблицей. Менделееву также были неизвестны произведения Бегуайе де Шанкуртуа 1862 года, Ньюлендса 1863/64 или Хинрихса 1866/67.
Лотар Мейер
В своем учебнике «Die modern Theorien der Chemie» , опубликованном в 1864 году, Мейер уже представил таблицу, содержащую 28 элементов, расположенных в соответствии с возрастающими атомными массами. Разделение на строки было сделано таким образом, что каждый столбец (соответствующий сегодняшним основным группам) содержал элементы одного и того же значения, а значение изменялось на одну единицу от одного столбца к другому. Мейер указал, что разница в атомной массе между первым и вторым элементами каждого столбца составляет около 16, следующие две разности колеблются в районе 46, а последняя разница всегда составляет примерно 87-90. Он предположил, что это может - подобно гомологическим сериям молекул - указывать на систематическую структуру атомов из более мелких компонентов.
Мейер поменял местами теллур и йод в соответствии с их химическими свойствами в соответствии с последовательностью, основанной на атомных массах. Мейеру пришлось оставить в таблице несколько пробелов, в том числе один между кремнием и оловом, в котором, согласно его разностной схеме, должен был ожидаться элемент с атомной массой 73. Недостающим элементом был германий, открытый в 1886 году, с атомной массой 72,61. Другая таблица, не упорядоченная по атомной массе, содержала 22 элемента, которые Мейер не включил в свою схему - они соответствуют сегодняшним переходным металлам.
В 1870 году (представленный в декабре 1869 года, всего через год после первой публикации Менделеева периодической таблицы) Мейер опубликовал расширенную версию своей таблицы, в которой, используя обновленные атомные массы, ему удалось «расположить все элементы, известные на сегодняшний день, в та же схема ». Точки в этой системе располагались вертикально, группы - горизонтально. Переходные металлы (еще не так называемые) стали частью таблицы. Подобно короткопериодной системе, они были организованы в периоды, чередующиеся с (еще не так называемыми) основными группами.
Чтобы проиллюстрировать изменение свойств по периодам, Мейер добавил диаграмму, которая показывает периодически изменяющиеся атомные объемы в зависимости от атомной массы (аналогично диаграмме в разделе « Атомные радиусы» ). Эта иллюстрация внесла значительный вклад в принятие периодической таблицы Менделеева. Мейер обсудил различные физические свойства атомов, которые расположены параллельно атомным объемам и, следовательно, также являются периодическими, такие как плотность, летучесть, пластичность, хрупкость или удельная теплоемкость.
Дмитрий Менделеев
Имя Менделеева в основном связано с периодической таблицей в ее нынешнем виде. Его периодическая таблица была более полной, чем другие системы того времени, он активно продвигал и защищал свою систему, работал над ней десятилетиями и использовал ее для гораздо более обширных и подробных предсказаний, чем другие авторы периодических систем.
В поисках структуры для своего учебника химии Менделеев создал Jul. / 1 March, 1 869 Greg. первый набросок его версии таблицы Менделеева. В марте он опубликовал свою систему с подробным объяснением в журнале Русского химического общества.
Он прямо указал, что большинство свойств элементов не подходят в качестве четкого принципа упорядочения. Например, большинство элементов могут иметь разные значения. Большинство свойств свободных элементов зависит от присутствующей модификации (например, графит и алмаз являются модификациями углерода со значительно разными свойствами) и так далее. Единственное однозначное и численно измеряемое свойство элемента, которое сохраняется во всех модификациях свободного элемента, а также во всех его соединениях, - это его атомная масса (атомный номер как другое такое свойство еще не был известен Менделееву).
Он расположил элементы «природных групп», уже известных как принадлежащие друг другу (такие как галогены, щелочноземельные металлы, азотная группа и т. Д.), В соответствии с их атомной массой и обнаружил, что это расположение соответствует «преобладающему естественному сходству». среди элементов "без посторонней помощи. Он заявил: «Элементы, расположенные в соответствии с размером их атомного веса, демонстрируют четкую периодичность своих свойств», и на этом основании попытался вписать другие элементы в схему в соответствии с их химическим поведением.
В этой статье Менделеев уже предсказал существование двух новых элементов с атомными массами от 65 до 75, которые должны были напоминать алюминий и кремний, исходя из зазоров, оставшихся в его системе. Как и некоторые из его предшественников, Менделеев также поменял местами теллур и йод в соответствии с последовательностью, полученной из атомных масс. Однако его предсказание о том, что атомная масса теллура должна быть скорректирована, потому что, согласно его системе, она не может быть 128, а скорее должна быть между 123 и 126, не сбылось - здесь на самом деле наблюдается неравномерность атомных масс. В том же году были опубликованы два кратких описания новой системы на немецком языке.
В 1871 году появилась обширная статья, в которой Менделеев представил две дальнейшие версии своей периодической таблицы. Одним из таких вариантов была первая короткопериодная система. В этой статье он продемонстрировал, среди прочего, как атомную массу элемента можно определить или скорректировать с помощью таблицы Менделеева, если его химическое поведение было известно. В статье также содержатся три самых известных предсказания о свойствах еще неизвестных элементов, существование которых Менделеев обнаружил из оставшихся пробелов в своей периодической таблице. Путем умной интерполяции между физическими и химическими свойствами соседних элементов он смог точно предсказать многочисленные свойства еще неизвестных элементов.
Менделеев назвал неизвестные элементы в честь элемента над соответствующим пробелом в своей системе коротких периодов с добавлением префикса Eka ( санскрит: «один»). Экаалюминий был открыт Полем Эмилем Лекоком де Буабодраном в 1875 году и назван галлием в честь Франции, страны открытий . Экабор был открыт Ларсом Фредриком Нильсоном в 1879 году и получил название Скандинавия после Скандинавии. Ecasilicon был открыт Клеменсом Винклером в 1886 году и был назван германием в честь страны открытия, Германии .
| элемент | окись | хлористый | Этиловое соединение | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Атомная масса |
Плотность (г / см³) |
Нагревательный колпачок. Дж / (кг · К) |
цвет | формула | Плотность (г / см³) |
формула | Кипение точка |
Плотность (г / см³) |
формула | Кипение точка |
|
| прогноз | 72 | 5.5 | 306 | темно-серый | EsO 2 | 4,7 | EsCl 4 | 100 ° С | 1.9 | Es (C 2 H 5 ) 4 | 160 ° С |
| нашел | 72,32 | 5,47 | 318 | серо-белый | GeO 2 | 4,703 | GeCl 4 | 86 ° С | 1887 | Ge (C 2 H 5 ) 4 | 160 ° С |
Не все предсказания Менделеева оказались успешными. В целом, только половина его предсказаний относительно новых элементов оказалась верной.
Благородный газ аргон, открытый в 1894 году, по-видимому, представлял серьезную угрозу для общей достоверности периодической таблицы Менделеева, поскольку его нельзя было интегрировать в существующую систему. Однако, когда в быстрой последовательности были обнаружены другие благородные газы (гелий 1895 г., неон 1898 г., криптон и ксенон, радон 1900 г.), стало ясно, что периодическую таблицу нужно было только расширить, включив в нее новую группу элементов между галогенами и щелочами. металлы, чтобы иметь возможность включить их все. Менделеев говорил о «критическом испытании», которое его таблица Менделеева «блестяще выдержала».
Менделеев опубликовал около тридцати вариантов периодической таблицы Менделеева за эти годы, и еще тридцать доступны в рукописи. Самая старая сохранившаяся доска в периодической таблице датируется 1879–1886 гг. И находится в Университете Сент-Эндрюс .
| Таблица Менделеева, 1869 г. | Современная таблица Менделеева по урану, устроенная по схеме Менделеева | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| СБН = 45 | Y = 89 | Ла - Лу | Ac, Th, Па, U | |||||||||||
| Ti = 50 | Zr = 90 | ? = 180 | Ti = 48 | Zr = 91 | Hf = 178 | |||||||||
| V = 51 | Nb = 94 | Ta = 182 | V = 51 | Nb = 93 | Ta = 181 | |||||||||
| Cr = 52 | Пн = 96 | Вт = 186 | Cr = 52 | Пн = 96 | W = 184 | |||||||||
| Mn = 55 | Rh = 104,4 | Pt = 197,4 | Mn = 55 | Тс = 97 | Re = 186 | |||||||||
| Fe = 56 | Ru = 104,4 | Ir = 198 | Fe = 56 | Ru = 101 | Os = 190 | |||||||||
| Ni = 59 Co = 59 |
Pd = 106,6 | Os = 199 | Co = 59 | Rh = 103 | Ir = 192 | |||||||||
| Ni = 59 | Pd = 106 | Pt = 195 | ||||||||||||
| H = 1 | Cu = 63,4 | Ag = 108 | Hg = 200 | Cu = 64 | Ag = 108 | Au = 197 | ||||||||
| Be = 9,4 | Mg = 24 | Zn = 65,2 | Cd = 112 | Zn = 65 | Cd = 112 | Hg = 201 | ||||||||
| В = 11 | Al = 27,4 | ? = 68 | Ur = 116 | Au = 197? | В = 11 | Al = 27 | Ga = 70 | В = 115 | Tl = 204 | |||||
| С = 12 | Si = 28 | ? = 70 | Sn = 118 | С = 12 | Si = 28 | Ge = 73 | Sn = 119 | Pb = 207 | ||||||
| N = 14 | P = 31 | As = 75 | Сб = 122 | Би = 210? | N = 14 | P = 31 | As = 75 | Сб = 122 | Би = 209 | |||||
| O = 16 | S = 32 | Se = 79,4 | Те = 128? | O = 16 | S = 32 | Se = 79 | Те = 128 | Po = 209 | ||||||
| F = 19 | Cl = 35,5 | Br = 80 | J = 127 | F = 19 | Cl = 35 | Br = 80 | I = 127 | При = 210 | ||||||
| Li = 7 | Na = 23 | К = 39 | Rb = 85,4 | Cs = 133 | Tl = 204 | Он = 4 | Ne = 20 | Ar = 40 | Kr = 84 | Хе = 131 | Rn = 222 | |||
| Ca = 40 | Sr = 87,6 | Ba = 137 | Pb = 207 | H = 1 | Li = 7 | Na = 23 | К = 39 | Rb = 85 | Cs = 133 | Пт = 223 | ||||
| ? = 45 | Ce = 92 | Be = 9 | Mg = 24 | Ca = 40 | Sr = 88 | Ba = 137 | Ra = 226 | |||||||
| ? Он = 56 | La = 94 | |||||||||||||
| ? Yt = 60 | Di = 95 | |||||||||||||
| ? В = 75,6 | Чт = 118? | |||||||||||||
Цвета указывают на текущее назначение элементов:
Щелочные металлы, Щелочноземельные металлы, 3-я основная группа, 4-я основная группа, 5-я основная группа,6-я основная группа, Галогены, благородные газы, Переходные металлы, Лантаноиды, Актиниды. Предполагаемый элемент дидимий (Di) позже оказался смесью редкоземельных элементов празеодима и неодима. Чтобы преобразовать современную таблицу Менделеева, показанную справа, в обычную сегодня, последние две строки должны быть добавлены вверху, сдвинуты на одну рамку вправо, и вся система будет отражена по диагонали. сверху слева направо снизу. В представленной современной периодической таблице атомные массы для ясности округлены до целых чисел.
Анри Беккерель (радиоактивность)
Анри Беккерель обнаружил в 1896 году, что уран испускает ранее неизвестное излучение. Урановый минеральный настуран испускал значительно больше радиации, чем могло бы соответствовать содержанию урана. Мари и Пьер Кюри открыли новые радиоактивные элементы полоний и радий в настуране в 1898 году. Они также признали элемент торий радиоактивным.
Эрнест Резерфорд (атомное ядро)
Джозеф Джон Томсон установил в 1897 году, что катодные лучи, наблюдаемые в газоразрядных трубках, были частицами легкого материала, а не волнами эфира. Томсон смог определить отношение заряда e / m к массе частиц, называемых «электронами», и обнаружил, что это не зависит от материала катода, наполняющего газа и других обстоятельств, что электроны, по-видимому, являются универсальными компонентами атомов. В 1904 году Томсон создал модель сливового пудинга , согласно которой электроны были заключены в однородно положительно заряженную сферу.
При исследовании радиоактивных веществ можно было выделить разные типы излучения: отклонение в магнитном поле показало, что проникающие бета-лучи имеют отрицательный заряд; В конце концов Беккерель идентифицировал их как электроны. Эрнест Резерфорд и Томас Ройдс установили в 1908 году, что менее проникающее альфа-излучение представляет собой дважды положительно заряженные ионы гелия.
Эксперименты Резерфорда по рассеянию , в которых он бомбардировал металлическую фольгу альфа-частицами, показали в 1911 году, что положительные заряды атомов сосредоточены в небольшом ядре, а электроны расположены вне ядра - однако их расположение и количество были все еще неизвестны.
Генри Мозли (порядковый номер)
Анализ его экспериментов по рассеянию был Резерфорд завершена в 1911 году , чтобы определить , что положительный заряд ядра примерно соответствует половине атомной массы: . Антониус ван ден Брук указал, что атомная масса увеличивается на две единицы от одного элемента к другому, то есть, согласно формуле Резерфорда, количество зарядов в ядре увеличивается на одну от одного элемента к другому. Таким образом, количество возможных элементов равно количеству возможных ядерных зарядов, и каждый возможный ядерный заряд соответствует возможному элементу. Атомный номер также определяет положение каждого элемента в периодической таблице. (Увеличение атомной массы на две единицы является лишь грубым приближением; здесь на Ван ден Брука повлияло его предположение, что все атомы состоят из половины альфа-частиц с массовым числом 2.)
Генри Мозли подтвердил, что атомный номер (также: атомный номер) является более подходящим принципом упорядочения элементов, чем атомная масса. Он воспользовался тем фактом, что материалы, бомбардируемые электронами, испускают не только тормозной спектр (Röntgen 1895), но также рентгеновские лучи с длиной волны, характерной для материала ( Barkla , ок. 1906 ), и что длину волны этого излучения можно определить. с помощью дифракции на кристаллах ( фон Лауэ 1912). Мозли определил длины волн характеристического излучения различных элементов и обнаружил, что частоты этих излучений были пропорциональны квадрату целого числа, описывающего положение рассматриваемого элемента в периодической таблице ( закон Мозли ). Он узнал это число как количество зарядов в ядре. Это позволяло легко определять атомный номер элемента экспериментально.
Мозли продемонстрировал, что многие из 70 или около того недавно открытых элементов, которые боролись за заполнение 16 пробелов в периодической таблице Менделеева, не могли существовать, потому что для них не было места в сетке порядковых номеров.
Десять добрых « редкоземельных элементов » (их точное количество в то время не было известно) трудно разделить химически, потому что они очень похожи друг на друга. Менделеев не нашел для них места в своей схеме. Порядковый номер Мозли четко обозначил им места с 57 по 71.
Пионерам периодической таблицы приходилось исправлять случайные массовые инверсии (например, между йодом и теллуром), заменяя соответствующие элементы в схеме атомных масс, не имея возможности объяснить это, за исключением того, что они лучше вписывались в схему. химического сходства. Атомный номер Мозли подтвердил правильный порядок обмениваемых элементов; атомные массы здесь вводили в заблуждение.
Когда разразилась Первая мировая война , Мозли пошел добровольцем на военную службу и пал в битве при Галлиполи . Последователи Мозли завершили систематические измерения и определили, что уран (самый тяжелый из известных на тот момент элемент) имеет атомный номер 92, то есть ровно 92 элемента в ряду элементов от водорода до урана. Были обнаружены пробелы в порядковых номерах 43, 61, 72, 75, 85, 87 и 91, которые могут быть заполнены в следующие десятилетия соответствующими новыми открытиями.
Фредерик Содди (изотопы)
В 1902 году Эрнест Резерфорд и Фредерик Содди определили, что радиоактивные элементы не только испускают излучение, но и состоят из нестабильных атомов, которые спонтанно превращаются в новые элементы с испусканием альфа-, бета- или гамма- излучения - в явном противоречии с тем, что ранее предполагалось неделимым. и неизменность атомов. Начиная с актиния ( Debierne 1899), после полония и радона было быстро обнаружено множество других радиоактивных веществ (в 1912 году их число выросло до 30). Новые вещества изначально рассматривались как отдельные элементы, и казалось, что таблица Менделеева не может вместить их все. Однако оказалось, что почти все они химически неотличимы от элементов, которые уже были известны и как таковые уже имели место в периодической таблице. Например, продукт распада, первоначально названный «радий D» , нельзя было отличить от свинца. С другой стороны, точные определения атомной массы показали, что образцы свинца из разных источников могут иметь разные атомные массы. Теодор Уильям Ричардс нашел атомную массу 206,4 для свинца, сделанного из урановой обманки, и 208,4 для свинца, сделанного из торита .
Из нескольких подобных случаев в 1911 году Содди сделал вывод, что один и тот же элемент может быть смесью различных атомных масс, и в 1913 году он ввел термин «изотопы» для атомов с одним и тем же атомным номером, но с разными массовыми числами. Содди и Казимир Фаянс установили теоремы смещения, согласно которым атом данного элемента теряет два ядерных заряда, когда испускается альфа-частица, и переносится на элемент, который находится на два места левее в периодической таблице, а один - когда испускается бета-частица. Поместите правее. Что касается элементов между свинцом и ураном, было очевидно, почему они могут существовать с разными атомными массами. Атом тория (атомный номер 90) может, например, образоваться из урана-235 (атомный номер 92) в результате альфа-распада, а затем иметь массу 231. Однако он также может возникнуть в результате бета-распада актиния-230. (атомный номер 89), а затем имеет массу 230. Содди смог предсказать массовое число 206 для свинца из урановых руд и массовое число 208 для свинца из ториевых руд еще до того, как Ричардс представил результаты своих измерений.
В 1920-х годах большое количество вновь открытых изотопов ввергло периодическую таблицу в кризис, поскольку казалось, что вместо элементов нужно было систематизировать гораздо большее количество изотопов с их разными атомными массами. Однако Фриц Панет и Джордж де Хевеши показали, что химические свойства изотопов элемента практически идентичны, так что было оправдано рассматривать их как один и тот же элемент в соответствии с их общим атомным номером (как новый критерий упорядочения вместо атомная масса) и, таким образом, сохранить таблицу Менделеева.
Фрэнсис Уильям Астон разработал первый масс-спектрограф в 1919 году и обнаружил, что другие элементы , не полученные в результате серии распадов, также могут быть смесью различных изотопов. Это прояснило, почему (средние) атомные массы некоторых элементов, таких как хлор, так сильно отклоняются от целого числа. И тот факт, что йод, например, имеет более высокий атомный номер, но меньшую атомную массу, чем теллур, был понятен как следствие соответствующих земных смесей изотопов двух элементов.
Нильс Бор (принцип построения)
Когда возбужденный атом снова излучает энергию возбуждения, испускаемое излучение обычно имеет точно определенную длину волны, которая зависит от типа атома и возбужденного состояния. Модель атома Резерфорда, в которой электроны движутся вокруг центрального ядра, прояснила, почему вообще существует излучение, поскольку электроны должны посылать электромагнитные волны в виде движущихся зарядов. Однако он не мог объяснить, почему излучались волны только определенных длин. Кроме того, находящиеся в постоянном движении электроны должны были бы постоянно излучать энергию и из-за этой непрерывной потери энергии должны были бы упасть в ядро в кратчайшие сроки.
Нильс Бор поддержал открытие Макса Планка, согласно которому распределение энергии излучения черного тела можно объяснить только в предположении, что излучение энергии происходит не непрерывно, а в форме дискретных «пакетов энергии». В 1913 году он создал атомную модель водорода, в которой электрон вращается вокруг ядра не по какой-либо, а по одной из нескольких разрешенных орбит, посредством чего - согласно постулату Бора , который не обоснован - он не излучает никакой энергии. Электрон более энергичен на высоких орбитах. Если он упадет на более глубокий путь, он испускает разницу в энергии в виде излучения. Частота этого излучения не (как можно было бы ожидать в соответствии с электродинамики Максвелла) частоты колебаний орбитального электрона, но, в соответствии с другим постулатом Бора, заданного по условию Планка с постоянной Планка . Бору удалось сформулировать условие для разрешенных орбит таким образом, чтобы разность энергий между каждыми двумя орбитами точно соответствовала наблюдаемым частотам спектральных линий в спектре водорода . Таким образом, атомная модель Бора смогла успешно описать спектр водорода; она также дала хорошие результаты для спектральных линий других атомов с одним электроном (H, He + , Li ++ и т. Д.).
Бор также пытался описать электронные конфигурации атомов с несколькими электронами, распределяя электроны по разным орбитам своей атомной модели. Его «принцип построения» предполагал, что электронная конфигурация элемента может быть получена из конфигурации предыдущего элемента путем добавления другого электрона (в основном на самой внешней орбите). Когда дорожка (на современном языке «чаша») была заполнена, начиналась заполняться следующая дорожка. Однако Бор не мог вывести из своей модели, сколько электронов может пройти путь и распределить электроны, как предполагалось с химической и спектроскопической точек зрения.
Ирвинг Ленгмюр (октет валентных электронов)
Гилберт Ньютон-Льюис сформулировал октетную теорию химической связи в 1916 году на основе множества отдельных фактов о химическом и кристаллографическом поведении веществ, накопленных в настоящее время . Согласно этой теории, атомы всегда стремятся к октету валентных электронов как к особенно стабильной конфигурации и, в случае неионных связей, могут достичь этого состояния, вступив в химическую связь с другими атомами и завершив свой собственный октет с помощью валентные электроны этих других атомов. Льюис назвал такую связь, опосредованную общими электронами, ковалентной связью . Он представил, что валентные электроны расположены в восьми углах куба, окружающего ядро.
Ирвинг Ленгмюр расположил октеты в чаши, диаметр которых соответствовал орбитам в атомной модели Бора. Он смог объяснить индивидуальное поведение химических элементов, используя правило октетов: благородные газы уже имеют полный октет валентных электронов и не склонны вступать в химические связи. Элементы с одним или несколькими электронами в валентной оболочке имеют тенденцию отдавать эти электроны. Элементы, которым не хватает одного или нескольких электронов для завершения октета, как правило, занимают недостающее количество электронов. Ленгмюру даже удалось объяснить различные значения элементов, то есть их тенденцию к объединению с определенным числом соответствующих атомов-партнеров ( Эдвард Франкланд представил эту концепцию в 1852 году). Согласно Ленгмюру, валентность - это количество электронов, принятых или выпущенных для завершения октета. Хлор, например, принимает электрон, поэтому является одновалентным и поэтому соединяется, например, ровно с одним атомом водорода. (Современная концепция валентности остается более общей.) Ленгмюру также удалось объяснить природу изотопов: поскольку химическое поведение определяется валентными электронами, все изотопы элемента, очевидно, имеют одинаковое количество валентных электронов и таким образом, такое же количество валентных электронов, которое характерно для химического поведения этого элемента. С другой стороны, разное количество частиц в ядре приводит к разным атомным массам, но не влияет на химическое поведение.
Вольфганг Паули (принцип исключения)
В 1921 г. Бор снова занялся проблемой оболочечной конфигурации многоэлектронных атомов. Арнольд Зоммерфельд расширил атомную модель Бора, включив в нее эллиптические орбиты, и ввел второе квантовое число для их описания. Бор создал новую таблицу с электронными конфигурациями, в которой определенное количество квантовых чисел Зоммерфельда (на сегодняшнем языке: вторичные квантовые числа) было разрешено для каждого числа орбиты (на современном языке: каждое основное квантовое число).
Эдмунд Клифтон Стоунер создал таблицу конфигураций оболочек в 1924 году, в которой он использовал третье квантовое число, тем временем введенное Зоммерфельдом, для подсчета возможных электронных состояний. Он смог воспроизвести ценности элементов лучше, чем Бор. Однако оставалась проблема, заключающаяся в том, что количество дополнительных спектральных линий, на которые расщепляется спектральная линия, когда атом помещается в магнитное поле, предполагает вдвое больше возможных состояний электронов, чем считалось ранее. Вольфганг Паули смог объяснить таблицу Стонера, введя четвертое квантовое число («квантовое число спина»), которое может принимать два разных значения и, таким образом, удвоить количество возможных состояний, и предположив, что нет двух электронов. в атомной оболочке во всех четырех квантовых числах могли согласоваться ( принцип исключения Паули ). По этой причине каждая основная оболочка может содержать 2, 8, 18, 32 и т. Д. Электронов.
Правило Хунда , созданное с помощью Хунда в 1927 г., описывает порядок , в котором отдельные орбитали субоболочки заполнены электронами: Если несколько орбиталей имеют один и тот же уровень энергии, они сначала заполняется отдельными электроны (с взаимно параллельными спинами). Только тогда каждая из орбиталей занята вторым электроном (согласно принципу Паули с противоположным спином).
Эрвин Шредингер (водородная проблема)
Квантовая механика была разработана в 1920-х годах , начиная с де Бройля (1924), Гейзенберга (1925) и Шредингера (1926). Он заменил описательные электронные траектории атомной модели Бора абстрактными, математически описанными «орбиталями» .
В случае простого атома водорода квантово-механическое уравнение Шредингера может быть решено точно. Для этой так называемой « водородной проблемы » существует не просто одно решение, а целый набор функций решения, которые описывают различные возможные состояния электрона. Это набор дискретных , то есть индивидуально счетных математических функций, которые, следовательно, можно отличить друг от друга с помощью «кодовых чисел». Как оказалось, для однозначной идентификации каждого состояния необходимо ровно четыре таких индикатора, которые можно отождествить с четырьмя квантовыми числами, уже полученными в результате экспериментов. Связь между первыми тремя квантовыми числами может быть получена из уравнения Шредингера для атома водорода:
- Начиная с 1, главное квантовое число может иметь любое целочисленное значение:
- Вторичное квантовое число может принимать следующие целочисленные значения, в зависимости от того, что присутствует в каждом случае :
- Магнитное квантовое число может принимать следующие целые значения в зависимости от того, что присутствует в каждом случае :
Согласно требованию Паули, квантовое число спина может принимать одно из двух возможных значений:
Теперь это также обеспечивает физико-математическое обоснование количества возможных электронных состояний для данного основного квантового числа, то есть максимального количества электронов, которое может удерживать каждая основная оболочка.
В основной оболочке, например, есть 3 подоболочки, которые различаются вторичными квантовыми числами:
- Нижняя оболочка с содержит 1 орбиталь с .
- Нижняя оболочка с содержит 3 орбитали с .
- Нижняя оболочка с содержит 5 орбиталей с .
Всего эта основная оболочка содержит 9 орбиталей. Каждая орбиталь может вместить два электрона , так что основная оболочка может содержать максимум 18 электронов.
Если сложить возможное количество подоболочек и орбиталей, можно обнаружить, что основная оболочка с основным квантовым числом может удерживать электроны в целом , то есть для электронов , которые уже известны .
В атомах с несколькими электронами электроны принимают не одноэлектронные состояния только что описанного атома водорода, а скорее многоэлектронные состояния, для которых только что описанные квантовые числа, строго говоря, больше не действуют. Но у них есть аналоговые квантовые числа, для которых используются те же обозначения.
Гленн Т. Сиборг (трансуранцы)
В 1919 году Резерфорд обнаружил, что азот, бомбардированный альфа-частицами, испускает частицы нового типа. Вместе с Джеймсом Чедвиком он идентифицировал эти частицы как положительно заряженные ядра водорода и назвал их « протонами ». Это определило источник положительного заряда на атомном ядре. Блэкетт и Харкинс наблюдали в камере Вильсона в 1925 году, что в таких случаях альфа-частица проглатывалась, а не просто выбивала протон из ядра азота. Из этого был сделан вывод, что согласно уравнению
атом азота стал атомом кислорода, первым примером искусственного преобразования элемента (« трансмутации »). Из-за своего более низкого заряда протоны могут легче преодолевать электрическое отталкивание более тяжелых ядер, чем альфа-частицы, и поэтому лучше подходят в качестве снарядов в экспериментах по бомбардировке, поскольку они могут легче достигать этих ядер. Поскольку естественных источников протонов с требуемой энергией не было, были разработаны протонные ускорители, частично как линейные ускорители, но особенно в форме циклотрона ( Лоуренс и Ливингстон , 1931), что сделало возможным множество новых трансмутаций.
При бомбардировке альфа-частицами бериллий, бор и литий испускали ранее неизвестное, очень проникающее излучение, которое Чедвик идентифицировал как незаряженные частицы с массой протона. Этот «нейтрон» объяснил, почему разные изотопы элемента могут иметь один и тот же атомный номер, но разные массы: у них было разное количество нейтронов в ядре. Поскольку нейтрон не отталкивается ядрами как незаряженная частица, он также подходит в качестве снаряда в экспериментах по бомбардировке.
В ходе экспериментов по бомбардировке удалось получить новые, не встречающиеся в природе изотопы путем трансмутации (первым в 1934 году был изотоп фосфора с массовым числом 30 Иреном и Фредериком Жолио-Кюри ). Искусственно созданные изотопы являются радиоактивными («искусственная радиоактивность») и в силу их особой технологичности были быстро использованы в научных и практических целях. Бомбардировка атомов урана нейтронами привела к открытию ядерного деления в 1938 году .
В 1940 году Эдвин Маттисон Макмиллан и Филип Хауге Абельсон идентифицировали новый элемент нептуний в продуктах, полученных при бомбардировке урана нейтронами . С порядковым номером 93 это был первый Трансуран . Рабочая группа под руководством Гленна Т. Сиборга изучила химические свойства нового элемента (45 микрограммов его можно было получить на циклотроне). Можно было ожидать, что бета-распад изотопа нептуний-239 приведет к образованию элемента с атомным номером 94. Целенаправленное производство этого изотопа путем бомбардировки урана-238 нейтронами позволило Сиборгу и его коллегам в 1941 году получить новый элемент, плутоний.
Я. II III IV V VI VII VIII ... 5 Руб. Sr Y Zr Nb Пн Tc RU ... Шестой CS Ба SE Hf Та W. повторно Операционные системы ... 7-е Пт. Ра Ac ЧтПаU... SE = Ла Ce Pr Nd Вечера См ... 5 Руб. Sr Y Zr Nb Пн Tc RU ... Шестой CS Ба LAN. Hf Та W. повторно Операционные системы ... 7-е Пт. Ра ДЕЙСТВОВАТЬ. Rf Db Sg Бюстгальтер Hs ... LAN. знак равно Ла Ce Pr Nd Вечера См ... ДЕЙСТВОВАТЬ. знак равно Ac Чт Па U Np Пух ...
До этого было установлено, что редкие земли («SE» в периодической таблице напротив) представляют собой вставку в шестом периоде периодической таблицы, но возможное существование подобной вставки еще не было признано в седьмом периоде. Франций, радий и актиний явно принадлежали к первой, второй и третьей группам седьмого периода. Предполагалось, что следующие элементы торий, протактиний и уран должны принадлежать к четвертой, пятой и шестой группе, то есть в периодической таблице они будут подпадать под переходные металлы гафний, тантал и вольфрам. Некоторые сходства с этими группами, такие как ценность 4 у тория или ценность 6 урана, казалось, подтверждали классификацию. Эта ошибка задерживала прогресс исследований, потому что при идентификации и разделении новых элементов часто использовалось их химическое сходство с известными элементами. Новые вещества в основном производились в слишком малых количествах, чтобы их можно было изолировать. Однако, если им было позволено участвовать в химической реакции вместе с известным элементом, продукт которого затем выпадал в осадок , и если в осадке была обнаружена легко измеримая радиоактивность, то было показано химическое сходство с известным элементом. (Мари и Пьер Кюри использовали эту технику, чтобы сконцентрировать обнаруженный радий в осадке хлорида бария.) Однако, если радиоактивность осталась в растворе, предполагаемое сходство было опровергнуто. Неправильно предполагаемое химическое сходство, среди прочего, задержало работу над протактинием и ураном. В 1944 году Сиборг признал, что вновь созданные трансурановые элементы не были переходными металлами, а принадлежали к вставке седьмого периода (актиниды), которая соответствует вставке (теперь называемой лантаноидами) шестого периода.
Сиборг и др. Получили элемент 96 ( кюрий ) в 1944 году путем бомбардировки плутония-239 ионами гелия и вскоре после этого элемент 95 ( америций ) путем бомбардировки плутония-239 нейтронами. В результате бомбардировки америция-241 ионами гелия в 1949 году был получен элемент 97 ( берклий ), за которым последовал элемент 98 ( калифорний ) в результате бомбардировки кюрия-242 ионами гелия.
Несколько рабочих групп определили элементы 99 ( эйнштейний ) и 100 ( фермий ) в результате испытания ядерного оружия «Майк» (1952 г.). С еще более крупными ускорителями все более и более тяжелые атомы могли использоваться в качестве снарядов, так что было также возможно создание более тяжелых и более тяжелых трансурановых элементов. Самый тяжелый Transuran, произведенный до сих пор (по состоянию на 2021 год), - это Element 118 ( Oganesson ).
Текущие обсуждения по позиционированию
Даже сегодня ведутся дискуссии о положении некоторых элементов в таблице Менделеева.
Классификация первого периода
Из-за электронной конфигурации, но не из-за элементарных свойств, гелий (электронная конфигурация 1s 2 ) должен быть отнесен ко второй основной группе, то есть выше бериллия в периодической таблице. Гелий имеет только два электрона, в отличие от других благородных газов с восемью электронами на внешней оболочке. Поскольку гелий химически ведет себя как благородный газ, он находится в восьмой основной группе вместе с другими благородными газами. Когда около 1900 года были открыты благородные газы, они были отнесены к нулевой основной группе, которой сегодня больше не существует. В то время гелий находился на вершине (т.е. в первом периоде) нулевой основной группы. Сегодня благородные газы находятся в восьмой основной группе по версии IUPAC.
Водород может быть более четко позиционирован в периодической таблице по сравнению с гелием, потому что он может принимать степени окисления 0 и +1, типичные для первой основной группы, и, как и приведенный ниже литий, может образовывать ковалентные связи и поэтому считается щелочным Металлы, даже если это единственный газообразный металл, является щелочным металлом и имеет сравнительно высокую электроотрицательность. Водород образует сплавообразные гидриды металлов с некоторыми переходными металлами. Тем не менее, из-за его неметаллической химической активности водород иногда относят к седьмой основной группе вместе с галогенами. По этой причине водород указан дважды в некоторых периодических таблицах, в первой и седьмой основной группе, хотя и редко. Также было предложено сортировать водород выше углерода, потому что его электроотрицательность, сродство к электрону и потенциал ионизации ближе к углероду, даже если он может реагировать только с одним электроном, в отличие от представителей углеродной группы (четвертая основная группа), которая имеет четыре электрона, может реагировать.
Чтобы учесть различные свойства водорода и гелия, они в редких случаях показаны за пределами периодической таблицы.
Лантаноиды и актиниды
Классификация лантаноидов и актинидов относительно отличается от элементов из других периодов. Ранние попытки поместили лантаноиды и актиниды между основными элементами группы. Богуслав Браунер отсортировал лантаноиды и актиниды ниже циркония в 1902 году - это расположение было названо «гипотезой астероидов», основанной на нескольких астероидах на одной орбите, которые Браунер описал в письме Менделееву в 1881 году. В 1922 году Нильс Бор поместил лантаноиды и актиниды между s- блоком и d- блоком. Периодическая таблица, разработанная Гленном Т. Сиборгом в период с 1944 по 1949 год, показывает лантаноиды и актиниды в сносках под иттрием. Однако также критиковалось, что такая классификация разрывает представление таблицы Менделеева.
Скандий и иттрий теперь относительно фиксированы, но элементы в первой подгруппе ниже меняются. Ниже иттрия, в зависимости от представленности, находятся либо первые представители лантаноидов и актинидов (лантан и актиний, т.е. в порядке Sc-Y-La-Ac), либо реже последние представители лантаноидов и актинидов (лютеций и лоуренсий, то есть в порядке Sc-Y-Lu-Lr) или пробел со сносками (то есть в порядке Sc-Y - * - *). Эти три варианта основаны на обсуждении того, где начинается и заканчивается блок f . В четвертом варианте третья группа прерывается и вставляется ветвь актинид-лантаноид и ветвь лютеций-лоуренсий. Существуют химические и физические аргументы в пользу варианта с лоуренсием и лютецием ниже иттрия, но этот вариант не находит большинства среди экспертов по вопросу о периодической таблице. Большинство химиков незнакомы с этим обсуждением. В 2015 году ИЮПАК создал проектную группу по расположению лантаноидов и актинидов. В январе проектная группа опубликовала предварительный отчет. В нем она формулирует три желающих : 1) Порядок элементов должен соответствовать их порядковому номеру. 2) D-блок не предназначен для разделения на две очень непохожие части. 3) Блоки должны состоять из двух, шести, десяти и четырнадцати групп в соответствии с основными требованиями квантовой механики. Это возможно только с Sc-Y-Lu-Lr.
Периодическая таблица по первооткрывателям стихий
Датировка открытия таких химических элементов, известных с доисторических времен или античности , является неточной и может варьироваться на несколько столетий в зависимости от литературного источника. Более надежная датировка возможна только с 18 века. До этого было известно и описано только 15 элементов: 12 металлов (железо, медь, свинец, висмут, мышьяк, цинк, олово, сурьма, платина, серебро, ртуть и золото) и три неметалла (углерод, сера и фосфор). Большинство элементов были обнаружены и научно описаны в 19 веке. В начале 20 века только десять природных элементов были неизвестны. С тех пор, в основном , трудно получить доступ, часто радиоактивные элементы были показаны . Многие из этих элементов не встречаются в природе и являются продуктом искусственных процессов ядерного синтеза . Только в декабре 1994 года были произведены два искусственных элемента - Дармштадций ( Эка- Платина) и Рентгений (Эка-Золото). Пока имена элементов не определены, новые элементы идентифицируются систематическими именами элементов .
Эта таблица Менделеева дает обзор первооткрывателей или производителей отдельных элементов, нажав на идентификацию элемента. Для элементов, для которых не известен ни один первооткрыватель / производитель, текущее историческое состояние знаний кратко показано под обзорным планом.
| группа | 1 | 2 | 3 | 4-й | 5 | Шестой | 7-е | 8-е | 9 | 10 | 11 | 12-е | 13-е | 14-е | 15-е | 16 | 17-е | 18-е | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| период | ||||||||||||||||||||
| 1 |
H + |
Он + |
||||||||||||||||||
| 2 |
Ли + |
Будь + |
B + |
C + |
N + |
O + |
F + |
Ne + |
||||||||||||
| 3 |
Na + |
Mg + |
Al + |
Si + |
P + |
S + |
Cl + |
Ar + |
||||||||||||
| 4-й |
K + |
Ca + |
Sc + |
Ti + |
V + |
Cr + |
Mn + |
Fe + |
Co + |
Ni + |
Cu + |
Zn + |
Ga + |
Ge + |
Как + |
Se + |
Br + |
Kr + |
||
| 5 |
Rb + |
Sr + |
Y + |
Zr + |
Nb + |
Пн + |
Tc + |
Ru + |
Rh + |
Pd + |
Ag + |
C d + |
В + |
Sn + |
Sb + |
Te + |
Я + |
Xe + |
||
| Шестой |
CS + |
Ba + |
* + |
H f + |
Та + |
W + |
R e + |
Ос + |
Ir + |
Pt + |
Au + |
Hg + |
T l + |
Pb + |
Би + |
Po + |
При + |
Rn + |
||
| 7-е |
Пт + |
Ra + |
** + |
Rf + |
D b + |
S g + |
B h + |
HS + |
Mt + |
D s + |
Rg + |
C n + |
Nh + |
Fl + |
Mc + |
Ур + |
Ц + |
Og + |
||
| * |
La + |
C e + |
Пр + |
Nd + |
PM + |
Sm + |
Eu + |
Gd + |
Tb + |
Dy + |
Хо + |
Он + |
Tm + |
Yb + |
Лу + |
|||||
| ** |
Ас + |
Чт + |
Па + |
U + |
Np + |
Pu + |
На + |
См + |
Bk + |
C f + |
E s + |
F m + |
M d + |
Нет + |
Lr + |
|||||
| до 1800 | 1800-1849 | 1850-1899 | 1900-1949 | 1950–1999 | с 2000 года |
| |||||
2019: Международный год Периодической таблицы Менделеева
Организация Объединенных Наций (ООН) объявила 2019 год «Международным годом Периодической таблицы химических элементов» (IYPT 2019): этим они хотят привлечь внимание всего мира к тому, как химия способствует устойчивому развитию и решениям глобальных проблем в области энергетики и образования. , сельское хозяйство или здравоохранение могут предложить. Таким образом, последние открытия и названия четырех «сверхтяжелых» элементов периодической таблицы с порядковыми номерами 113 (Nihonium), 115 (Moscovium), 117 (Tenness) и 118 (Oganesson) должны быть уточнены. известный. Посвящение также совпадает со 150-летием разработки таблицы Менделеева. Мероприятия в Париже , Мурсии и Токио ознаменуют это событие.
Будущие расширения периодической таблицы
Эксперименты по созданию синтетических элементов продолжаются и, как ожидается, также приведут к созданию элементов с атомными номерами выше 118. Если они вписываются в предыдущую схему, подоболочка g (а именно, пятая основная оболочка) заполняется впервые в восьмом периоде . Поскольку подоболочка g содержит девять орбиталей, которые могут содержать 18 электронов, восьмой период будет включать в общей сложности пятьдесят (2 · 5 2 ) элементов: восемь элементов основной группы (заполняющих подоболочки 8s и 8p ), десять внешних переходных элементов (заполняющих 7d нижняя оболочка), четырнадцать внутренних переходных элементов, в которых заполнена нижняя оболочка 6f , и еще восемнадцать внутренних переходных элементов, в которых заполнена нижняя оболочка 5g . То же самое относится и к девятому периоду.
Возможно, что релятивистские эффекты, увеличивающиеся с порядковым номером ( см. Выше ), будут все больше и больше размывать периодичности. Они влияют на поведение электронов и, следовательно, на химические свойства, так что они больше не обязательно должны соответствовать положению элемента в периодической таблице. На это уже указывают известные элементы: переходные металлы 104 резерфорд и 105 дубний должны быть похожи по своему поведению на переходные металлы гафний и тантал, соответственно, которые указаны выше в периодической таблице. Однако эксперименты показывают поведение, которое больше похоже на актиниды плутония или протактиния. Следующие элементы 106 сиборгий и 107 бориум, однако, снова показывают поведение, соответствующее их положению в периодической таблице. 114 Флеровий должен напоминать свинец как элемент четвертой основной группы, но, похоже, ведет себя больше как драгоценный металл.
Как правило, чем тяжелее атомы, тем короче их срок службы. Теоретические оценки показывают, что из порядковых номеров чуть более 170 время жизни сгенерированных атомов приближается к нулю, так что о сгенерированных атомах уже нельзя говорить вообще. Если применимо, это будет теоретический верхний предел объема периодической таблицы.
Другие представления таблицы Менделеева
Система с долгим периодом
Средняя форма таблицы Менделеева (с 18 столбцами и компактным f- блоком), которая в основном используется в настоящее время , уже была подробно объяснена. Если вы не переместите f -блок, который включает лантаноиды и актиниды, вы получите так называемую длинную форму таблицы Менделеева с 32 столбцами. В этом представлении, в отличие от средне-длинной формы, нет прерываний в последовательности порядковых номеров.
Первая долгопериодическая система была предложена Альфредом Вернером в 1905 году . Уильям Б. Дженсен рекомендовал таблицу с длинными периодами, потому что лантаноиды и актиниды, показанные отдельно в таблицах с более короткими периодами, могут показаться студентам неважными и скучными. Несмотря на бесшовное отображение, долговременная система редко используется из-за ее громоздкого формата для высокой печати. Таблица Менделеева, выходящая за пределы атомного номера 118, может быть найдена в Расширенной периодической таблице .
Альтернативные периодические таблицы
Преобладала форма периодической таблицы Дмитрия Менделеева. Тем не менее, были (и есть) другие предложения по альтернативному расположению элементов в соответствии с их свойствами. За первые сто лет после черновика Менделеева 1869 года было опубликовано около 700 вариантов таблицы Менделеева. Помимо множества прямоугольных вариантов, существовали также круглые, сферические, кубические, цилиндрические, спиральные, пирамидальные, слоистые, цветочные, петлевые, восьмиугольные и треугольные периодические таблицы. Различные формы в основном служат для подчеркивания определенных свойств. Большинство представлений двумерны . Первое трехмерное изображение было опубликовано де Шанкуртуа до того, как в 1862 году была опубликована периодическая таблица Менделеева. Еще одно трехмерное изображение нескольких петель бумаги было опубликовано М. Куртинсом в 1925 году, а многослойное изображение было сделано А. Н. Ригли в 1949 году. Поль-Антуан Жигер опубликовал периодическую таблицу, составленную из нескольких пластин в 1965 году, а Фернандо Дюфур опубликовал представление в форме дерева в 1996 году. Периодическая таблица Тима Стоу с 1989 года описывалась как четырехмерная, включая одно цветовое измерение.
Кроме того, существуют более химически и более физически ориентированные представления таблицы Менделеева. Химически ориентированная таблица Менделеева была опубликована в 2002 году Джеффом Райнером-Кэнхэмом для химиков-неоргаников, подчеркивая тенденции и закономерности, а также необычные химические свойства. Физически ориентированная периодическая таблица была опубликована Чарльзом Жане в 1928 году с более сильным акцентом на электронной конфигурации и квантовой механике, как это сделал Альпер в 2010 году. Последняя, однако, подвергалась критике из-за отсутствия представления периодичности характеристики. Смешанные формы включают стандартную периодическую систему, в которой перечислены как химические, так и физические свойства, такие как степень окисления, электрическая и теплопроводность. Его распространенность объясняется сбалансированностью и практичностью отображаемых свойств. Короткая периодическая система ( см. Выше ), в которой основная и подгруппы вложены друг в друга , не является альтернативной периодической таблицей, но все же представляет собой явно иное представление . Другие методы классификации основаны на естественном присутствии элементов в минералах ( классификация Гольдшмидта ) или на кристаллической структуре .
Цитировать
«В дополнение к предсказанию новых элементов и их ожидаемых свойств, таблица Менделеева также оказалась неоценимой при поиске многообещающих исследовательских подходов к производству новых соединений. Химики настолько усвоили этот образ мышления, что даже не осознают, насколько сложной была бы их задача, если бы они не могли полагаться на периодические тенденции. Ваша работа может быть успешно спланирована, потому что вы можете предвидеть последствия замены элемента или группы в соединении. Благоразумный химик всегда следит за возможностью появления неожиданно новых эффектов или неожиданных факторов ».
Смотри тоже
литература
- Эккехард Флак , Клаус Г. Хойман : Периодическая таблица элементов: физические свойства; [химические, биологические и геологические свойства]. 5-е издание, Wiley-VCH, Weinheim 2012, ISBN 978-3-527-33285-4 .
- Таблица Менделеева интерактивная! (CD-ROM для Windows и Mac OS X), Welsch & Partner, Тюбинген.
- П. Курцвейл, П. Шайперс: Химия. Vieweg + Teubner, Висбаден 2010, ISBN 978-3-8348-0341-2 , Глава 3: Периодическая таблица элементов (PSE) .
- Н. Н. Гринвуд , А. Эрншоу : химия элементов. 2-е изд., Elsevier, Oxford, 2016, ISBN 978-0-7506-3365-9 , Глава 2: Химическая периодичность и периодическая таблица .
- К. Зеуберт (ред.): Природная система химических элементов - трактаты Лотара Мейера (1864–1869) и Д. Менделеева (1869–1871). Энгельманн, Лейпциг 1895 г. ( оцифрованная версия ).
- Стивен Дж. Браш : Восприятие Периодического закона Менделеева в Америке и Великобритании. В: Изида. Том 87, 1996, стр. 595-628.
- Ян В. ван Спронсен : Периодическая система химических элементов. История первой сотни лет. Эльзевир, Амстердам, Лондон и Нью-Йорк, 1969, ISBN 978-0-444-40776-4 .
- Масанори Кадзи, Хельге Краг , Габор Палло (ред.): Ранние отклики на периодическую систему. Oxford University Press, 2015, ISBN 978-0-19-020007-7 .
- Эрик Шерри : Периодическая таблица. Его история и его значение. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 .
веб ссылки
- Томас Зайльнахт: Периодическая таблица для уроков химии
- Гельмут Зицманн (редактор): Запись в таблице Менделеева. В: Römpp Online . Георг Тиме Верлаг, по состоянию на 4 июня 2020 г.
- Спектр науки / Общество немецких химиков: элементы, 150 лет Периодической таблицы , 2019 (pdf)
- веб-элемент - информация об элементах (англ.)
- Периодическая таблица , Теодор Грей
- Версия для печати PDF на pse-online.de (135 kB)
- Установка стола. Краткая визуальная история периодической таблицы. Анимация на сайте sciencemag.org , последний просмотр 1 февраля 2019 г.
- Ральф М. Кан: Исторические и философские аспекты Периодической таблицы химических элементов (PDF; 560 kB)
- Эрик Шерри, Наследие Менделеева: Периодическая система , дистилляции, 12 апреля 2007 г.
- Интернет-база данных периодических таблиц , обширная коллекция исторических и современных периодических таблиц.
- Периодическая таблица Европейского химического агентства Echa - предоставляет химические и физические свойства, а также много нормативной и правовой информации, которую иначе трудно найти.
Индивидуальные доказательства
- ^ Вильгельм Папе , Макс Зенгебуш (аранжировка): Краткий словарь греческого языка . 3-е издание, 6-е впечатление. Vieweg & Sohn, Braunschweig 1914 ( images.zeno.org [доступ 6 марта 2019 г.]).
- ↑ Хайнц Ф. Вендт: Карманный словарь Лангеншайдса современного греческого и немецкого языков . 13-е издание. Лангеншайдт, Берлин 1986.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр.16.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 10.
- ↑ Основы и основные элементы группы. в: Холлеманн, Виберг, Учебник неорганической химии , Вальтер де Грюйтер, 2016 г., ISBN 978-3-11-049585-0 , том 1, стр. 82.
- ^ Химия: четыре элемента добавлены в периодическую таблицу. (Больше недоступно в Интернете.) В: BBC News. 4 января 2016, архивируются с оригинала на 4 января 2016 года ; Доступ к 12 сентября 2018 года .
- ^ Николас Сент-Флер: четыре новых имени, официально добавленных в Периодическую таблицу элементов. (Больше недоступно в Интернете.) В: New York Times. 1 декабря 2016, в архиве с оригинала на 14 августа 2017 года ; Доступ к 12 сентября 2018 года .
- ↑ a b Винфрид Кельцер: Лексикон по ядерной энергии. KIT Scientific Publishing, 2013, ISBN 978-3-7315-0059-9 , стр.50 .
- ^ A b c Дж. Эмсли: Строительные блоки природы: Руководство по элементам для Аризоны , нов. 2-е издание, Oxford University Press, Нью-Йорк, Нью-Йорк 2011, ISBN 978-0-19-960563-7 .
- ^ Открытие и присвоение элементов с атомными номерами 113, 115, 117 и 118 - ИЮПАК - Международный союз чистой и прикладной химии. В: iupac.org. 8 июня 2016, доступ к 15 марта 2019 .
- ↑ Ханс Петер Латша, Мартин Мутц: Химия элементов. ISBN 3-642-16914-7 , стр. 1.
- ^ AF Holleman , Н. Виберг : неорганическая химия . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , стр.96.
- ↑ а б в А. Ф. Холлеман , Н. Виберг : Inorganische Chemie . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , стр. 99.
- ^ AF Holleman , Н. Виберг : неорганическая химия . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , стр.101.
- ↑ а б в А. Ф. Холлеман , Н. Виберг : Inorganische Chemie . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , стр.102.
- ^ AF Holleman , Н. Виберг : неорганическая химия . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , стр.97.
- ^ А б А. Ф. Холлеман , Н. Виберг : Inorganische Chemie . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , стр. 100-101.
- ↑ б с д е е А. Ф. Holleman , Н. Wiberg : Inorganische Chemie . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , стр. 327–341.
- ↑ а б в г д А. Ф. Холлеман , Н. Виберг : Inorganische Chemie . 103-е издание. Том 2: Элементы подгруппы, лантаноиды, актиниды, трансактиниды. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049590-4 , стр. 1537-1540.
- ↑ Л. Полинг: Общая химия. Dover Publications, Нью-Йорк 1988, ISBN 978-0-486-65622-9 , стр. 621.
- ↑ Л. Полинг: Общая химия. Dover Publications, Нью-Йорк 1988, ISBN 978-0-486-65622-9 , стр. 133.
- ↑ б с д е е Л. Полинга: общей химии. Dover Publications, Нью-Йорк 1988, ISBN 978-0-486-65622-9 , стр. 172.
- ↑ а б в А. Ф. Холлеман , Н. Виберг : Inorganische Chemie . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , стр. 81.
- ^ AF Holleman , Н. Виберг : неорганическая химия . 103-е издание. Том 2: Элементы подгруппы, лантаноиды, актиниды, трансактиниды. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049590-4 , стр. 2227–2231.
- ↑ б с д е е г ч я J к л м н о А. Ф. Holleman , Н. Wiberg : Inorganische Chemie . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , стр. 330-340.
- ^ А б А. Ф. Холлеман , Н. Виберг : Inorganische Chemie . 103-е издание. Том 1: Основы и основные элементы группы. де Грюйтер, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , стр.149.
- ^ А б А. Ф. Холлеман , Н. Виберг : Inorganische Chemie . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , стр.157.
- ↑ б с д е е г Л. Полинг: общая химия. Dover Publications, Нью-Йорк 1988, ISBN 978-0-486-65622-9 , стр.183.
- ↑ a b Р. Карстен: Строительная химия: Справочник для изучения и практики. 9-е издание, Мюллер, Карлсруэ 1992, ISBN 3-7880-7438-8 , стр. 43.
- ↑ Р. Карстен: Строительная химия: Справочник для изучения и практики. 9-е издание, Мюллер, Карлсруэ 1992, ISBN 3-7880-7438-8 , стр. 44.
- ↑ а б в Н. Н. Гринвуд, А. Эрншоу: Химия элементов. 2-е изд., Elsevier, Oxford, 2016, ISBN 978-0-7506-3365-9 , стр. 27.
- ↑ а б в Н. Н. Гринвуд, А. Эрншоу: Химия элементов. 2-е изд., Elsevier, Oxford, 2016, ISBN 978-0-7506-3365-9 , стр. 65.
- ↑ Л. Полинг: Общая химия. Dover Publications, Нью-Йорк 1988, ISBN 978-0-486-65622-9 , стр. 624.
- ↑ Л. Полинг: Общая химия. Dover Publications, Нью-Йорк 1988, ISBN 978-0-486-65622-9 , стр. 625.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 18.
- ↑ а б в Карстен Р.: Строительная химия: Справочник для учебы и практики. 9-е издание, Мюллер, Карлсруэ 1992, ISBN 3-7880-7438-8 , стр. 78f.
- ↑ a b Р. Карстен: Строительная химия: Справочник для изучения и практики. 9-е издание, Мюллер, Карлсруэ 1992, ISBN 3-7880-7438-8 , стр.78.
- ↑ а б в Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр.14.
- ↑ Р. Карстен: Строительная химия: Справочник для изучения и практики. 9-е издание, Мюллер, Карлсруэ, 1992, ISBN 3-7880-7438-8 , стр.79 .
- ↑ Р. Карстен: Строительная химия: Справочник для изучения и практики. 9-е издание, Мюллер, Карлсруэ, 1992, ISBN 3-7880-7438-8 , стр. 81.
- ↑ Р. Карстен: Строительная химия: Справочник для изучения и практики. 9-е издание, Мюллер, Карлсруэ 1992, ISBN 3-7880-7438-8 , стр.82 .
- ^ A b Н. Н. Гринвуд, А. Эрншоу: Химия элементов. 2-е изд., Elsevier, Oxford, 2016, ISBN 978-0-7506-3365-9 , стр. 26.
- ↑ GD Хинрикс: О классификации и атомных весов так называемых химических элементов, с особым акцентом на определения Стаса Архивировано из оригинала 2 августа 2016 г. В: Труды Американской ассоциации содействия развитию науки . 18, No. 5, 1869, pp. 112-124.
- ↑ а б в А. Ф. Холлеман , Н. Виберг : Inorganische Chemie . 103-е издание. Том 1: Основы и основные элементы группы. де Грюйтер, Берлин / Бостон, 2016 г., ISBN 978-3-11-049585-0 , стр. 339.
- ↑ б с д е е Eric R. Скерри: Периодической таблицы. Oxford University Press, США, 2007, ISBN 978-0-19-530573-9 , стр. 272-276.
- ↑ а б Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 265-266.
- ^ Г. Райнер- Кэнхэм : Изодиагональность в периодической таблице. Основы химии, т. 13, выпуск 2 (июль 2011 г.), 121-129, DOI: 10.1007 / s10698-011-9108-y (Paywall)
- ^ А. Ф. Holleman , Е. Wiberg , Н. Wiberg : Учебник неорганической химии . 101-е издание. Вальтер де Грюйтер, Берлин, 1995 г., ISBN 3-11-012641-9 , стр. 654.
- ^ Г. Райнер-Кэнхэм: Периодические паттерны: связь группы (n) и группы (n + 10). Основы химии, т. 15, выпуск 2 (июль 2013 г.), 229-237, DOI : 10.1007 / s10698-012-9169-6 ( Paywall )
- ↑ а б в г Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 267 и далее.
- ↑ a b c А. Ф. Холлеман , Э. Виберг , Н. Виберг : Учебник неорганической химии . 81–90. Версия. Вальтер де Грюйтер, Берлин, 1976, ISBN 3-11-005962-2 , стр. 748-750.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 291, сноска 26.
- ↑ а б в Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 11.
- ^ ИЮПАК: Номенклатура неорганической химии - Рекомендации ИЮПАК 2005 г. («Красная книга») RSCPublishing, Кембридж 2005, ISBN 0-85404-438-8 ( PDF 4,3 МБ ), стр. 51; на сайте IUPAC: Группы 1-18 и коллективные названия
- ↑ б с д е е г Chemistry: трещины в периодической таблице. В: Spektrum.de. Проверено 19 января 2019 года .
- ↑ Ханс-Ульрих Хартен: Физика для медицинских работников. Springer-Verlag, 2013, ISBN 978-3-662-22293-5 , стр.77.
- ^ Роланд Линднер: Ядерная и радиохимия. Springer-Verlag, 1961, переиздание 2013, ISBN 978-3-642-87162-7 , стр.229.
- ↑ Химия: Остров тяжеловесов. В: Spektrum.de. Проверено 19 января 2019 года .
- ^ AF Holleman , Н. Виберг : неорганическая химия . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016 г., ISBN 978-3-11-049585-0 , стр. 89.
- ↑ а б в А. Ф. Холлеман , Н. Виберг : Inorganische Chemie . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , стр. 71.
- ^ AF Holleman , Н. Виберг : неорганическая химия . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , стр. 72–73.
- ^ AF Holleman , Н. Виберг : неорганическая химия . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , таблица 1.
- ↑ а б в А. Ф. Холлеман , Н. Виберг : Inorganische Chemie . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , Приложение III.
- ^ AF Holleman , Н. Виберг : неорганическая химия . 103-е издание. Том 1: Основы и основные элементы группы. де Грюйтер, Берлин / Бостон, 2016 г., ISBN 978-3-11-049585-0 , стр. 479.
- ↑ а б в Введение по химическим элементам. В: Römpp Online . Георг Тиме Верлаг, по состоянию на 10 июля 2019 г.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 78 f.
- ↑ Б. Джаффе: Горнилы: История химии. 4-е изд., Довер, Нью-Йорк, 1976, ISBN 978-0-486-23342-0 , стр. 91.
- ↑ Б. Джаффе: Горнилы: История химии. 4-е изд., Довер, Нью-Йорк, 1976, ISBN 978-0-486-23342-0 , стр. 91 и далее.
- ^ А б Б. Джаффе: Горнилы: История химии. 4-е изд., Довер, Нью-Йорк, 1976, ISBN 978-0-486-23342-0 , стр. 94.
- ↑ а б в Б. Джаффе: Горнилы: История химии. 4-е изд., Довер, Нью-Йорк, 1976, ISBN 978-0-486-23342-0 , стр. 229-230.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 41.
- ↑ Б. Джаффе: Горнилы: История химии. 4-е изд., Довер, Нью-Йорк, 1976, ISBN 978-0-486-23342-0 , стр. 116 и далее.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 63 и далее.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 66.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 256.
- ^ Анонимус, Nachrichten AUS Chemie унд Technik. (1972), т. 20, стр. 459-460.
- ↑ Э. Ренатус, В: Химия нашего времени (1983), том 17, стр. 96-102.
- ↑ a b c d e f g Запись в периодической таблице. В: Römpp Online . Георг Тиме Верлаг, по состоянию на 6 июня 2019 г.
- ^ AF Holleman , Н. Виберг : неорганическая химия . 103-е издание. Том 1: Основы и основные элементы группы. de Gruyter, Берлин / Бостон, 2016, ISBN 978-3-11-049585-0 , стр.78.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 42.
- ↑ Отрывок из письма Хофрата Вурцера, профессора дер Хеми цу Марбург. in: LW Gilbert (Ed.): Annalen der Physik, New Series, Volume 26, Leipzig 1817, pp. 331–334, оцифрованная цифровая версия .
- ↑ а б Л. Гмелин: Справочник по теоретической химии. 1-й том, 1-й отдел, 3-е издание, Франкфурт-на-Майне 1827, стр. 35-36 ( оцифрованная версия ).
- ↑ JW Döbereiner: Попытка сгруппировать элементарные вещества по их аналогии. в: JC Poggendorff (Ed.): Annalen der Physik und Chemie, Volume 15, Leipzig 1829, pp. 301–307 Digitalisat Digitalisat
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 43.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 43, исправлено 80 470 ошибок в расчетах или печати.
- ↑ Л. Гмелин: Справочник по теоретической химии. 1-й том, 1-й отдел, 3-е издание, Франкфурт-на-Майне 1827 г., стр. 192 ( оцифрованная версия ).
- ↑ Л. Гмелин: Handbuch der Chemie. Том 1, 4-е издание, Гейдельберг 1843 г., стр. 457 ( оцифрованная версия ).
- ↑ а б в Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 55-56.
- ↑ а б Э. Ленсен: О группировке элементов по их физико-химическому характеру. Анналы химии и фармации Юстуса Либиха, CIII. Том, 2-й выпуск (1857 г.), стр. 121-131, DOI: 10.1002 / jlac.18571030202 .
- ↑ Эрнст Ленссен: К теории цветов. Анналы химии и фармации Юстуса Либиха. CIV. Том, 2-й выпуск (1857 г.), стр. 177-184, DOI : 10.1002 / jlac.18571040206 .
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 68.
- ↑ б с д е е г ч Eric R. Скерри: Периодической таблицы. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 76-77.
- ↑ а б в Н. Н. Гринвуд, А. Эрншоу: Химия элементов. 2-е изд., Elsevier, Oxford, 2016, ISBN 978-0-7506-3365-9 , стр.29.
- ↑ а б Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 68-69.
- ↑ Масанори Кадзи, Хельге Краг, Габор Палло: Ранние ответы на периодическую систему. Oxford University Press, 2015, ISBN 978-0-19-020008-4 , стр. 50-57.
- ↑ а б в г Эрик Шерри: Наследие Менделеева: Периодическая система. Институт истории науки Дистилляции. Проверено 6 июня 2019 года.
- ↑ Дж. В. ван Спронсен: Периодическая система химических элементов: история первых ста лет . Эльзевир, Амстердам, 1969.
- ↑ Юлиус Лотар Мейер: Современные теории химии. Maruschke & Berendt, Breslau 1864, таблица на стр.137 .
- ↑ Юлиус Лотар Мейер: Современные теории химии. Maruschke & Берендт, Бреслау 1864 стр. 138 .
- ↑ Юлиус Лотар Мейер: Современные теории химии. Maruschke & Берендт, Бреслау 1864, стр. 136 .
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр. 94.
- ↑ а б в Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр.96.
- ↑ a b L. Meyer: Природа химических элементов как функция их атомного веса , Annalen der Chemie und Pharmacie, VII. Supplementary volume 1870, pp. 354-364, Google-Books Archive.org
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр.98.
- ↑ Дмитрий Иванович Менделеев: Эксперимент для системы элементов, основанный на их атомном весе и химическом сходстве (перевод), 1869.
- ↑ а б в Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 101.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 123.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 117.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 105.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 106.
-
↑ а б в г
Д. Менделеев, J. Russ. Phys. Chem. Soc., 1, 60 (1869).
Немецкий перевод:
Д. Менделеев: Связь между свойствами элементов и их атомным весом. В: К. Зеуберт (Ред.): Природная система химических элементов - трактаты Лотара Мейера (1864–1869) и Д. Менделеева (1869–1871). Engelmann, Leipzig 1895, p. 20 ( оцифрованная версия ). -
↑ a b c d
Д. Менделеев: О связи свойств с атомным весом элементов. Journal for Chemistry, New Series, Volume V, Quandt & Handel, Leipzig 1869, стр. 405 ( оцифрованная версия )
Д. Менделеев: О взаимосвязи между свойствами и атомным весом элементов. В: К. Зеуберт (Ред.): Природная система химических элементов - трактаты Лотара Мейера (1864–1869) и Д. Менделеева (1869–1871). Engelmann, Leipzig 1895, p. 18 ( оцифрованная версия ). - ↑ Переписка: В. фон Рихтер из Санкт-Петербурга 17 октября 1869 г. Доклады Немецкого химического общества, 2-й курс, Ferd. Verlagsbuchhandlung Дюммлера, Берлин 1869, стр. 552 и сл., Здесь стр. 553 ( оцифрованная версия ).
-
↑
Д. Менделеев, Ж. Русь. Phys. Chem.Soc., 3, 25 (1871).
Немецкий перевод:
Д. Менделеев: Периодическая регулярность химических элементов. Annalen der Chemie und Pharmacie, VIII, дополнительный том, 133–229, CF Winter'sche Verlagshandlung, Leipzig and Heidelberg 1872 ( оцифрованная версия )
D. Mendelejeff: Периодическая регулярность химических элементов. В: К. Зеуберт (Ред.): Природная система химических элементов - трактаты Лотара Мейера (1864–1869) и Д. Менделеева (1869–1871). Engelmann, Leipzig 1895, p. 41 ( оцифрованная версия ). - ^ AJ Ihde: Развитие современной химии. Dover, New York 1984, ISBN 978-0-486-64235-2 , p. 246, p. 253 и рис. 9.7, p. 245.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 131 сл.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 139. Теплоемкости 0,073 и 0,076, данные Шерри без единиц измерения, очевидно, выражены в британских тепловых единицах / (фунт ° F) и были преобразованы в Дж / (кг · К) путем их умножения на 4186,8.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 143.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 151.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 291, сноска 32.
- ↑ а б Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 156.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 112.
- ↑ В ядовитом шкафу: Найдена самая старая копия таблицы Менделеева. В: Spektrum.de. Проверено 19 января 2019 года .
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 302, сноска 47.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 161 ф.
- ^ Б. Джаффе: Горнилы: История химии. 4-е изд., Довер, Нью-Йорк, 1976, ISBN 978-0-486-23342-0 , стр.186.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 488 f.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 487.
- ^ A b AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 482.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 500.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 490.
- ^ Б. Джаффе: Горнилы: История химии. 4-е изд., Довер, Нью-Йорк, 1976, ISBN 978-0-486-23342-0 , стр. 211 f.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 164.
- ↑ а б в г Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 165 ф.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 170.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 161.
- ^ Б. Джаффе: Горнилы: История химии. 4-е изд., Довер, Нью-Йорк, 1976, ISBN 978-0-486-23342-0 , стр. 223.
- ↑ Нобелевская премия - Чарльз Гловер Баркла: Факты : «Примерно в 1906 году Чарльз Баркла показал, что вторичный спектр каждого элемента уникален, независимо от температуры, структуры и химического состава».
- ^ Б. Джаффе: Горнилы: История химии. 4-е изд., Довер, Нью-Йорк, 1976, ISBN 978-0-486-23342-0 , стр. 222.
- ↑ а б Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 171.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 172.
- ↑ а б в г Б. Джаффе: Горнилы: История химии. 4-е изд., Довер, Нью-Йорк, 1976, ISBN 978-0-486-23342-0 , стр. 227.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 175.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 173 ф.
- ↑ a b c AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 493.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 492.
- ↑ a b c AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 494.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 177.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 178.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 178 (порядковый номер 91, данный Шерри для тория, должен правильно читаться как 90).
- ↑ Нобелевская премия - Фрэнсис У. Астон: Факты : «... Фрэнсис Астон разработал масс-спектрограф в 1919 году для картирования различных изотопов».
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 496.
- ↑ а б Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 188.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 503.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 504.
- ↑ а б в Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 190.
- ^ А б Б. Джаффе: Горнилы: История химии. 4-е изд., Довер, Нью-Йорк, 1976, ISBN 978-0-486-23342-0 , стр. 246.
- ↑ Б. Джаффе: Горнилы: История химии. 4-е изд., Довер, Нью-Йорк, 1976, ISBN 978-0-486-23342-0 , стр. 247.
- ↑ Б. Джаффе: Горнилы: История химии. 4-е изд., Довер, Нью-Йорк, 1976, ISBN 978-0-486-23342-0 , стр. 249.
- ↑ Б. Джаффе: Горнилы: История химии. 4-е изд., Довер, Нью-Йорк, 1976, ISBN 978-0-486-23342-0 , стр. 250.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 192.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 197 и сл.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 196.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 199.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 200.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 202.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 230.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 506.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 231.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 507.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 234.
- ↑ Эрик Р. Скерри: Периодическая таблица. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 . С. 320, сноска 21.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 508.
- ↑ a b c d AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 509.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 510 f.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 512.
- ↑ a b AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 513.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 514.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 519.
- ↑ a b c AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 522.
- ↑ a b c d AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 594.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 523.
- ↑ Эрик Шерри: Повесть о семи элементах. Oxford University Press, Нью-Йорк, 2013 г., ISBN 978-0-19-539131-2 , стр. 67.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 515.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 488.
- ^ AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 595.
- ^ A b AJ Ihde: Развитие современной химии. Довер, Нью-Йорк, 1984, ISBN 978-0-486-64235-2 , стр. 596.
- ^ Т. Грей: Элементы: Визуальное исследование каждого известного атома во Вселенной. Издательство Black Dog & Leventhal. ISBN 978-1-57912-814-2 , стр. 12.
- ↑ Эррол Дж. Льюарс: Моделирование чудес: вычислительное ожидание новых молекул . Springer Science & Business Media, 5 декабря 2008 г., ISBN 978-1-4020-6973-4 , стр. 69-71. Архивировано из оригинального 19 мая 2016 года.
- ^ ИЮПАК: Периодическая таблица элементов ИЮПАК . В: iupac.org . ИЮПАК. 1 мая 2013 г. Архивировано из оригинального 22 августа 2015. Проверено 20 сентября 2015.
- ^ PA Cox: Неорганическая химия , 2-е. Издание, Bios Scientific, Лондон 2004, ISBN 978-1-85996-289-3 , стр. 149.
- ↑ Г. Райнер-Кэнхэм, Т. Овертон: Описательная неорганическая химия , 4-е. 1-е издание, WH Freeman, Нью-Йорк, 1 января 2006 г., ISBN 978-0-7167-8963-5 , стр. 203.
- ^ П. Уилсон: Водород принимает позицию щелочного металла . В кн . : Мир химии » . Королевское химическое общество. 2013.
- ↑ GM Bodner, LH Rickard, JN Spencer: Chemistry: Structure and Dynamics . John Wiley & Son, Нью-Йорк 1995, ISBN 978-0-471-14278-2 , стр.101.
- ↑ Эрик Шерри: Некоторые комментарии к недавно предложенной периодической таблице, в которой элементы упорядочены по подоболочкам . В: Журнал биологической физики и химии (2012), том 12, выпуск 2.
- ^ Г. Сиборг: химические и радиоактивные свойства тяжелых элементов . В: Химическая английская газета . 23, No. 23, 1945, pp. 2190-2193. DOI : 10.1021 / СЕН-v023n023.p2190 .
- ^ MW Cronyn: подходящее место для водорода в периодической таблице . В: Журнал химического образования . 80, № 8, август 2003 г., стр. 947-951. bibcode : 2003JChEd..80..947C . DOI : 10.1021 / ed080p947 .
- ^ Н. Н. Гринвуд, А. Эрншоу: химия элементов. Oxford, Pergamon Press, 1984. ISBN 978-0-08-022057-4 .
- ^ А б П. Тиссен, К. Биннеманс: Размещение редких земель в Периодической таблице: исторический анализ . В KA Gschneider Jr. (Ред.): Справочник по физике и химии редких земель. Elsevier, Амстердам, 2011 г., том 41, стр. 1-94.
- ^ GT Сиборг: Происхождение концепции актинидов . В: KA Gschneider Jr. (Ed.): Handbook on the Physics and Chemistry of the Rare Earths . Том 18. Амстердам, Elsevier, 1994, стр. 1-27.
- ↑ П. Дж. Стюарт: Таблица с форзацеванием: альтернатива . В: Журнал химического образования . 85, № 11, 2008 г., стр. 1490. bibcode : 2008JChEd..85.1490S . DOI : 10.1021 / ed085p1490 .
- ↑ Г. Хевесы : Редкие земли с точки зрения строения атома. Цитируется в Трифонова 1970, стр. 188 ( русский ). НХТИ, Ленинград, 1929.
- ^ Зильберберг: Химия: молекулярная природа материи и изменений , 4-е. Издание, МакГроу-Хилл, Нью-Йорк, 2006 г., ISBN 978-0-07-111658-9 , стр. 536.
- ↑ П. Тиссен, К. Биннеманс: Размещение редких земель в Периодической таблице: исторический анализ . В KA Gschneider Jr. (Ред.): Справочник по физике и химии редких земель. Elsevier, Амстердам, 2011 г., том 41, стр. 80-81.
- ↑ Дж. Килер, П. Уотерс: Химическая структура и реакционная способность: комплексный подход . Оксфордский университет, Оксфорд, 2014 г., ISBN 978-0-19-960413-5 , стр. 259.
- ^ Э. Шерри : Периодическая таблица Менделеева наконец завершена и что делать с группой 3? Архивировано из оригинала 5 июля 2017. В: Химия International . 34, № 4, 2012. DOI : 10,1515 / ci.2012.34.4.28 .
- ↑ Д. Castelvecchi: . Экзотические атом изо всех сил пытается найти свое место в периодической таблице Архивировано из оригинала 5 октября 2015. В: Nature . 8 апреля 2015 г. doi : 10.1038 / nature.2015.17275 .
- ^ Состав группы 3 периодической таблицы . ИЮПАК. 2015. Архивировано из оригинала 5 июля 2016 года Проверено 30 июля 2016.
- ↑ Эрик Шерри: Предварительный отчет по обсуждениям группы 3 Периодической таблицы . В: Chemistry International . 43, No. 1, 18 января 2021 г., стр. 31-34.
-
↑ Badische Zeitung: Итог: когда воняет и трескается. В: Badische Zeitung . 2 января 2019, доступ к 21 января 2019 . 2019 год будет Международным годом Периодической таблицы Менделеева. Химия Ассоциация Баден-Вюртемберг, 12 января 2018, доступ к 21 января 2019 года .
- ↑ Международный год Периодической таблицы Менделеева [1]
- ^ А. Ф. Holleman , Е. Wiberg , Н. Wiberg : Учебник неорганической химии . 81–90. Версия. Вальтер де Грюйтер, Берлин, 1976, ISBN 3-11-005962-2 , стр. 994.
- ^ А. Ф. Holleman , Е. Wiberg , Н. Wiberg : Учебник неорганической химии . 81–90. Версия. Вальтер де Грюйтер, Берлин, 1976, ISBN 3-11-005962-2 , стр. 998.
- ↑ Эрик Шерри: Повесть о 7 элементах: Элемент 61 - Прометий . Oxford University Press (США), 2013, ISBN 978-0-19-539131-2 , стр. 175-194 (190). Не Архивировано из оригинального 10 сентября 2017 года: «... нет перерывов в последовательности возрастания атомных номеров ...»
- ^ A b Уильям Б. Дженсен: Классификация, симметрия и периодическая таблица . В: Комп. И математика. С аппл. . 12B, No. I / 2, 1986. Проверено в январе 2017 года.
- ↑ MR Leach: Относительно электроотрицательности как основного свойства элемента и почему периодическая таблица обычно представлена в ее средней форме . В кн . : Основы химии . 15, No. 1, 2012, pp. 13-29. DOI : 10.1007 / s10698-012-9151-3 .
- ^ Поиск помощи Эдварду Г. Мазурсу Коллекция изображений периодических систем .
- ↑ Эрик Шерри: Периодическая таблица: ее история и ее значение. Oxford University Press, Нью-Йорк 2007, ISBN 978-0-19-530573-9 , стр.20.
- ↑ Weird Words of Science: Lemniscate Elemental Landscapes . В кн . : Области науки . fieldofscience.com. 22 марта 2009 года Архивировано из оригинала 4 марта 2016 года Проверено 4 января 2016.
- ^ Интернет-база данных периодических таблиц
- ^ Куртинками, J. Химическое образование, т. 2, 1925, стр. 107.
- ^ Марк Р. Лич: Периодическая классификация Куртинс 1925 года . Архивировано из оригинального 16 мая 2016 года , извлекаемых 16 октября 2012 года.
- ^ TO Wrigley, WC Mast, TP McCutcheon: ламинарная форма периодической таблицы. Часть I., J. Chem. Education, том 26, 1949 г., стр. 216, DOI: 10.1021 / ed026p216 . Название искажено в Ван Спронсен, Периодическая система химических элементов (1969).
- ^ Марк Р. Лич: 1949 Lamina System Рингли . Архивировано из оригинала на 3 декабря 2011 года , извлекаемых 16 октября 2012 года.
- ^ Е. Mazurs: Графическое представление периодической системы в течение Ста лет . University of Alabama Press, Алабама, 1974, ISBN 978-0-8173-3200-6 , стр. 111.
- ^ Марк Р. Лич: Периодическое дерево Дюфура 1996 года . Архивировано из оригинального 18 апреля 2010 года , извлекаемых 16 октября 2012 года.
- ↑ Г.Б. Кауфман: Elementree: 3-D периодическая таблица Фернандо Дюфура, The Chemical Educator, том 4, 1999, стр 121-122.
- ^ Марк Р. Лич: Периодическая таблица физика 1989 Тимоти Стоу . Архивировано из оригинала на 5 июня 2012 года , извлекаемых 16 октября 2012 года.
- ↑ Д. Брэдли: Наконец, окончательная таблица Менделеева? Архивировано из оригинала на 1 мая 2013 г. В: ChemViews Magazine . 20 июля 2011 г. doi : 10.1002 / chemv.201000107 .
- ↑ Эрик Шерри: Периодическая таблица: ее история и ее значение. Oxford University Press, Нью-Йорк, 2007. ISBN 978-0-19-530573-9 , стр. 285-286.
- ↑ Марк Р. Лич: Периодическая таблица 2002 Неорганические химика . Архивировано из оригинала 9 марта 2013 г. извлекаться 16 октября 2012 года.
- ^ Э. Шерри : Роль триад в эволюции периодической таблицы Менделеева: прошлое и настоящее . В: Журнал химического образования . 85, No. 4, 2008, pp. 585-589 (589). bibcode : 2008JChEd..85..585S . DOI : 10.1021 / ed085p585 .
- ^ Р. Альпер: Упрощенная таблица Менделеева: элементы, упорядоченные по их подоболочкам . В: Журнал биологической физики и химии . 10, № 2, 2010, с. 74-80. DOI : 10,4024 / 43AL09F.jbpc.10.02 .
- ↑ Э. Шерри : Некоторые комментарии к недавно предложенной периодической таблице, в которой элементы упорядочены по подоболочкам . В: Журнал биологической физики и химии . 12, No. 2, 2012, pp. 69-70.
- ^ HA Bent, F. Weinhold: Дополнительная информация: Новости из периодической таблицы: Введение в «Символы периодичности, таблицы и модели для валентности более высокого порядка и родства донор-акцептор» . В: Журнал химического образования . 84, No. 7, 2007, pp. 3-4. DOI : 10.1021 / ed084p1145 .
- ↑ Эрик Шерри: Таблица Менделеева: очень краткое введение. Oxford University Press, Нью-Йорк, 2011. ISBN 978-0-19-958249-5 .
- ^ М. Франкля: Таблица манеры Архивировано из оригинального 25 октября 2012 года: Nature Chemistry . 1, № 2, май 2009 г., стр. 97-98. bibcode : 2009NatCh ... 1 ... 97F . DOI : 10.1038 / nchem.183 . PMID 21378810 .
- ^ J. Emsley, Р. Шарп: Периодическая таблица: Лучшие из диаграмм Архивировано из оригинала на 1 июля 2017. В: The Independent . 21 июня 2010 г.
- ^ Г. Сиборг: Плутоний: элемент ужаса . В кн . : Химия . 37, No. 6, 1964, p. 14.
- ^ Н. Н. Гринвуд, А. Эрншоу: химия элементов. 2-е изд., Elsevier, Oxford, 2016, ISBN 978-0-7506-3365-9 , стр. 30: «В дополнение к предсказанию новых элементов и их вероятных свойств, таблица Менделеева оказалась неоценимой, предлагая плодотворные направления исследований. при приготовлении новых соединений. Действительно, этот образ мышления сейчас настолько укоренился в умах химиков, что они редко останавливаются, чтобы подумать о том, насколько чрезвычайно трудной была бы их задача, если бы периодические тенденции были неизвестны. Это способность предвидеть эффект изменения элемента или группы в соединении, которая позволяет эффективно планировать работу, хотя благоразумный химик всегда внимателен к возможности новых эффектов или неожиданных факторов, которые могут неожиданно вмешаться ».

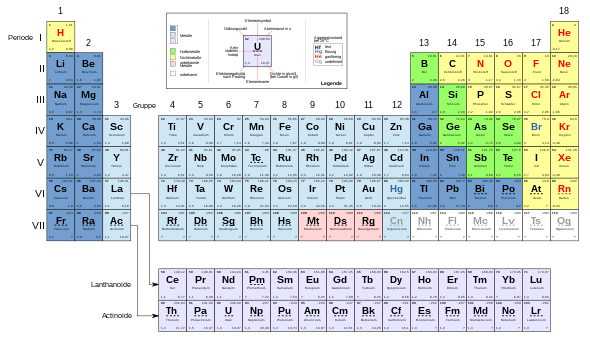

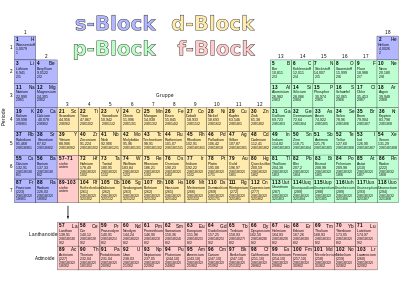




























![{\ displaystyle \ mathrm {{} _ {4} Be} \ quad {\ xrightarrow [{+ 8}] {}} \ quad \ mathrm {{} _ {12} Mg} \ quad {\ xrightarrow [{+ 8 }] {}} \ quad {\ color {BrickRed} \ mathbf {{} _ {20} Ca} \ quad {\ xrightarrow [{\ mathbf {+18}}] {}} \ quad \ mathbf {{} _ {38} Sr} \ quad {\ xrightarrow [{\ mathbf {+18}}] {}} \ quad \ mathbf {{} _ {56} Ba}} \ quad {\ xrightarrow [{+ 32}] {} } \ quad \ mathrm {{} _ {88} Ra}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b244a79c0b31c8833e988dd5f2b459e0547e8c22)