калий
| характеристики | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| В целом | |||||||||||||||||||||||||||||||||||||||||||||||||
| Имя , символ , атомный номер | Калий, К, 19 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Щелочные металлы | ||||||||||||||||||||||||||||||||||||||||||||||||
| Группа , период , блок | 1 , 4 , п. | ||||||||||||||||||||||||||||||||||||||||||||||||
| Появление | серебристо-белый | ||||||||||||||||||||||||||||||||||||||||||||||||
| Количество CAS | |||||||||||||||||||||||||||||||||||||||||||||||||
| Номер ЕС | 231-119-8 | ||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA InfoCard | 100.028.290 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Массовая доля земной оболочки | 2,41% | ||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный | |||||||||||||||||||||||||||||||||||||||||||||||||
| Атомная масса | 39.0983 (1) и др. | ||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус (рассчитанный) | 220 (243) вечера | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 203 вечера | ||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 275 вечера | ||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Ar ] 4 с 1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Энергия ионизации | 4-й.340 663 69 (9) эВ ≈ 418.81 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Энергия ионизации | 31 год.62500 (19) эВ ≈ 3 051.35 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Энергия ионизации | 45.8031 (17) эВ ≈ 4 419.3 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Энергия ионизации | 60.917 (19) эВ ≈ 5 878 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Энергия ионизации | 82.66 (16) эВ ≈ 7 975 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| Физически | |||||||||||||||||||||||||||||||||||||||||||||||||
| Физическое состояние | фиксированный | ||||||||||||||||||||||||||||||||||||||||||||||||
| Кристальная структура | объемно-центрированная кубическая | ||||||||||||||||||||||||||||||||||||||||||||||||
| плотность | 0,856 г / см 3 (20 ° С ) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по шкале Мооса | 0,4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| магнетизм | парамагнитный ( Χ m = 5,7 10 −6 ) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 336,53 К (63,38 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||
| точка кипения | 1047 К (774 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Молярный объем | 45.94 10 −6 м 3 моль −1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 79,1 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 2.334 кДж моль -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука | 2000 м с −1 при 293,15 К. | ||||||||||||||||||||||||||||||||||||||||||||||||
| Удельная теплоемкость | 757,8 Дж кг −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Рабочая функция | 2.30 эВ | ||||||||||||||||||||||||||||||||||||||||||||||||
| Электропроводность | 14,3 · 10 6 А · В −1 · м −1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 100 Вт · м −1 · K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Химически | |||||||||||||||||||||||||||||||||||||||||||||||||
| Состояния окисления | -1, +1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Нормальный потенциал | −2,931 В (К + + е - → К) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | 0,82 ( шкала Полинга ) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Изотопы | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Для других изотопов см. Список изотопов | |||||||||||||||||||||||||||||||||||||||||||||||||
| ЯМР свойства | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| правила техники безопасности | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
|
Насколько это возможно и общепринято, используются единицы СИ . Если не указано иное, приведенные данные относятся к стандартным условиям . | |||||||||||||||||||||||||||||||||||||||||||||||||
Калий ( латиница , от арабского القلية, DMG al-qalya 'зола растений') представляет собой химический элемент с символом элемента K (ранее также Ka) и атомным номером 19. В периодической таблице он находится в первой основной группе или 1-й группе ИЮПАК и является одним из что щелочные металлы .
Калий является одним из десяти наиболее распространенных элементов в оболочке Земли и происходит в многочисленных минералах в этом земной коре .
история


19 ноября 1807 года , Хэмфри Дэви сообщил в Королевском обществе в Лондоне , что ему удалось получить два различных металла от электролиза слабо увлажненный каустической щелочи; Один из металлов, впервые извлеченный 6 октября 1807 года, он назвал калием (английский и французский термин для обозначения калия, который используется до сих пор), потому что его можно извлечь из поташа , а другой - впервые через несколько дней. позже, это натрий (который до сих пор используется на английском и французское имя натрия ), так как он содержится в различных модификациях из карбоната натрия (соды). В немецкоязычных странах натрий Дэвис с 1811 года называется натрием по предложению Берцелиуса , в то время как выражение Калиум (с арабского), введенное Клапротом в 1796 году, используется для Калия Дэвиса .القَلْيَة al-qalya = пепел, получаемый из растительного пепла).
Вхождение
Калий встречается в природе только в виде катиона в соединениях калия. Это связано с тем, что у него есть только один внешний электрон, и он очень готов отказаться от него, чтобы получить стабильную внешнюю электронную оболочку с низкой энергией . Поэтому соединения ковалентного калия неизвестны. Средняя концентрация в морской воде составляет 399,1 мг К + / кг = 408,4 мг К + / л.
Встречающиеся в природе минералы, содержащие калий :
- Сильвин - KCl
- Сильвинит - KCl · NaCl
- Карналлит - KCl · MgCl 2 · 6H 2 O
- Каинит - KCl · MgSO 4 · 3H 2 O
- Шёнит - K 2 SO 4 • MgSO 4 • 6 H 2 O
- Полигалит - K 2 SO 4 · MgSO 4 · MgSO 4 · 2 CaSO 4
- Ортоклаз (калиевый полевой шпат) - K [AlSi 3 O 8 ]
- Мусковит (калийная слюда ) - KAl 2 (OH, F) 2 [AlSi 3 O 10 ]
Соли калия образуют отложения испарения на бывшем морском дне , что делает добычу солей калия в этих районах экономичной. Калийную соль добывают в Канаде, России, Беларуси, Казахстане, Германии, Израиле, США, Иордании и других местах по всему миру. Самые большие из когда-либо обнаруженных залежей находятся на глубине 1000 метров под поверхностью в канадской провинции Саскачеван. Эти месторождения расположены в точке группы Элка, которая формируется в центральном девоне . В Саскачеване , где с 1960-х годов работали несколько крупных шахт, была внедрена технология замораживания влажного песка (формация Блэрмор) для проходки шахтных стволов через них. Основная компания по добыче калийных удобрений в Саскачеване - это Potash Corporation . Вода Мертвого моря используется в качестве источника калийных удобрений в Израиле и Иордании, в то время как концентрация в обычных океанах слишком мала для коммерческого производства при нынешних ценах.
В 2010 году калий был обнаружен в атмосфере экзопланет XO-2b и HD 80606 b .
Извлечение и представление
Металлический калий можно извлечь несколькими способами. Были использованы электролитические процессы, такие как процесс Degussa или термический процесс от IG Farben , завод Griesheim. Большинство калия, однако, при этом в 1950 Технике безопасности в шахтах сделали введен метод MSA , в котором при температуре 870 ° С в атмосфере защитного газа с металлическим натрием является снижением из хлорида калия осуществляются. Образующийся газообразный калий осаждается в холодной ловушке путем конденсации.
Имеющиеся в продаже сплавы Na-K также доступны за счет изменения параметров дистилляции.
Элементарный калий можно найти в лаборатории путем восстановления хромата или дихромата с использованием циркония в соответствии с:
или термическое разложение азида калия :
а также последующая перегонка в высоком вакууме.
характеристики
Как и другие щелочные металлы , калий часто очень бурно реагирует со многими другими элементами и соединениями , особенно с неметаллами , и в естественной среде встречается только химически связанным . Калий обладает более высокой реакционной способностью, чем натрий, и бурно реагирует с водой с образованием гидроксида калия и выделением водорода . Высокоскоростные записи реакции щелочных металлов с водой предполагают кулоновский взрыв .
- Реакция калия с водой
Из-за сильно экзотермической реакции водород воспламеняется при поступлении воздуха. Это может привести к дефлаграциям и взрывам . В сухом кислороде металл горит интенсивным фиолетовым пламенем с образованием гипероксида калия KO 2 и пероксида калия K 2 O 2 .
- соответственно.
- Реакция калия с кислородом
Во влажном воздухе он очень быстро реагирует с водой и углекислым газом с образованием карбоната калия с образованием водорода .
- Реакция калия с водой и углекислым газом
Калий реагирует со спиртами с образованием алкоголятов с образованием водорода .
- Реакция калия с этанолом
Как и все щелочные металлы , калий легко растворяется в жидком аммиаке , образуя сине-фиолетовый раствор . С галогенами брома и йода в жидкой или твердой форме калий взрывным образом превращается в соответствующие галогениды .
Чтобы избавиться от калия, обычно рекомендуется осторожно поместить небольшие кусочки металла в большой избыток трет-бутилового спирта , с которым он реагирует с образованием алкоголята и водорода . Поскольку эта реакция протекает очень медленно, может случиться так, что небольшие остатки калия останутся незамеченными, покрытыми коркой трет- бутанолата калия . Поэтому необходимо внимательно следить за полнотой реакции . В качестве альтернативы, 1-бутанол также можно использовать для небольших количеств калия , который реагирует с калием быстрее, но все еще поддается контролю. Ни при каких обстоятельствах нельзя использовать «низшие» спирты ( пропанолы , этанол или метанол ), так как они слишком бурно реагируют с калием и также более легковоспламеняемы .
В воздухе , блестящий серебристо-белой поверхность среза свежего металла покрыта голубоватый мерцающий слой оксида и гидроксида и небольшое количество карбоната в течение нескольких секунд . Оставленный на воздухе, он, как и все щелочные металлы, медленно и полностью реагирует с образованием карбоната . Поэтому металлический калий используется в безводных органических жидкостях , таких как. Б. хранимое парафиновое масло. В отличие от натрия , калий все еще может образовывать корки оксидов , пероксидов и гидроксидов после длительного хранения , которые покрывают металл в виде красновато-желтых слоев и могут взорваться при прикосновении или нажатии . В этом случае безопасная утилизация становится невозможной; единственный вариант - сжечь весь контейнер в контролируемых условиях. Калий, сваренный в полиэтиленовую упаковку, также может покрыться взрывоопасной коркой, поэтому такая упаковка не подходит для хранения .
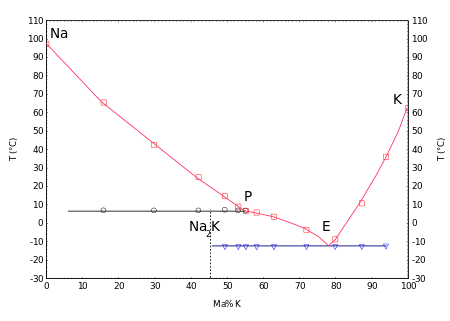
Жидкие смеси образуются с натрием в широком диапазоне концентраций при комнатной температуре , см .: NaK (сплав) . На фазовой диаграмме показано соединение Na 2 К, плавится несоответственно при 7 ° C и эвтектической при -12,6 ° С с содержанием натрия 23% мас .
использовать
Калий использовался в качестве охлаждающей жидкости в некоторых высокоскоростных ядерных реакторах в виде эвтектического сплава Na-K . В противном случае металлический калий не имеет большого технического значения, поскольку его можно заменить более дешевым натрием .
В научно - исследовательской лаборатории калия иногда для сушки из растворителей , используемых, в частности , когда температура кипения вышеуказанного растворителя точки плавления калия, но ниже точки плавления натрия находится. Затем калий плавится в кипящем растворителе, и его поверхность не покрывается коркой. Таким образом, вам нужно значительно меньше щелочного металла, и его можно почти полностью использовать в процессе сушки, так что нужно утилизировать только очень небольшие остатки.
При длительном стоянии калий образует корки пероксосоединений (K 2 O 2 и KO 2 ) даже под защитной жидкостью ( нефть ), которые реагируют очень взрывоопасно . Эти пероксосоединения могут вызвать взрывы даже при низком давлении , особенно при поднятии кусочков калия плоскогубцами или при резке ножом . В качестве контрмер рекомендуется либо плавление в стеклянных ампулах, либо хранение в защитной жидкости и инертном газе . Кроме того, галогенированные растворители нельзя сушить калием из-за опасности взрыва. Также опасны реакции калия при взаимодействии растворителей, которые могут легко выделять кислород .
Другое использование:
- Легирование вольфрамовой проволоки для производства нитей накаливания.
- Нагревательный сплав Na-K (см. Натрий )
- В форме гипероксида калия KO 2 в качестве воздушного фильтра калия (см. Калийные картриджи ), используемого на подводных лодках , среди прочего, для регенерации воздуха для дыхания.
Биологическое значение
Важность как удобрение
Водорастворимые соли калия используются в качестве удобрений, поскольку растениям трудно переваривать силикаты калия, содержащиеся в почве .
Индустриальное сельское хозяйство использует удобрения к в жатвы , чтобы заменить потерянный калий. Большинство сельскохозяйственных удобрений содержат хлорид калия , в то время как сульфат калия используется для культур, чувствительных к хлоридам, или культур с более высоким содержанием серы . Немногие удобрения содержат нитрат калия . Другими удобрениями, содержащими калий, являются Корнкали с оксидом магния , Патенткали, Флори, Нитрофоска и фосфат калия .
Существенные макроэлементы калий имеет широкий спектр эффектов в растениях . В ксилеме он служит осмотиком , что имеет решающее значение для повышения корневого давления. Калий в клетках листа увеличивает тургор , что приводит к удлинению клеток и росту поверхности листа. Увеличивая тургор, он также обеспечивает открытие устьиц , что способствует поглощению углекислого газа и, таким образом, оказывает прямое влияние на фотосинтез . Если калий присутствует в достаточном количестве, он способствует образованию сахаров C3 на первом этапе , которые перерабатываются в крахмал , целлюлозу , лигнин и белки в других метаболических процессах, на которые влияет калий . У растений, страдающих недостатком калия, симптомы проявляются в основном на старых листьях . Калий ретранслируется из них и транспортируется в молодые листья через флоэму . Типичными симптомами дефицита калия являются точечный, межреберный хлороз и хлороз края листа и некроз края листа . Также наблюдается сжатый габитус и, возможно, увядание . Сильный солнечный свет может вызвать фотоокисление листьев. Большой избыток вызывает ожоги корней и дефицит кальция или магния .
Калий является антагонистом кальция, поэтому оба питательных элемента должны присутствовать в правильном соотношении друг с другом в растении и в почве.
Значение для человеческого тела
Калий - важный минерал ( основной элемент ) для поддержания жизни . Как самый важный внутриклеточный катион , калий участвует в физиологических процессах в каждой клетке:
- Биоэлектричество из клеточных мембран , д. ЧАС. нормальная нервно-мышечная возбудимость, стимуляция и проводимость сердца
- Регулирование роста клеток
- Влияние защитных (защитных) функций эндотелия сосудов
- Поддержание нормального артериального давления
- Регулирование кислотно-щелочного баланса путем воздействия на почечную кислоты экскреции чистый
- Влияние на высвобождение гормонов (например, инсулина из бета-клеток )
- Использование углеводов и синтез белка
Рекомендуемое и фактическое потребление калия
Для поддержания всех жизненно важных физиологических процессов рекомендуется ежедневно употреблять не менее 2 г калия. Однако Совет по пищевым продуктам и питанию (FNB) США и Канады считает, что потребление 4,7 г / день (120 ммоль / день) является подходящим для всех взрослых с профилактической точки зрения. Согласно новым данным, такое количество калия (из пищи) необходимо для предотвращения, уменьшения или отсрочки хронических заболеваний, таких как повышенное артериальное давление , чувствительность к соли , камни в почках , потеря костной массы или инсульты .
Согласно Национальному исследованию питания II (NVS II), потребление калия в Германии находится в среднем на уровне 3,1 г / день (женщины) или 3,6 г / день (мужчины). Рекомендуемое FNB потребление 4,7 г калия в день не достигается 75% мужчин и 90% женщин.
Важность соотношения натрий / калий

Калий играет важную роль в регулировании мембранного потенциала в организме . Внутриклеточная концентрация калия составляет около 150 ммоль / л, внеклеточная - 4 ммоль / л. Внутриклеточная концентрация натрия составляет около 10 ммоль / л, внеклеточная концентрация около 140 ммоль / л. Эти различия в концентрации поддерживаются Na / K-АТФазой и жизненно важны для функционирования клетки. Постоянное изменение этих клеточных концентраций может привести к остановке сердца в систолу с повышением концентрации K + ( гиперкалиемия ), т.е. K + >> 4,5 ммоль / л, и к гипокалиемии (K + <3,5 ммоль / л). сокращение мышц, повышенное возбуждение, нарушение проводимости возбуждения, экстрасистолии сердца. K + (помимо Na + ) имеет решающее значение для осмотического давления клеток, то есть для содержания воды в клетке. Слишком низкая концентрация K + в крови приводит к остановке сердца в диастолу . Нормальный диапазон в сыворотке крови составляет 3,6–4,5 ммоль / л, в моче - 26–123 ммоль / л. То есть постоянно теряется К + , который нужно заменить едой.
Это особенно актуально в наши дни, поскольку западная диета характеризуется потреблением продуктов животного происхождения. Однако потребление богатой калием растительной пищи значительно снижено по сравнению с предыдущим периодом. До развития сельского хозяйства потребление калия составляло 10,5 г / день по сравнению со средним значением 3,4 г / день согласно NVS II. С другой стороны, потребление натрия, которое было изменено на противоположное, ранее составляло всего 0,8 г / день. день и увеличился в среднем до 3,1 г / день (женщины) и 4,3 г / день (мужчины) из-за нашей диеты с высоким содержанием соли. Это влияет на естественное соотношение калия и натрия в организме человека.
Калий является естественным антагонистом натрия , и сбалансированное соотношение двух минералов особенно важно для регуляции физиологических процессов. Чрезмерное потребление натрия может привести к истощению запасов калия. И наоборот, калий обладает натрийуретическим действием. В этом отношении соотношение Na / K в пище имеет большее значение, чем концентрация отдельных катионов по отдельности. ВОЗ рекомендует молярное отношение двух минералов 1: 1. Этому соотношению соответствуют рекомендации ВОЗ: менее 2 г натрия в день и не менее 3,5 г калия в день.
Физиологическое значение
Помимо натрия, калий имеет большое значение для регулирования артериального давления . Эпидемиологические исследования показывают, что повышенное потребление калия связано со снижением артериального давления и снижает риск инсульта. Антигипертензивный эффект калия также был продемонстрирован при попытках приема добавок .
Так называемая диета DASH (диетические подходы к борьбе с гипертонией) (богатая цельнозерновыми злаками , фруктами, овощами, птицей, рыбой и орехами) также может снизить кровяное давление . В отличие от обычной диеты, эта диета содержит меньше поваренной соли и насыщенных жиров, относительно большое количество калия, но также больше других питательных веществ, таких как магний и кальций, которые также считаются ответственными за снижение артериального давления. По этой причине следует рекомендовать диету, богатую фруктами и овощами (богатыми калием), в сочетании с умеренным снижением потребления натрия, так как соотношение натрия и калия, равное 1 или меньше, положительно влияет на артериальное давление. Регулировать потребление калия до высокого уровня натрия не имеет смысла. Европейская кухня безопасности Орган (EFSA) также подтверждает давление возрастает эффект крови натрия.
Калий также положительно влияет на метаболизм костей, поскольку более высокое потребление калия предотвращает повышенное выведение кальция, которое вызвано высоким потреблением соли. Таким образом, калий способствует удержанию кальция почками в почках и предотвращает расщепление кальция из костей . В этом контексте также необходимо учитывать влияние сопутствующего аниона, состава пищи и возраста на кислотно-щелочной статус. Клинические исследования показали, что цитрат калия противодействует потере кальция через почки и распаду кальция из костей. Проспективное контролируемое интервенционное исследование с участием 161 женщины в постменопаузе с остеопенией показало, что частичная нейтрализация кислотного воздействия, вызванного диетой (с использованием 30 ммоль цитрата калия в день, что эквивалентно 1,173 г калия), в течение двенадцати месяцев значительно увеличивала плотность костей и значительно улучшала костную ткань. состав. Цитрат калия был так же эффективен, как ралоксифен , модулятор рецепторов эстрогена, используемый для лечения и профилактики остеопороза у женщин в постменопаузе.
Калий - важный электролит . Ионы калия в основном находятся внутри клетки ( внутриклеточное пространство ), где они участвуют в поддержании потенциала покоя . Следовательно, высокие потери калия, например, из-за обильного потоотделения , могут привести к судорогам и состоянию истощения.
Продукты, богатые калием, обладают мочегонным / обезвоживающим действием . В диализных -pflichtigen пациентов с нарушенной функцией почек , важно , что они избегают сильных калия , содержащих пищевые продукты, так как это может привести к гиперкалиемии в опасных для жизни условиях.
Смертельная инъекция, используемая для казней в Соединенных Штатах, содержит, среди прочего, хлорид калия , который парализует сердечные мышцы и, таким образом, приводит к смерти.
Для получения дополнительной информации о физических эффектах калия
Уровни калия в продуктах питания
Продукты, богатые калием, включают грибы, бананы, финики, изюм, бобы, перец чили, сыр, шпинат и картофель, которые содержат от 0,2 до 1,0 г калия на 100 г пищи.
Уровень калия в продуктах, богатых калием, в мг на 100 г; из Национальной базы данных по питательным веществам Министерства сельского хозяйства США (2011 г.)
| Еда 100 г | калий |
|---|---|
| Соя (сушеная) | 1800 мг |
| Абрикосы (сушеные) | 1,370 мг |
| Пшеничные отруби | 1350 мг |
| фисташка | 1,020 мг |
| Томатная паста | 1,014 мг |
| Свекольные листья (приготовленные) | 909 мг |
| линзы | 840 мг |
| Изюм | 749 мг |
| Миндаль | 705 мг |
| Концентрат апельсинового сока | 674 мг |
| арахис | 658 мг |
| Свидание (Деглет Нур) | 656 мг |
| соевое молоко | 638 мг |
| Сладкие каштаны (жареные) | 592 мг |
| Гречневая мука (цельнозерновая) | 577 мг |
| Кешью | 565 мг |
| Картофель фри (растительное масло) | 550 мг |
| Картофель (неочищенный, запеченный) | 535 мг |
| Соевые бобы (приготовленные) | 515 мг |
| авокадо | 485 мг |
| Грейпфрутовый сок (белый) | 484 мг |
| Шпинат (приготовленный) | 466 мг |
| Подорожники (приготовленные) | 464 мг |
| белые бобы | 454 мг |
| Томатное пюре | 439 мг |
| Фасоль (приготовленная) | 402 мг |
Поскольку соли калия, содержащиеся в пище, очень хорошо растворяются в воде, содержание калия в пище можно заметно снизить за счет так называемого замачивания ( замачивания в воде в течение примерно трех-пяти часов). Это особенно важно для людей с нарушениями функции почек и обмена веществ.
радиоактивность
Природный калий состоит из 0,0117 процентов радиоактивного изотопа 40 K и, следовательно, имеет удельную активность 31,6 беккереля на грамм. При 0,17 мЗв в год это почти 10 процентов естественной дозы облучения в Германии (в среднем 2,1 мЗв в год) назад к собственному калию организма.
40 K распадается через β-распад : с вероятностью 89% через β - -разложение на стабильный 40 кальция и с вероятностью 11% через β + -распад или захват электрона (EC, K-capture) на стабильный 40 аргон . Период полураспада составляет 1,248 миллиарда лет.
Распад от 40 K до 40 Ar является важным источником аргона в атмосфере Земли и может также использоваться для определения возраста с помощью калий-аргонового датирования .
Физическая особенность
Металла калия может в соответствии с компьютерным моделированием при экстремальных давлении одновременно фиксированной и жидкости , чтобы быть потому , что, в соответствии с моделированием , то хотя большинство атомов в твердых барах , однако, расположить несколько атомов для жидкости , чтобы быть. Под экстремальным давлением калий представляет собой твердый блок, из которого одновременно вытекает жидкий калий.
Доказательство калия

В дополнение к спектроскопическому обнаружению, основанному на цвете пламени , ионы калия , растворенные в воде, могут быть обнаружены и определены потенциометрически с помощью ионоселективного электрода, специализирующегося на K + . Большинство калиевых электродов используют специфическое комплексообразование калия с валиномицином C 54 H 90 N 6 O 18 , который встроен в пластиковую мембрану в концентрации около 0,7%.
Качественное доказательство калия является возможным с помощью хлорной кислоты . Калий перхлорат (KClO 4 ) , который является умеренно растворим в воде в холоде, формы в виде белого осадка . Однако другие образующие катионы, такие как рубидий , цезий и белый аммоний , тяжелые в хладорастворимых осадках .
Калий можно определить количественно с помощью гравиметрии . Здесь калий представляет собой тетрафенилборат калия (K [B (C 6 H 5 ) 4 ]) путем добавления к раствору с осажденным калигностом, и полученный осадок уравновешивается.
Кроме доказательство можно также осадки от hexanitrocobaltate калия (III) , тартрат калия (K A = 3,80 · 10 -4 ) и гексахлороплатинат (IV) .
В рутинном анализе ( клиническая химия ( крови ), экологическая химию , химии воды ), калий определяется количественно вплоть до уровня трассировки с помощью пламенной фотометрии . Указанный здесь предел количественного определения составляет 100 мкг / л. В атомно-абсорбционной спектрометрии 1 мкг / л все еще можно обнаружить с помощью пламенного метода и 0,004 мкг / л с помощью метода графитовой печи.
ссылки
В его соединениях калий присутствует только в виде одновалентного катиона со степенью окисления 1.
Оксиды
Оксид калия представляет собой очень реактивное белое твердое вещество и имеет кристаллическую структуру антифторита в кубической кристаллической системе в пространственной группе Fm 3 m (пространственная группа № 225) . Там положения анионов и катионов меняются местами относительно их положений во флюорите : ионы калия связаны с 4 ионами оксида, а ионы оксида связаны с 8 ионами калия.
Пероксид калия - это очень реактивное твердое вещество- окислитель , которое само по себе не является горючим , но бурно реагирует с легковоспламеняющимися веществами . Сильно разлагается при контакте с водой . Он используется как окислитель и отбеливатель, а также для очистки воздуха .
Гипероксид калия - желтое, соленое соединение . Он разлагается в воде с образованием гидроксида калия , перекиси водорода и кислорода .
Галогениды
Хлорид калия образует бесцветные, легко растворимые в воде кристаллы без запаха . Хлорид калия встречается в природе в виде сильвина . Другими распространенными минералами и породами, содержащими калий и хлорид, являются карналлит (KCl · MgCl 2 · 6 H 2 O), каинит (KCl · MgSO 4 · 3 H 2 O) и сильвинит (KCl · NaCl). Он используется в пищевой промышленности как укрепляющий агент и усилитель вкуса . Он используется для производства из калийных удобрений и почти во всех калиевых соединений , используемых в промышленности , таких как карбонат калия , гидроксид калия используется.
Фторид калия - это белый гигроскопичный порошок, который обычно встречается в виде дигидрата . Он используется для производства из глазурей , в качестве добавки к цементу , в качестве оксидного компонента растворения алюминиевых порошков сварки, в качестве консерванта древесины и для травления стекла .
Калий бромистый используются для производства из серебра - эмульсии на пленках и пластинах для фотографических пленок , используемых. В проявителях фотографий он противодействует запотеванию и задерживает проявление.
Иодид калия находится в лаборатории для получения из раствора иодида калия йода , используемого (раствор Люголя). Он также используется в производстве иодида серебра , и в производстве из лекарственных средств, а в аналитической химии для обнаружения определенных соединений .
Все эти соединения калия имеет кубическую кристаллическую структуру с хлоридом натрия типа.
Больше связей
Гидроксид калия - белое гигроскопичное твердое вещество без запаха. В воде он растворяется с образованием сильного основного гидроксида калия, выделяющего большое количество тепла . В микросистемной технике он используется для селективного анизотропного травления монокристаллического кремния . В микробиологии он используется для различения грамположительных и грамотрицательных бактерий в процедуре экспресс- теста. Он используется в качестве электролита в гальванических датчиках кислорода . Он служит той же цели в широко распространенных щелочно-марганцевых элементах и исторически важных никель-кадмиевых батареях . Он используется в качестве регулятора кислотности в пищевой промышленности.
Карбонат калия - белый гигроскопичный порошок. Он имеет моноклинную кристаллическую структуру в пространственной группе P 2 1 / c (пространственная группа № 14) . Он используется в производстве из стекла , краски и фотографических разработчиков .
Гидрокарбонат калия используется как разделительный агент и регулятор кислотности в пищевых продуктах и как разрыхлитель .
Хлорат калия - это белая стабильная соль, которая превращается в бесцветный раствор в воде . Соединение имеет сильное окисление и волю среди прочего для производства из матчей , грунтовочных крышек и других пиротехнических изделий , используемых.
В чистом виде перхлорат калия образует ромбические призмы , размер которых может достигать нескольких сантиметров. Кристаллическая система является ромбической в пространственной группе Pnma (пространственная группа нет. 62) . Он часто используется в пиротехнике из-за его сильного огнестойкого эффекта и хорошего срока хранения , например, в качестве окислителя в молниях . Он редко используется в ракетных двигателях, потому что был заменен перхлоратом аммония .
Нитрат калия - основной компонент черного пороха . Он также используется для сохранения в пище используется.
Сульфат калия в основном используется в качестве удобрения .
Фосфат калия используется как добавка в моющие средства , как удобрение и как регулятор кислотности в пищевых продуктах .
Дихромат калия - это апельсиновая соль. Он имеет триклинную кристаллическую структуру в пространственной группе P 1 (пространственная группа № 2) . В лаборатории он используется в качестве окисляющего агента , реагента для обнаружения из перекиси водорода и основного титр вещества из - за свою жизнь хорошо полки . В технике он используется в кожевенном , гальваники , на матчи и для производства из chromosulfuric кислоты .
Перманганат калия представляет собой металлическое блестящее кристаллическое вещество почти черного цвета, являющееся сильным окислителем .
Гексацианоферрат (II) калия образует желтые моноклинные кристаллы . При окислении с перекисью водорода или хлора может быть Kaliumhexacyanidoferrat (III) , производится. В пищевой промышленности он используется как разделительный агент и стабилизатор . Однако его можно использовать в пищевых продуктах только в небольших количествах, поскольку цианистый водород может образовываться при нагревании или при воздействии кислот .
Цианид калия (цианид) представляет собой калиевую соль цианистого водорода и также очень токсичен. Он используется в промышленных производственных процессах , где он в основном используются для извлечения золота ( цианирования ) и в гальванических ваннах, но также и в синтетической органической химии для производства из нитрилов .
Калий кислый тартрат (зубной камень) представляет собой соль из винной кислоты . Он производится во время хранения из вина или виноградного сока . Он используется для производства винной кислоты и, вместе с гидрокарбонатом натрия, в качестве разрыхлителя .
Мыла являются натриевые или калиевые соли из жирных кислот . Для производства , жиры являются кипятили с каустической содой или калием раствором гидроксида . Этот процесс называется кипячением мыла , химической реакцией омыления . Жиры расщепляются на глицерин и щелочные соли жирных кислот (собственно мыло). В качестве альтернативы мыла могут быть получены непосредственно из свободных жирных кислот путем их реакции со щелочами с образованием их солей . Подходящими жирными кислотами являются, например, лауриновая кислота , миристиновая кислота , пальмитиновая кислота , стеариновая кислота , олеиновая кислота и рицинолевая кислота .
Индивидуальные доказательства
- ↑ а б Гарри Х. Биндер: Словарь химических элементов. С. Хирцель Верлаг, Штутгарт 1999, ISBN 3-7776-0736-3 .
- ↑ Значения свойств (информационное окно) взяты с сайта www.webelements.com (калий) , если не указано иное .
- ↑ CIAAW, Standard Atomic Weights Revised 2013 .
- ↑ a b c d e Запись о калии в Крамиде, А., Ральченко, Ю., Ридере, Дж. И NIST ASD Team (2019): База данных атомных спектров NIST (версия 5.7.1) . Издание: НИСТ , Гейтерсбург, Мэриленд. DOI : 10.18434 / T4W30F ( https://physics.nist.gov/asd ). Проверено 11 июня 2020 года.
- ↑ a b c d e Запись по калию в WebElements, https://www.webelements.com , по состоянию на 11 июня 2020 г.
- ^ Н. Н. Гринвуд, А. Эрншоу: Химия элементов. 1-е издание. VCH, Weinheim 1988, ISBN 3-527-26169-9 , стр.97 .
- ↑ Роберт К. Уист и др. (Ред.): Справочник по химии и физике CRC . CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9 , стр. E-129 - E-145. Значения здесь основаны на г / моль и даны в единицах cgs. Приведенное здесь значение представляет собой рассчитанное на его основе значение в системе СИ без единицы измерения.
- ↑ a b Иминь Чжан, Джулиан Р.Г. Эванс, Шоуфэн Ян: Скорректированные значения точек кипения и энтальпий испарения элементов в справочниках. В: Journal of Chemical & Engineering Data. 56, 2011, стр. 328-337, DOI : 10.1021 / je1011086 .
- ^ Людвиг Бергманн, Клеменс Шефер, Райнер Кассинг: твердое тело. (= Учебник экспериментальной физики . Том 6). 2-е издание. Де Грюйтер, Берлин 2005 г., ISBN 3-11-017485-5 , стр. 361.
- ↑ Дэвид Р. Лид (Ред.): Справочник по химии и физике CRC . 90-е издание. (Интернет-версия: 2010 г.), CRC Press / Taylor and Francis, Boca Raton, FL, Electrochemical Series, pp. 8-22.
- ↑ б запись на калий в базе данных GESTIS субстанцию на выставке IFA , доступ к 16 декабря 2019 года. (Требуется JavaScript)
- ↑ Вход на калий в классификации и маркировки Перечня в Европейское химическое агентство (ECHA), доступ к 1 августа 2016 г. Производители или дистрибьюторы могут расширить гармонизированной системы классификации и маркировки .
- ^ A b Статистика и информация о калийных удобрениях . Геологическая служба США.
- ^ Дэвид Дж. Уишарт: Энциклопедия Великих равнин . U of Nebraska Press, 2004, ISBN 978-0-8032-4787-1 , стр. 433.
- ↑ Новая техника обнаруживает газообразные металлы в атмосферах экзопланеты wired.com, 31 августа 2010 г.
- ↑ Астрономы находят калий в атмосфере гигантской планеты sciencedaily.com, 1 сентября 2010 г. (по состоянию на 20 сентября 2010 г.).
- ^ А. Е. ван Arkel, П. Aßmann, Г. Борелиус, Г. Chaudron, EJ Daniels, Р. Gadeau, В. Geibel, В. грассмановы, CR Hayward, Г. Янч, W. Kroll, К. Линс: Reine Металлы: Производство · Свойства · Использование , издатель AE van Arkel, Verlag Springer-Verlag, 2013, ISBN 9783642996955 .
- ↑ Георг Брауэр: Свободные щелочные металлы . В кн . : Справочник по препаративной неорганической химии . Фердинанд Энке Верлаг, Штутгарт, 1954, стр. 724 ff .
- ^ PE Mason, F. Uhlig, V. Vanek, T. Buttersack, S. Bauerecker, P. Jungwirth: Кулоновский взрыв на ранних стадиях реакции щелочных металлов с водой. В кн . : Природная химия. Том 7, номер 3, март 2015 г., стр. 250-254, DOI: 10.1038 / nchem.2161 , PMID 25698335 .
- ↑ Freie Universität Berlin , Институт химии и биохимии по утилизации калия ( памятная записка от 13 декабря 2013 г. в веб-архиве. Сегодня )
- ↑ Дж. Эверс, Т. М. Клапётке , Г. Элингер: Опасная корка моногидрата гидроксида калия. В: Новости химии и машиностроения , 80 (37), стр. 2, 4.
- ↑ GLCM van Rossen, H. van Bleiswijk: О диаграмме состояния калий-натриевых сплавов. В: Z. anorg. allg. Chem. , 1912, 74, стр. 152-156. DOI: 10.1002 / zaac.19120740115 .
- ↑ Конрад Менгель: Питание и метаболизм растений. 7-е издание. Fischer, Jena 1991, ISBN 3-334-00310-8 , стр. 335-346.
- ↑ Shieh et al: Калиевые каналы: молекулярные дефекты, заболевания и терапевтические возможности. В: Pharmacol Rev . 52 (4), декабрь 2000 г., стр. 557-594, PMID 11121510 .
- ^ Тамарго и др.: Фармакология сердечных калиевых каналов. В: Cardiovasc Res . 62 (1), 1 апреля 2004 г., стр. 9-33, PMID 15023549 .
- ↑ Нимейер и др.: Модуляция двухпорового домена кислотно-чувствительного K + канала TASK-2 (KCNK5) путем изменения объема клетки. В: J Biol Chem . 276 (46), 16 ноября 2001 г., стр. 43166-43174, PMID 11560934 .
- ↑ Шен и др.: Изоформа котранспортера KCl KCC3 может играть важную роль в регуляции роста клеток. В: Proc Natl Acad Sci USA . 98 (25), 4 декабря 2001 г., стр. 14714-14719, PMID 11724933 .
- ↑ Янг и др.: Детерминанты сердечного фиброза в экспериментальных гиперминералокортикоидных состояниях. В: Am J Physiol-Endocrinol Metab . 269 (4, часть 1), октябрь 1995 г., стр. E657-E662, PMID 7485478 .
- ↑ Янг и Ма: Сосудистые защитные эффекты калия. В кн . : Семин Нефрол . 19, 1999, стр. 477-486, PMID 10511387 .
- ↑ Кришна: Влияние потребления калия на кровяное давление. В: J Am Soc Nephrol . 1 (1), июль 1990 г., стр. 43-52, PMID 2104250 .
- ^ Suter: Калий и гипертония. В: Nutr Rev.56 (5, часть 1), май 1998 г., стр. 151-153, PMID 9624886 .
- ↑ Янг и др.: Сердечно-сосудистые защитные механизмы калия. В: Am J Physiol-Regul Integr Comp Physiol . 268 (4 Pt 2), апрель 1995 г., стр. R825-R837, PMID 7733391 .
- ^ Таннен: Влияние калия на кровяное давление. В: Kidney Int Suppl . 22, 1987, стр. S242-S248, PMID 3323616 .
- ↑ Frassetto et al.: Диета, эволюция и старение - патофизиологические эффекты пост-сельскохозяйственной инверсии соотношений калия и натрия и оснований и хлоридов в рационе человека. В: Eur J Nutr. 40 (5), октябрь 2001 г., стр. 200-213, PMID 11842945 .
- ↑ Frassetto et al.: Оценка чистого производства эндогенной неуглеродной кислоты у людей из содержания калия и белка в рационе. В: Am J Clin Nutr. 68 (3), сентябрь 1998 г., стр. 576-583, PMID 9734733 .
- ↑ Frassetto et al.: Бикарбонат калия снижает выведение азота с мочой у женщин в постменопаузе. В: J Clin Endocrinol Metab . 82 (1), январь 1997 г., стр. 254-259, PMID 8989270 .
- ↑ Manz et al.: Факторы, влияющие на способность выведения ионов водорода почками у здоровых детей. В кн . : Педиатр Нефрол . 16 (5), май 2001 г., стр. 443-445, PMID 11405120 .
- ↑ Ремер и др.: Потенциальная почечная кислотная нагрузка и почечная чистая экскреция кислоты у здоровых, свободно живущих детей и подростков. В: Am J Clin Nutr. 77 (5), май 2003 г., стр. 1255-1260, PMID 12716680 .
- ^ Ремер: Влияние диеты на кислотно-щелочной баланс. В: Semin Dial.13 (4), июль-август 2000 г., стр. 221-226, PMID 10923348 .
- ↑ Таннен: Влияние калия на закисление почек и кислотно-щелочной гомеостаз. В: Семин Нефрол . 7 (3), сентябрь 1987 г., стр. 263-273, PMID 2825318 .
- ↑ Европейское агентство по безопасности пищевых продуктов : EFSA Journal. 8 (2), 2010, с. 1469.
- ↑ Федеральный институт оценки риска : использование минералов в продуктах питания: токсикологические и физиологические аспекты .
- ↑ Curhan et al.: Сравнение диетического кальция с дополнительным кальцием и другими питательными веществами как факторами, влияющими на риск образования камней в почках у женщин. В: Ann Intern Med . 126 (7), 1 апреля 1997 г., стр. 497-504. PMID 9092314 .
- ↑ Хирвонен и др.: Потребление питательных веществ и употребление напитков и риск образования камней в почках среди курящих мужчин. В: Am J Epidemiol. 150 (2), 15 июля 1999 г., стр. 187-194. PMID 10412964 .
- ↑ Кесслер и Гессе: перекрестное исследование влияния минеральной воды, богатой бикарбонатом, на состав мочи в сравнении с цитратом калия натрия у здоровых мужчин. В: Br J Nutr. 84 (6), декабрь 2000 г., стр. 865-871. PMID 11177203 .
- ↑ Macdonald et al.: Связь питания с потерей костной массы во время менопаузального перехода: доказательства положительного эффекта кальция, алкоголя, фруктовых и овощных питательных веществ, а также вредного воздействия жирных кислот. В: Am J Clin Nutr. 79 (1), январь 2004 г., стр. 155–165. PMID 14684412 .
- ↑ Моррис и др.: Разные эффекты дополнительных KCl и KHCO3: патофизиологические и клинические последствия. В кн . : Семин Нефрол. 19 (5), сентябрь 1999 г., стр. 487-493. PMID 10511388 .
- ↑ Sellmeyer et al: Цитрат калия предотвращает повышенную экскрецию кальция с мочой и резорбцию костей, вызванную диетой с высоким содержанием хлорида натрия. В: J Clin Endocrinol Metab. 87 (5), май 2002 г., стр. 2008-2012. PMID 11994333 .
- ^ A b Suter: Влияние калия, магния, кальция и клетчатки на риск инсульта. В: Nutr Rev.57 (3), март 1999 г., стр. 84-88. PMID 10101922 .
- ↑ a b Институт Макса Рубнера, Федеральный научно-исследовательский институт питания и пищевых продуктов (2008) Национальное исследование потребления II. Отчет о результатах, часть 2. Общенациональное исследование питания подростков и взрослых. ( Памятка от 28 декабря 2013 г. в Интернет-архиве ) (PDF; 3,3 МБ).
- ↑ a b Eaton et al.: Возвращение к палеолитическому питанию: двенадцатилетняя ретроспектива его природы и последствий. В: Eur J Clin Nutr. 51 (4), 1997, стр. 207-216. PMID 9104571 .
- ^ П. Эллиотт, И. Браун: Потребление натрия во всем мире. Справочный документ, подготовленный для Форума и Технического совещания по снижению потребления соли населением (Париж, 5-7 октября 2006 г.) . (PDF; 2,2 МБ).
- ↑ a b Всемирная организация здравоохранения: Рекомендации: потребление калия взрослыми и детьми. Женева, 2012 г. (PDF; 564 kB).
- ^ Всемирная организация здравоохранения: Глобальная стратегия по питанию, физической активности и здоровью. Стратегии снижения содержания натрия в популяции . Проверено 13 декабря 2013 года.
- ↑ Suter et al.: Факторы питания в контроле артериального давления и гипертонии. В: Nutr Clin Care. 5 (1), январь-февраль 2002 г., стр. 9-19, PMID 12134718 .
- ↑ Тобиан: Пищевые хлорид натрия и калий влияют на патофизиологию гипертонии у людей и животных. В: Am J Clin Nutr. 65 (2 Suppl), февраль 1997 г., стр. 606S-611S, PMID 9022555 .
- ↑ Баззано и др.: Потребление калия с пищей и риск инсульта у мужчин и женщин в США: Национальное исследование здоровья и питания. Последующее эпидемиологическое исследование. В: Инсульт. 32 (7), июль 2001 г., стр. 1473-1480, PMID 11441188 .
- ↑ Ascherio et al.: Потребление калия, магния, кальция и клетчатки и риск инсульта среди мужчин в США. В кн . : Тираж. 98 (12), 22 сентября 1998 г., стр. 1198-1204, PMID 9743511 .
- ↑ Barri & Wingo: Влияние дефицита калия и добавок на кровяное давление: клинический обзор. В: Am J Med Sci. 314 (1), июль 1997 г., стр. 37-40, PMID 9216439 .
- ↑ Geleijnse et al.: Электролиты связаны с кровяным давлением в пожилом возрасте: Роттердамское исследование. В: J Hum Hypertens. 11 (7), июль 1997 г., стр. 421-423, PMID 9283057 .
- ↑ Khaw & Barrett-Connor: Диетический калий и кровяное давление у населения. В: Am J Clin Nutr. 39 (6), июнь 1984 г., стр. 963-968, PMID 6720624 .
- ↑ Khaw & Barrett-Connor: Пищевые волокна и снижение смертности от ишемической болезни сердца у мужчин и женщин: 12-летнее проспективное исследование. В: Am J Epidemiol. 126 (6), декабрь 1987 г., стр. 1093-1102, PMID 2825519 .
- ↑ Siani et al.: Контролируемое испытание долгосрочных пероральных добавок калия у пациентов с легкой гипертензией. В: Br Med J (Clin Res Ed). 294 (6585), 6 июня 1987 г., стр. 1453-1456, PMID 3300841 .
- ↑ Светкей и др.: Двойное слепое плацебо-контролируемое испытание хлорида калия в лечении легкой гипертензии. В кн . : Гипертония. 9 (5), май 1987 г., стр. 444-450, PMID 3570421 .
- ↑ Sacks et al.: Влияние пониженного содержания натрия в пище на артериальное давление и диетические подходы к борьбе с гипертонией (DASH). Группа совместных исследований DASH-Sodium. В: N Engl J Med . 344 (1), 4 января 2001 г., стр. 3-10, PMID 11136953 .
- ↑ Воллмер и др.: Новые сведения о влиянии на артериальное давление диет с низким содержанием соли и высоким содержанием фруктов и овощей и нежирных молочных продуктов. В: Curr Control Trials Cardiovasc Med.2 (2), 2001, pp. 71-74, PMID 11806776 .
- ↑ Земель: Диета и гипертония: исследование DASH. Диетические подходы к остановке гипертонии. В: Nutr Rev.55 (8), август 1997 г., стр. 303-305, PMID 9287480 .
- ↑ Федеральный институт оценки рисков: использование минералов в продуктах питания.
- ↑ Европейское агентство по безопасности пищевых продуктов : EFSA Journal. 8 (2), 2010, с. 1469.
- ↑ Харрингтон, Кэшман: высокое потребление соли, по-видимому, увеличивает резорбцию костей у женщин в постменопаузе, но высокое потребление калия смягчает этот неблагоприятный эффект. В: Nutr Rev.61 (5, часть 1), май 2003 г., стр. 179-183, PMID 12822707 .
- ↑ Lemann et al.: Введение калия снижает, а его депривация увеличивает выведение кальция с мочой у здоровых взрослых. В: Kidney Int. 39 (5), май 1991 г., стр. 973-983, PMID 1648646 .
- ↑ New et al.: Более низкие оценки чистой эндогенной продукции неуглеродистой кислоты положительно связаны с индексами здоровья костей у женщин в пременопаузе и перименопаузе. В: Am J Clin Nutr. 79 (1), январь 2004 г., стр. 131-138. PMID 14684409 .
- ↑ Барзель: Скелет как система ионного обмена: значение кислотно-щелочного дисбаланса в генезе остеопороза. В: J Bone Miner Res . 10 (10), октябрь 1995 г., стр. 1431-1436, PMID 8686497 .
- ↑ Frassetto et al.: Влияние возраста на кислотно-основной состав крови у взрослых людей: роль возрастного снижения функции почек. В: Am J Physiol. 271 (6, часть 2), декабрь 1996 г., стр. F1114-F1122, PMID 8997384 .
- ↑ Леманн: Взаимосвязь между кальцием с мочой и чистым выделением кислоты, определяемая диетическим белком и калием: обзор. В: Нефрон. 81 Приложение 1, 1999, стр. 18-25, PMID 9873210 .
- ↑ Мэсси: Диетический животный и растительный белок и здоровье костей человека: подход из цельных продуктов. В: J Nutr. 133 (3), март 2003 г., стр. 862S-865S, PMID 12612170 .
- ↑ Моррис и др.: Различные эффекты дополнительных KCl и KHCO 3 : патофизиологические и клинические последствия. В кн . : Семин Нефрол. 19 (5), сентябрь 1999 г., стр. 487-493, PMID 10511388 .
- ^ Ремер и Манц: Не забывайте о кислотно-основном статусе при изучении метаболических и клинических эффектов дефицита калия с пищей. В: J Clin Endocrinol Metab. 86 (12), декабрь 2001 г., стр. 5996-5997, PMID 11739479 .
- ^ Ремер: Влияние диеты на кислотно-щелочной баланс. В: Semin Dial.13 (4), июль-август 2000 г., стр. 221-226, PMID 10923348 .
- ↑ a b S. Jehle et al.: Частичная нейтрализация ацидогенной западной диеты цитратом калия увеличивает костную массу у женщин в постменопаузе с остеопенией. В: J Am Soc Nephrol. 17, 2006, стр. 3213-3222, PMID 17035614 .
- ↑ M. Marangella et al.: Влияние добавок цитрата калия на метаболизм костей. В: Calcif Tissue Int. 74, 2004, стр. 330-335, PMID 15255069 .
- ↑ DE Sellmeyer et al.: Цитрат калия предотвращает повышенную экскрецию кальция с мочой и резорбцию костей, вызванную диетой с высоким содержанием хлорида натрия. В: J Clin Endocrinol Metab. 87, 2002, стр. 2008-2012, PMID 11994333 .
- ↑ Национальная база данных по питательным веществам Министерства сельского хозяйства США для стандартной справки, выпуск 24 «Содержание выбранных продуктов по общему показателю, калий, K (мг), отсортированные по содержанию питательных веществ ( Мементо от 5 апреля 2013 г. в Интернет-архиве )» (PDF; 150 kB).
- ↑ курага . Веб-сайт Немецкой сети рекомендаций и информации по питанию. Проверено 21 октября 2012 года.
- ↑ Низкокалиевая диета - Практические советы .
- ↑ Федеральное управление радиационной защиты: Какие радионуклиды содержатся в продуктах питания? Проверено 19 августа 2014 года.
- ^ С. Майкл Ледерер, Джек М. Холландер, Айседор Перлман : Таблица изотопов, John Wiley & Sons , Нью-Йорк, 1967.
- ↑ Калий-40 - с периодом полураспада 1,28 миллиарда лет, длительный и радиоэкологически значимый
- ↑ Livechart - Table of Nuclides - Ядерная структура и данные о распаде. Проверено 11 февраля 2020 года .
- ↑ Таблица нуклидов. Проверено 11 февраля 2020 года .
- ^ Андреас Херманн: Элементы могут быть твердыми и жидкими одновременно. В: Новости - Эдинбургский университет . 9 апреля 2019, доступ к 10 апреля 2019 .
- ↑ a b Карл Камманн (Ред.): Инструментальная аналитическая химия. Spektrum, Heidelberg 2001, ISBN 3-8274-0057-0 , стр. 4-60.
- ^ А. Ф. Holleman , Е. Wiberg , Н. Wiberg : Учебник неорганической химии . 102-е издание. Вальтер де Грюйтер, Берлин 2007, ISBN 978-3-11-017770-1 , стр. 1286.
- ^ A b А. Ф. Холлеман , Э. Виберг , Н. Виберг : Учебник неорганической химии . 101-е издание. Вальтер де Грюйтер, Берлин, 1995 г., ISBN 3-11-012641-9 , стр. 1176.
- ↑ запись на хлористый калий в базе вещества GESTIS из в IFA , доступ к 17 декабря 2019 года. (Требуется JavaScript)
- ↑ С.-П. Баллштадт, П. Рейнхард, М. Рентшлер, Э. Роттлендер, А.А. Боденштедт, Д. Бризен, А. Брукхаус, Й. Бюшенфельд, А. Хауптманн, Д.А. Хиллер: Изменение почв в результате антропогенного воздействия: Междисциплинарное учебное пособие , Verlaginger Springer Берлин Гейдельберг, 1997, ISBN 3-540-61556-3
- ^ А. Ф. Holleman , Е. Wiberg , Н. Wiberg : Учебник неорганической химии . 101-е издание. Вальтер де Грюйтер, Берлин, 1995 г., ISBN 3-11-012641-9 , стр. 1170.
- ↑ запись на гидроксидом калия в базе вещества GESTIS из в МРС , доступ к 17 декабря 2019 года. (Требуется JavaScript)
- ↑ Y. Idemoto, JW Richardson, N. Koura, S. Kohara, CK Loong: Кристаллическая структура (Li x K 1-x ) 2 CO 3 (x = 0,0.43,0.5,0.62,1) методом нейтронной порошковой дифракции анализ. В: Журнал физики и химии твердого тела , 59, 1998 г., стр. 363-376, DOI : 10.1016 / S0022-3697 (97) 00209-6 .
- ↑ Дж. К. Брэндон, И. Д. Браун: Точное определение кристаллической структуры триклинного дихромата калия, K 2 Cr 2 O 7 . В: Канадский химический журнал . Лента 46 , нет. 6 , 15 марта 1968 г., стр. 933-941 , DOI : 10,1139 / v68-155 ( PDF ).
- ↑ Аксель Траутманн, Йорг Кляйне-Теббе: Аллергология в клинике и практике Аллергены - Диагностика - Терапия . Георг Тиме Верлаг, 2013, ISBN 978-3-13-159352-8 , стр. 227 ( ограниченный просмотр в поиске Google Книг).
- ↑ Ханс-Дитер Якубке, Рут Керхер (ред.): Химический словарь , Академическое издательство Spectrum, Гейдельберг, 2001.