D- аминокислоты
D- аминокислоты представляют собой класс аминокислот, в которых присутствуют функциональные группы - карбокси (-COOH) и амино (-NH 2 ) - α-положение в D - конфигурации . Они являются зеркальным отражением изомеров в L - аминокислоты.
D- аминокислоты представлены во всех известных биологических системах значительно реже , чем их L - изомеры , которые являются важными строительными блоками жизни в виде 23 протеиногенных аминокислот . Поэтому долгое время считалось, что D- аминокислоты вообще не имеют биологической функции и являются «неестественными». Эта картина изменилась с начала 1990-х годов. Сегодня мы знаем, что D- аминокислоты содержатся в пептидных антибиотиках, вырабатываемых, например , бактериями , а также в различных растениях, таких как рис, чеснок и горох.
Некоторые D- аминокислоты также выполняют важные физиологические функции у человека . В частности , в центральной нервной системе это D - серин и D - аспарагиновая кислота . D- аминокислоты, по-видимому, также играют роль в некоторых заболеваниях , таких как шизофрения . Эта область исследований является сравнительно новой, и многие функции свободных D- аминокислот и тех, которые связаны в пептидах или белках , все еще в значительной степени неизвестны или непонятны.
С помощью методов хроматографического анализа D- аминокислоты могут быть обнаружены в ряде пищевых продуктов и организмов . Одним из приложений здесь является определение возраста окаменелостей по аминокислотам .
Согласно текущему состоянию науки, свободные D- аминокислоты безвредны для человека в количествах, потребляемых ежедневно с пищей. Технически производимые D- аминокислоты используются в качестве строительных блоков для производства (пол) синтетических антибиотиков и являются химически связанными компонентами большого числа других лекарств .
Основы
Хиральность

За исключением глицина , простейшей аминокислоты, все протеиногенные аминокислоты имеют по крайней мере один атом углерода, который несет четыре разных атома или группы атомов ( заместителей ). С пространственной точки зрения эти заместители занимают четыре угла тетраэдра . Такое расположение вызывает асимметрию, которая приводит к двум различным возможностям выравнивания заместителей. Эти две формы, называемые энантиомерами или зеркальными изомерами, ведут себя как изображение и зеркальное отражение. Асимметричный атом углерода образует так называемый стереоцентр . Изображение и зеркальное отображение энантиомеров не могут совпадать. То же самое и с предметами повседневной жизни, у которых нет вращающейся оси зеркала . Руки - тому пример. Левая и правая руки подобны отражению и зеркальному отражению, но их нельзя совместить. Различия между правой и левой рукой становятся особенно очевидными, когда они взаимодействуют с другими хиральными (греческое слово, обозначающим «рука») системами. Например, когда правая рука трясет вторую правую или левую руку или пытается надеть «не ту» перчатку. В хиральных средах также очевидны различия в молекулярных энантиомерах.
Немецкий лауреат Нобелевской премии по химии Эмиль Фишер разработал проекционный метод, проекцию Фишера , с помощью которого пространственная структура хирального химического соединения может быть четко отображена в двух измерениях. Он выбрал эталонное вещество ( глицеральдегид ). Согласно правилам проекции Фишера, кислотная группа ( карбоксильная группа ) всегда рисуется вверху, а остаток R, который различает аминокислоты, всегда рисуется внизу. Если в этом методе проекции аминогруппа находится слева ( лат. Laevus ), говорят о L- аминокислоте. Буква L ставится перед названием аминокислоты маленькими заглавными буквами ; например L - серин . Если аминогруппа находится справа в проекции Фишера (латинское: dexter = 'right'), то это D -аминокислота. Прилагательные left и right относятся исключительно к конфигурации, показанной в соответствии с проекцией Фишера .
По своим физическим свойствам , таким как точка плавления , плотность , растворимость в воде и других растворителях и изоэлектрическая точка , D- и L- аминокислоты полностью идентичны. Даже в ахиральной среде, то есть в среде, в которой нет других хиральных молекул, они ведут себя одинаково, за одним исключением: два энантиомера вращают плоскость поляризации линейно поляризованного света в одинаковых условиях (концентрация, температура, значение pH , Растворители и др.) Одинаковы по вкладу, но в разных направлениях. Если повернуть свет по часовой стрелке, он называется по часовой стрелке или (+) - формой. Форма поворота против часовой стрелки называется поворотом влево или (-) формой. Направление и направление вращения аминокислот практически не играют роли в повседневной практике. Конфигурация - D - или L гораздо важнее . Направление вращения аминокислоты (влево или вправо) полностью не зависит от конфигурации аминокислоты. Это очень часто искажается в литературе. Часто термин «левовращающие аминокислоты» используется по отношению к L- аминокислотам . Фактически, направление вращения и направление вращения сильно зависят от внешней среды. Например, аминокислота L - лейцин имеет более конкретный угол от поворота на + 15,1 ° (= против часовой стрелка) при комнатной температуре в шесть молярной соляной кислоте и на угол конкретного от поворота на -10,8 ° (= по часовой стрелке) в нейтральной воде. С другой стороны, у 3-молярного едкого натра он равен 7,6 ° против часовой стрелки.
Смесь 50% D- и 50% L- аминокислот называется рацематом . Рацематы возникают, среди прочего, при обычном техническом синтезе аминокислот. Они оптически неактивны, то есть не способны вращать плоскость колебаний поляризованного света. По сравнению с чистыми энантиомерами рацематы иногда обладают разными физическими свойствами (например, точкой плавления ), но неизменно разными физиологическими свойствами.
Соглашения об именах и номенклатура
Проекция Фишера по-прежнему является предпочтительной проекционной системой для аминокислот и сахаридов . Кроме того, для аминокислот используется конвенция Кана-Ингольда-Прелога (система CIP), которая описывает абсолютную конфигурацию хиральных молекул. Согласно системе CIP, большинство протеиногенных L- аминокислот являются ( S ) -аминокислотами. Их зеркальные отражения, D- аминокислоты, почти всегда имеют ( R ) -конфигурацию. Исключение является L - цистеин , L - цистин и L - селеноцистеин , так как сера и селен , имеют более высокий приоритет , чем кислород , в соответствии с номенклатурой CIP . Эти три L- аминокислоты находятся в ( R ) конфигурации. Напротив, три соответствующих D- аминокислоты имеют ( S ) конфигурацию.
В аминокислотных последовательностях , в D - аминокислота в три буквах коды предшествует строчный капитал D (небольшие колпачки).
На примере гептапептидного дерморфина
H-Tyr-D-Ala-Phe-Gly-Tyr-Pro-Ser-NH2
В одном -Письме коды , D - аминокислоты снабжены строчная буква L -аминокислот.
В примере с дерморфином:
YaFGYPS-NH2
Естественное происхождение и история открытия
D- аминокислоты встречаются в природе гораздо реже, чем изомерные L- аминокислоты, в которых протеиногенные аминокислоты вместе с нуклеиновыми кислотами представляют собой основные строительные блоки жизни . Подобная асимметрия встречается в двух типах энантиомеров в случае углеводов . Здесь D -форма, например , Д - глюкозы , является «естественной» конфигурацией. Подсчитано, что D- глюкозы в 10 15 раз больше, чем L- глюкозы на Земле . До сих пор нет надежных оценок аминокислот.
Долгое время считалось, что только L- аминокислоты отбирались для образования пептидов и белков в процессе эволюции. С 1980-х годов усовершенствованные аналитические методы привели к пересмотру этого предположения. D- аминокислоты обнаруживаются у все большего числа живых существ , так что они имеют значительно большее распределение и частоту, чем предполагалось изначально. Поэтому в новейшей литературе D- аминокислоты рассматриваются как общий компонент растений и пищевых продуктов. Но даже у высших живых существ, включая людей, D- аминокислоты участвуют в важных физиологических процессах, некоторые из которых до сих пор в значительной степени не изучены.
Развитие жизни на Земле предполагало гомохиральность , то есть однородную конфигурацию аминокислот и других строительных блоков жизни. Самовоспроизведение не может происходить в рацемической среде . Существует ряд гипотез о первопричине крайнего дисбаланса частот двух изомерных форм аминокислот . Существует широко распространенное согласие с того момента, когда произошел первый небольшой дисбаланс в природе между D- и L- конфигурациями. С этого момента хиральная амплификация - своего рода самоусиливающийся эффект, который приводит в химической реакции к дальнейшему увеличению энантиомерной формы, которая ранее была в небольшом избытке, - может быть использована для объяснения крайнего обогащения энантиомерной формы. хорошо. Однако совершенно неясно, как была нарушена зеркальная симметрия , что с большой вероятностью привело к первоначальному небольшому избытку L- конфигурации в аминокислотах задолго до зарождения жизни на Земле . Возможными причинами нарушения зеркальной симметрии являются, среди прочего, нарушение четности при β-распаде ( гипотеза Вестера-Ульбрихта ) и «инокуляция изначального супа » излишками внеземных L- аминокислот. Последняя теория подтверждается тем фактом, что, например, в метеорите Мерчисон может быть обнаружен избыток соответствующего L- энантиомера непротеиногенных аминокислот 2-амино-2,3-диметилпентановой кислоты и изовалина . В метеорите Мерчисон избыток L- изовалина составил около 18,5 процента, а в метеорите Оргейл - около 15,2 процента. Этот избыток, возможно, был вызван ультрафиолетовым излучением с круговой поляризацией , которое - подтверждено экспериментально - преимущественно разрушает D- аминокислоты.
Образование D- аминокислот путем рацемизации
Большее количество D- аминокислот может быть результатом рацемизации L- аминокислот. Образование рацемата аминокислоты , т.е. смеси, содержащей 50% D- и 50% L- аминокислот, является термодинамически предпочтительным. Энтальпия остается неизменной, но чем выше «степень расстройства» приводит к увеличению энтропии , что означает , что свободная энтальпия Δ G системы уменьшается. Значение при 25 ° C около -1,6 кДж / моль . Более высокие температуры приводят к более высокому высвобождению свободной энтальпии, поэтому рацемизация значительно ускоряется. Полураспад рацемизации, который определяется как время , в течение которого значение й падает от 100 до 50%, зависит не только от температуры, но и от рНа , аминокислот, растворителя или влажности и наличия из катализаторов . При постоянных условиях рацемизацию можно рассчитать заранее или, наоборот, возраст исследуемого образца можно определить по степени рацемизации. Этот процесс, известный как датирование по аминокислотам , можно использовать для определения возраста образцов окаменелостей, а также живых организмов. Со смертью прекращаются все процессы, препятствующие рацемизации аминокислот в пораженных организмах. Жизнь - это борьба с энтропией, и самое позднее со смертью прекращаются процессы, противодействующие рацемизации. В некоторых тканях с чрезвычайно низким метаболизмом белка этот процесс начинается после того, как ткань сформировалась. Примером этого является коллагена в дентине с зубами или хрусталика глаза . Относительно постоянные значения температуры и pH в зубах также позволяют определять возраст живого организма с точностью приблизительно ± 4 года по степени рацемизации аспарагиновой кислоты . Процедура используется, в том числе, в криминалистике . Примером эффективности этого метода являются исследования, проведенные в 1996 году на костях императора Лотара фон Суплинбурга (1075–1137). По сравнению со своей женой Риченцей и Генрихом Гордым , Лотар имел гораздо более высокую степень рацемизации, что соответствовало бы возрасту около 9000 лет. С другой стороны, степень рацемизации двух образцов сравнения очень хорошо соответствовала их возрасту примерно 850 лет. Степень рацемизации L- аспарагиновой кислоты измеряли во всех трех случаях . Высокая степень рацемизации Лотара объясняется особыми обстоятельствами его смерти. Он умер недалеко от Брайтенванг в Тироле , примерно в 700 км от своей штаб-квартиры в Кенигслуттер-ам-Эльм . Чтобы защитить его труп от разложения перед длительной транспортировкой, с трупом обращались в соответствии с «немецким обычаем» ( mos teutonicus ). Труп Лотара был сварен, мясо снято с костей, а кости переданы Кенигслаттеру. В результате кипячения L- аспарагиновая кислота, измеренная 859 лет спустя, рацемизировалась гораздо сильнее, чем в обычно захороненных трупах жены и зятя. Используя степень рацемизации, можно определить время варки, равное примерно шести часам.
В волосах трупа человека из Тизенйоха возрастом около 5300 лет , более известного как « Эци », 37% гидроксипролина находится в D- конфигурации. В мумии возрастом 3000 лет - 31%, в волосах средневековья (возраст около 1000 лет) - 19%, а в свежих образцах волос - 4%.
L- аминокислоты в белках также могут рацемизироваться под воздействием температуры и экстремальных значений pH при приготовлении пищи . Отдельные аминокислоты рацемизируются с разной скоростью. Скорость рацемизации сильно зависит от боковой цепи соответствующей аминокислоты и аминокислот в ее окрестностях. Электроноакцепторные группы способствуют протонированию атома α-C, что способствует рацемизации. Это относится, например, к серину и аспарагиновой кислоте. Кроме того, стерические эффекты также играют роль. Аспарагин и аспарагиновая кислота рацемизируются особенно легко, если пептидная последовательность содержит глицин в непосредственной близости. Затем может образовываться циклический сукцинимид, который термодинамически сильно способствует эпимеризации. При низких значениях pH, например в шестимолярной соляной кислоте, наиболее сильно рацемизируется аспарагиновая кислота. Пролин и глутаминовая кислота рацемизируются намного медленнее , в то время как изолейцин , валин , серин и треонин рацемизируются в этих условиях очень слабо. Напротив, серин рацемизируется быстрее всего в одномолярном растворе гидроксида натрия, за ним следуют аспарагиновая кислота, фенилаланин , глутаминовая кислота и валин.


Рацемизация, катализируемая основанием и кислотой, требует довольно жестких условий реакции, чтобы получить полную рацемизацию за несколько часов. Напротив, в биологических системах катализируемая ферментами рацемизация происходит намного быстрее и в очень мягких условиях - в диапазоне нейтральных pH и при комнатной температуре или температуре тела. Рацемазы катализируют депротонирование по атому α-C аминокислоты. Атом водорода в этом положении чрезвычайно слабокислый. Константа кислотности протонированной формы имеет значение pK s ≈21, а значение изоэлектрической точки ≈29 даже меньше. В большинстве рацемаз отщепление протона значительно облегчается пиридоксальфосфатом (PLP). В активном центре этих ферментов PLP связан с остатком лизина . Аминогруппа L- аминокислоты связывается с альдегидной группой PLP и, таким образом, образует основание Шиффа (альдимин). В качестве электрофильного катализатора PLP отбирает электроны от атома α-C аминокислоты через ароматическое кольцо , которое депротонируется намного легче. Кроме того, оставшийся анион стабилизируется как мезомер . Репротонирование и добавление воды затем высвобождают рацемизированную аминокислоту в качестве продукта реакции в результате гидролиза основания Шиффа.
Существуют также PLP-независимые рацемазы, в активном центре которых тиоловые группы двух цистеинов катализируют протонирование. В двухосновном механизме депротонированный тиолат (RS - ) первоначально принимает протон атома α-C в качестве основания. Затем за репротонирование отвечает тиоловая группа второго цистеина. Эти катализируемые ферментами процессы рацемизации производят подавляющее большинство D- аминокислот в организмах.
Пептидные антибиотики и другие пептидные препараты природного происхождения

Большое количество пептидных антибиотиков состоит из D- аминокислот. Пептидные антибиотики - это натуральные продукты , которые вырабатываются прокариотами с помощью нерибосомного пептидного синтеза . Фармакологически очень важная группа пенициллинов содержит в качестве элементарного строительного блока D - пеницилламин , не-протеиногенных альфа-аминокислоты. В полимиксине (в полимиксин В1 D фенилаланин) и актиномицин ( D валин) также состоит из D - аминокислоты. Бацитрацин, образованный бактериями вида Bacillus subtilis, состоит, среди прочего, из D- аспарагиновой кислоты, -глутаминовой кислоты, -орнитина и -фенилаланина. С помощью Streptomyces fulvissimus производства валиномицина содержит D валина и что из Bacillus circulans , образованных circulin ( D - лейцина). Также фунгиспорин ( D- фенилаланин и D- валин), грамицидин и тироцидин (оба D- фенилаланин), мальформин C ( D- лейцин и D- цистеин), микобациллин ( D- аспарагиновая кислота и D- глутаминовая кислота) являются пептидными антибиотиками с D- аминокислоты.
Иммунодепрессанта циклоспорина из организма с помощью трубчатых грибов , таких как Tolypocladium inflatum , содержит D - аланин. В изопенициллин N входит D- валин.
Циклосерин , который используется для лечения туберкулеза и имеет относительно простую химическую структуру , продуцируется такими стрептомицетами , как Streptomyces garyphalus, из D- серина,
D- аминокислоты и пептиды, содержащие D- аминокислоты

Долгое время считалось, что в природе преобладает только один энантиомер аминокислоты, а именно L- форма. До 1960-х годов D- аминокислоты считались «лабораторными артефактами» (системно-зависимые ошибки) и классифицировались как «неприродные изомеры». Термин «неприродные аминокислоты» все еще можно встретить сегодня для D- аминокислот .

Оксидазы D- аминокислот - ферменты без субстрата?
В 1933 году немецкий врач, химик и позже лауреат Нобелевской премии по физиологии и медицине Кребс обнаружили фермент D - аминокислот оксидазы и описал его в деталях через два года. Кребс утверждает, что «неприродные» D- аминокислоты в присутствии протертых свежих свиных почек или печени дезаминируются значительно быстрее, чем их «естественные» L- изомеры . Посредством целенаправленного ингибирования , например, с помощью 1-октанола , он смог деактивировать оксидазу L- аминокислот, содержащуюся в пюре, и, таким образом, добиться того, чтобы только D- аминокислоты были селективно дезаминированы. В результате рака, который используется в органах или их экстрактах, две аминокислотные оксидазы были L- и D , -аминозаврооксидазенами, каждая из которых избирательно имеет L- или D- аминокислоты в качестве субстрата . Кребс был удивлен, что существует фермент, который имеет только «неприродные вещества» в качестве субстрата. Однако он указал, что Феликс Эрлих в 1914 году, Эдмунд Оскар фон Липпман в 1884 году и Зигмунд Френкель в 1923/24 году описали случайное появление D- аминокислот в природе. D- аланин, выделенный из грибов подберезовика ( Boletus edulis ) Э. Винтерстайном и его коллегами в 1913 году , был одним из таких ранних отчетов.
D- аминокислоты в растениях
D- аминокислоты могут быть обнаружены в растениях как в свободной форме, так и в форме, связанной с пептидами. Они часто в форме N - малонили - или N - ацетил - производные , содержащиеся в растениях. Например, 40% аланина в корне подсолнечника ( Helianthus annuus ) находится в конфигурации D. D - аланин и дипептид D -Ala- D - Ala найдены в различных травах; так же и с рисом ( Oryza australiensis ). Приблизительно 10% серина в рисе присутствует в виде D- энантиомера. Он вырабатывается самим растением с помощью сериновой рацемазы. Соответствующий ген этого фермента находится в Oryza sativa ssp. Japonica cv. Nipponbare на хромосоме 4. D - аминокислоты, были найдены в более низких концентрациях , в большом количестве растений, которые используются в качестве пищи. К ним относятся, например, горох ( Pisum sativum ), чеснок, различные виды капусты и фрукты. Функция свободных и пептидных D- аминокислот в растениях до сих пор остается неясной.

Бактерии и D- аминокислоты
Перед обнаружением свободного D микробного происхождения был идентифицирован ряд соединений-аминокислот D -аминокислот . Например , бензилпенициллин , которая была сформирована в формовочных культурах и был первым пенициллином быть обнаружено с помощью Александра Флеминга в 1928 году, содержит D -penicillamine (= 3-меркапто- D - валин) в качестве основного элемента . Биохимик Эсмонд Е. Снелл заметил в 1943 годе в опытах с культурами из стрептококк фекальных и Lactobacillus Casei , что пиридоксин (витамин В 6 ) необходим для роста этих бактериальных штаммов может быть полностью заменен D -аланином в качестве питательного вещества. Он также обнаружил, что D- аланин значительно более эффективен, чем L- аланин. Когда тогда стало возможным обнаруживать большие количества D- аланина в пептидогликанах - это биополимеры, которые придают клеточной стенке бактерий их прочность - стало ясно, для чего клеткам нужна эта «неестественная» аминокислота. Включение D- аланина и особенно D- глутамата предотвращает ферментативное расщепление пептидогликанов пептидазами . Интересно, что именно эта «защитная стена», состоящая из D- аминокислот, является точкой атаки β-лактамных антибиотиков, таких как пенициллин. Эти антибиотики ингибируют фермент D-аланин транспептидазу , который можно найти только в бактериях и катализирует сшивание с пептидогликанами, особенно через D -аланин . В 1951 году Ирвин Клайд Гансалус и Уиллис А. Вуд выделили аланинрацемазу из Streptococcus faecalis , фермента, который катализирует рацемизацию природного L -аланина в изомерный D -аланин. Ген alr , кодирующий аланинрацемазу, присутствует во всех бактериях. D- аланин, образованный с помощью аланинрацемазы , необходим для синтеза пептидогликанов почти у всех бактерий. Помимо D- аланина и D- глутаминовой кислоты, некоторые штаммы энтерококков также содержат D- серин в клеточной стенке. Д -Serine образует с D -Ala- D дипептид -Ser с D -аланина на С-конце , который отвечает за устойчивость этих бактериальных штаммов к гликопептидам антибиотики , такие как ванкомицин.
D- аминокислоты в губках
Так называемые polytheonamides могут быть обнаружены в губках . Это пептидные токсины , аминокислоты которых чередуются между D и L формами . Очевидно, они синтезируются рибосомами в виде L- пептидов, а затем посттрансляционно каждая вторая аминокислота эпимеризуется. Это делается с помощью нескольких ферментов, гены которых, очевидно, происходящие от бактерий, попали в губки посредством горизонтального переноса генов .
D- аминокислоты в многоклеточных клетках
Данкварта Аккерман и М. Мор смог обнаружить D - орнитин в печени из акулы ( Acanthias обыкновенной ) в 1937 году . Оксидаза D- аминокислот, открытая Кребсом, была обнаружена у всех млекопитающих в последующие годы . Х. Блашко и Джойс Хокинс впервые обнаружили их у беспозвоночных в 1951 году . Функция этого фермента в различных организмах оставалась неясной. К концу 1960-х было высказано предположение, что этот фермент использовался в пищеварительном тракте для разрушения компонентов клеточной стенки грамположительных бактерий, содержащих большое количество D- аминокислот. Теория , что D -аминокислоты оксидаза только служит , чтобы сломать внешне подаваемые (экзогенный) D -аминых кислот существовала до начала 1990 - х.
В гемолимфе Wanzenart Oncopeltus fasciatus был Оклер, а Паттон впервые в 1950 г. в многоклеточном D обнаружил аланин. В качестве аналитического метода они использовали двухмерную бумажную хроматографию . После элюирования они опрыскивали высушенные хроматограммы оксидазой D- аминокислоты , которая дезаминировала только D- аланин до кетокарбоновой кислоты, которую можно было легко обнаружить с помощью фенилгидразина . Предполагалось, что причиной присутствия D- аланина является микробная флора, попадание в организм с пищей и спонтанная рацемизация в результате старения .
Биосинтез из D -serine была продемонстрирована в 1965 году исследовательской группой во главе с Джоном Дж Корриган в Университете Тафтса школы медицины в штате Массачусетс . В шелкопряде подается с радиоактивно меченым D - глюкозы получают как L- и D - серин. Позднее D- аминокислоты были обнаружены также у других насекомых и млекопитающих.

1962 выделили итальянскую исследовательскую группу во главе с Эрспамерами, Витторио в южноамериканской лягушке из Physalaemus fuscomaculatus в тахикининной physalaemin . Этот полипептид состоит из двенадцати аминокислот и, если смотреть с N-конца, начинается с D- пролина. В однобуквенном коде последовательность такова pEADPNKFYGLM-NH2. Это был первый природный пептид, который был обнаружен с D- аминокислотой не микробиологического происхождения. Но даже три года спустя, например, американский биохимик Альтон Мейстер в своей стандартной работе « Биохимия аминокислот » написал, что «в настоящее время нет убедительных доказательств присутствия D- аминокислот в белках растений и животных» . Поначалу открытие Эрспамера почти не было замечено. Лишь 19 лет спустя, когда та же рабочая группа выделила дерморфин у бородавчатой макролаги ( Phyllomedusa sauvagii ), которая также является родиной Южной Америки , масштабы открытия постепенно стали осознаваться. Если смотреть с N-конца, дерморфин, который состоит из семи аминокислот, имеет D- аланин в положении 2 . D конфигурация аланин имеет важное значение для фармакологической активности. Дерморфин связывается с рецептором µ 1 и намного более селективен и эффективен, чем собственные эндорфины организма ( динорфины и энкефалины ) и широко распространенный в фармакологии растительный морфин . Открытие противоречило некоторым парадигмам, так что Эрспамеру было довольно сложно найти журнал, в котором были бы опубликованы результаты его рабочей группы. Одна из этих парадигм заключается в том, что при биосинтезе белка ДНК организма кодирует только 20 канонических аминокислот , которые находятся исключительно в L- конфигурации . Нет гена, кодирующего D- аминокислоты. Это противоречие было разрешено более десяти лет спустя: стереоселективная посттрансляционная модификация, катализируемая эпимеразами , ответственна за появление D- аминокислот в эукариотических пептидах. Это означает, что после трансляции под действием особого эндогенного фермента конфигурация определенной L- аминокислоты изменяется.
D- аминокислоты у млекопитающих
Биологическая функция D- аминокислот у млекопитающих была исключена до 1992 года. В результате совершенствования аналитических методов измерения, таких как газовая и высокоэффективная жидкостная хроматография (ГХ или ВЭЖХ), с 1980-х годов стало возможным чисто отделить D- аминокислоты от их L- зеркальных изображений и обнаруживать их даже в самые маленькие количества. В 1992 году Ацушите Хашимото и его коллеги обнаружили относительно больших количеств свободного D -serine в мозге из крыс . Они обнаружили концентрацию около 0,27 мкмоль / г массы мозга. Они определили L -serine содержания , чтобы быть 0,89 мкмоль / г массы мозга, что привело к D- to - L отношение 0,23. Это уже было известно до того, что D -serine подается извне (экзогенно) является мощным селективным аллостерическая агониста на рецептор NMDA ( N - метил - D -аспартата). Источник сравнительно высоких концентраций D- серина, который впоследствии был обнаружен также в мозге других млекопитающих, включая человека, первоначально оставался неясным. Такие предположения, как целенаправленное поглощение рацемизированного L- серина из пищи и транспорт через гематоэнцефалический барьер в мозг, закончились в 1999 году открытием фермента серинрацемазы в мозге крыс Германом Волоскером и его коллегами. Серин рацемаза катализирует рацемизацию серина. Аминокислотные рацемазы ранее были известны только у бактерий и некоторых насекомых. Фермент был обнаружен в глиальных клетках со сравнительно высокими концентрациями D- серина. Обнаружив серинрацемазу, можно было показать, что этот архаичный метаболизм D- аминокислот также сохраняется у млекопитающих и, как будет показано позже, выполняет важную функцию в нейротрансмиссии . От догмы о том, что D- аминокислоты не имеют особых функций у эукариот, пришлось отказаться. Сегодня мы знаем, что D- серин играет важную роль во многих процессах центральной нервной системы , таких как процессы обучения и функции памяти , а также при психических заболеваниях , невропатиях и нейродегенеративных заболеваниях .
Физиологическое значение
Свободные D- аминокислоты

До конца 1990-х годов считалось, что D- аминокислоты не имеют физиологической функции у позвоночных. С обнаружением больших количеств D- серина и D- аспарагиновой кислоты в мозге млекопитающих началось исследование функции этих двух необычных аминокислот. Исследование физиологических эффектов D- аминокислот - сравнительно молодая дисциплина, в которой остается множество вопросов, на которые нет ответов.
D- Серин
Помимо глиальных клеток , D- серин также содержится в нервных клетках (нейронах). Она возникает из L -serine под каталитическим действием фермента серинового рацемаза ( EC 5.1.1.18)полученное из этих клеток , выраженных в. Деградациякатализируемойпомощью D- аминокислот оксидазы (EC 1.4.3.3). Концентрация D- серина в головном мозге определяется этими двумя процессами накопления и распада. D -Serine выступаеткачестве со-агониста на рецептор NMDA , чей «естественный» лиганд является аминокислота глицин. Этот рецептор имеет большое значение для ряда физиологических, но также и патологических процессов. D- серин увеличивает активность рецептора NMDA. Поэтому он также известен как « нейромодулятор ». Сверхэкспрессия D -аминокислоты оксидазы, что приводит к повышенному разрушению D -serine, следовательноуменьшает активность в отношении рецептора NMDA. Снижение активности рецептора NMDA в основном связано с шизофренией . Даже небольшое количество рецепторов NMDA антагонисты могутвызывать симптомы , такие как когнитивных и физиологических расстройствкоторые соответствуют темшизофренииу здоровых испытуемых .
В 2002 году большая международная рабочая группа обнаружила, что недавно открытый ген G72 ( ген DAOA , активатор оксидазы D-аминокислот ) тесно связан с шизофренией. Продукт гена из G72 активирует D- аминокислоты оксидазы, который уменьшает концентрацию D -serine в головном мозге. Они обнаружили лишь слабую корреляцию между активностью оксидазы D- аминокислот и возникновением шизофрении. Сочетание D- аминокислотной оксидазы и G72 активатора был, однако, сильно поддерживают друг друга ( синергический ). Авторы пришли к выводу, что в конечном итоге концентрация свободного D- серина играет важную роль при шизофрении. Другие исследования также показали генетическую связь между оксидазой D- аминокислот и шизофренией. Результаты рабочих групп, которые смогли продемонстрировать, что концентрация D- серина в сыворотке крови и в спинномозговой жидкости больных шизофренией по сравнению с группой здоровых испытуемых, значительно снизились в соответствии с этими выводами . Кроме того, повышенная экспрессия оксидазы D- аминокислот была обнаружена в мозге умерших больных шизофренией . Добавление D- серина в лечение пациентов с шизофренией показало многообещающие результаты в клинических испытаниях. Мета-анализ 18 клинических исследований было установлено уменьшение симптомов шизофрении. Однако улучшение было умеренным.
Знание о функции D- аминокислотной оксидазы и D- аминокислот оксидазы привело к разработке различных ингибиторов D- аминокислотных оксидаз, которые являются потенциальными препаратами для лечения шизофрении. В D ингибиторы оксидазы кислоты -амино все еще в очень ранней стадии разработки, так что никакого лекарственного средства с этим активным началом до сих пор не одобрен (с 2012 г.).
Избыточная концентрация этой аминокислоты в глиальных клетках и связанная с ней эксайтотоксичность исследуются как возможная причина бокового амиотрофического склероза , дегенеративного заболевания нервной системы.
D- аспарагиновая кислота
Свободная D- аспарагиновая кислота была впервые обнаружена в 1986 году рабочей группой во главе с американцем Дэвидом С. Данлопом в значительных количествах в мозге грызунов и в крови человека. Они обнаружили самые высокие концентрации D- аспартата в полушарии головного мозга новорожденных крыс - 164 нмоль / г. Это соответствует 8,4% от общего количества аспарагиновой кислоты. Это значение концентрации превышает концентрацию многих незаменимых L- аминокислот в головном мозге. Помимо головного мозга, сравнительно высокие количества D- аспартата также могут быть обнаружены в шишковидной железе , гипофизе , надпочечниках и семенниках . По аналогии с D -serine, D - аспартат образуется в организме путем ферментативного рацемизации L - аспартат, в этом случае с помощью D - аспартат рацемаза (ЕС 5.1.1.13), и деградация происходит с помощью D-аспартат - оксидазы (EC 1.4 .3.1). Концентрация D- аспартата резко снижается с возрастом организма. Высокая активность D- аспартат рацемазы обнаружена в органах, в которых также могут быть обнаружены высокие концентрации D- аспарагиновой кислоты. Активность наиболее высока в гипофизе. Дезактивация аспартатрацемазы, например, ретровирусами , которые специфически вызывают потерю функции рибонуклеиновой кислоты (РНК), комплементарной аспартатрацемазе , приводит к значительному снижению концентрации D- аспартата. В результате развитие дендритов в значительной степени нарушается, что, в свою очередь, приводит к выраженным нарушениям нейрогенеза в гиппокампе . На основании этих результатов предполагается, что D- аспартат является важным регулятором развития нейронов. Точные физиологические эффекты D- аспарагиновой кислоты все еще в значительной степени неясны. Область исследований очень новая. Например, аспартатрацемаза была клонирована у млекопитающих только в 2010 году .
Пептиды, содержащие D- аминокислоту
С возрастом организм теряет гомохиральность из-за повышенной рацемизации, особенно аспарагиновой кислоты. Окислительный стресс и УФ-излучение могут ускорить эту потерю. Рацемизация (англ. «Аспарагиновая кислота» рацемизация аспарагиновой кислоты ) происходит из-за образования промежуточного сукцинимида , для которого особенно легко требуется только низкая энергия активации . Эта неферментативная рацемизация белков in vivo представляет собой автономный процесс старения, который в первую очередь влияет на долгоживущие белки, такие как коллаген в дентине или кристаллы в хрусталике глаза. Например, 0,14% аспарагиновой кислоты в хрусталиках глаза рацемизируется каждый год жизни. У 30-летнего человека в среднем 4,2% аспарагиновой кислоты в хрусталике глазных линз рацемизировано. Однако, кроме того, рацемизация также влияет на другие функциональные белки, такие как ферменты или вещества-мессенджеры . Пептиды, содержащие D- аминокислоты, значительно более устойчивы к ферментативной деградации протеазами, чем пептиды, аминокислоты которых присутствуют только в L- конфигурации. Во многих случаях рацемизация эндогенного белка приводит к физиологическим проблемам. В белках рацемизация вызывает потерю функции и накопление белка в самых разных тканях, которые организм больше не может расщеплять. На некоторых клинических картинах наблюдается усиление рацемизации. При атеросклерозе , эмфиземе , пресбиопии , катаракте и дегенерации хряща и головного мозга рацемизация аспарагиновой кислоты рассматривается как важный патологический фактор.
В 1988 году , увеличение степени рацемизации определ ли в первый раз в бета-амилоида в сенильных бляшек из мозга умерших пациентов с болезнью Альцгеймера . В частности, можно было обнаружить D- аспартат и D- серин. Позже было установлено, что рацемизация аспарагиновой кислоты в положении 23 приводит к ускоренной агрегации пептидов, что рассматривается как важный элемент патогенеза болезни Альцгеймера. В отличие от рацемизации в положении 23, рацемизация в положении 7 приводит к снижению агрегации пептидов. Важная роль в развитии болезни Альцгеймера приписывается процессам рацемизации β-амилоида, которые предположительно вызываются старением белков и протекают аналогично процессам в дентине. Рацемизация ускоряет агрегацию пептидов и затрудняет ферментативную деградацию протеазами.
характеристики
Химические и физические свойства
В ахиральной среде аминокислоты D и L полностью идентичны по своим химическим и физическим свойствам, за исключением направления вращения поляризованного света. Существенные различия можно найти в хиральной среде. Это особенно верно в отношении биохимических процессов, которые по своей природе хиральны. Практическим примером этого является различие во вкусе энантиомеров аминокислот. Вкусовые рецепторы, связанные с G-белками, состоящие из L- аминокислот, представляют собой хиральную среду, с которой энантиомеры взаимодействуют по-разному. Вкус большинства L- аминокислот описывается как « горький », в то время как вкус D- аминокислот обычно описывается как «сладкий». Крайний пример является D - триптофан ; Самая сладкая аминокислота имеет в 37 раз сладость, чем сахароза. L- триптофан, с другой стороны, является самой горькой аминокислотой вместе с L- тирозином. Соответственно, могут быть разные взаимодействия с другими рецепторами или ферментами в биохимических процессах. Это также относится, в частности, к пептидам и белкам, содержащим одну или несколько D- аминокислот.
Включение D или эпимеризация аминокислоты L в белок вызывает, со стереохимической точки зрения, образование диастереомера, который придает всему белку совершенно новые химические и физические свойства. Биохимически это вмешательство в первичную структуру оказывает значительное влияние на вторичную , третичную и четвертичную структуру пептида, полученного из нее . Биохимический эффект сильно изменен. В двух крайних случаях он может быть либо полностью утерян ( потеря функции ), либо совершенно новым, например, результатом токсического воздействия ( усиление функции ). В пептиде, в остальном состоящем из L- аминокислот, D- аминокислоты препятствуют образованию α-спирали . Они «ломают спираль». Только белки, полностью состоящие из D- или L- аминокислот, могут - при наличии образующих спираль аминокислот, таких как валин, глутамин , изолейцин, аланин, метионин , лейцин, глутаминовая кислота или триптофан - образовывать спиральную структуру, которая является зеркальным отражением. друг друга. Это невозможно со смешанными пептидами.
токсикология
D- изомеры протеиногенных аминокислот
В исследованиях, в которых изучалось обильное пероральное потребление аминокислот, например, в форме пищевых добавок, все аминокислоты в «естественной» L- конфигурации , за исключением серина и аспарагиновой кислоты, показали более токсические эффекты, чем соответствующий D- энантиомер. D- аминокислоты являются естественным компонентом самых разных пищевых продуктов. Там они возникают в основном в результате процессов рацемизации «природных» L- аминокислот. Пища, прошедшая процесс ферментации , например молочные продукты , содержит повышенное количество D- аминокислот. Эмменталер содержит около 0,7 г / кг D- аминокислот. Даже в исходном продукте, коровьем молоке , около 1,5% всех аминокислот находятся в D- конфигурации.
По оценкам, около трети D- аминокислот, попадающих в организм с пищей, имеют микробное происхождение . Чтобы иметь возможность использовать аминокислоты, содержащиеся в пище и связанные в белках, для организма, белки должны быть разбиты на их отдельные компоненты, свободные аминокислоты, во время пищеварения. Если в белке есть D- аминокислоты, доступность белка для протеолитических ферментов может быть значительно ограничена. Ферменты пищеварительной системы человека не могут разорвать связи между D- и L- аминокислотами. Распад на отдельные аминокислоты, ди- или трипептиды, который необходим для всасывания организмом через слизистые оболочки кишечника , затрудняется. Пептидные фрагменты большего размера использовать нельзя, они выводятся с фекалиями . В этом случае биодоступность , а значит, и пищевая ценность значительно снижаются. Ди- или трипептиды, содержащие D- аминокислоты, могут, как и свободные D- аминокислоты, абсорбироваться через переносчики пептидов . Большая часть D- аминокислот поглощается в этом образом выводится снова через почки. В зависимости от пищевых продуктов и соответствующей D- аминокислоты, некоторые из D- аминокислот превращаются в L- аминокислоты путем трансаминирования и, таким образом, становятся доступными для биосинтеза белка .
Включение «неестественных» D- аминокислот в клеточную стенку бактерий делает их устойчивыми к протеазам. Эта стабильность протеаз также имеет большое значение для человека, ведь в кишечнике взрослого человека содержится несколько сотен граммов кишечных бактерий , которые вместе с большим количеством протеаз необходимы для пищеварения.
Большинство D- аминокислот в пище создается во время приготовления. Высокие температуры и сильнокислые или щелочные условия приводят к (частичной) рацемизации. Например, около 14% аспарагиновой кислоты в картофельных чипсах находится в D- форме. В отбеливателях для кофе он составляет 17%, а в полосках бекона - 13%. Свободные L- аминокислоты рацемизируются примерно в десять раз медленнее, чем связанные с белками. Степень рацемизации также сильно зависит от самой аминокислоты. Серин особенно легко рацемизируется из-за гидроксильной группы . Жесткие условия, необходимые для производства желатина - кислотное или основное переваривание при повышенных температурах - приводят к сильной рацемизации, особенно аспарагиновой кислоты, в коллагене желатина. Доля D- аспартата в общем аспартате может быть немного выше 30% в случае коммерчески доступного желатина.

D- аминокислоты не включаются в белки, пептиды или другие (макро) молекулы метаболизма, когда они абсорбируются организмом млекопитающих. Скопления в тканях организма в неизмененном виде не наблюдается. С пищей или инфузией зарегистрированные D- аминокислоты частично выводятся с мочой и частично через фермент D- аминозаурооксидазу, присутствующий в печени и почках, путем дезаминирования «нормальных» продуктов метаболизма, кетокарбоновых кислот , окисляются . Что касается токсичности введенных D- аминокислот, существует, более или менее непроизвольно, многолетний опыт, который позволяет предположить, что D- аминокислоты не вредны для здоровья. В основе этого утверждения лежит хорошая переносимость парентерального питания («искусственного питания»), которое на протяжении многих лет состояло из рацематов аминокислот в высоких дозах. Эти инфузионные растворы были приготовлены из белков путем кислотного гидролиза, который неизбежно приводит к рацемизации. Рацемический метионин ( DL- метионин) является компонентом многих кормов в животноводстве . На дойных коровах было показано, что более 75% D- метионина превращается в L- метионин и, таким образом, становится биодоступным.
Независимо от этих эмпирических значений, результаты теста можно увидеть на модели крысы на животных. Высокие дозы (в диапазоне 0,8 г / кг массы тела) D- серина приводят к острому некрозу канальцев у этих модельных организмов , который является обратимым после прекращения введения D- серина. Функция почек полностью восстанавливается примерно через шесть дней. Патологические изменения во многом аналогичны изменениям почек, вызванным лизиноаланином . Почему D- серин токсичен для почек в таких высоких концентрациях, до сих пор точно не выяснено. D -serine может снизить концентрацию почечной глутатиона , который , как предполагается , чтобы защитить клетки проксимальных канальцев от вредного воздействия активных форм кислорода (ROS). Ферментативное разрушение D -serine от D -аминокислоты оксидазы производит перекись водорода в качестве побочного продукта , который значительно уменьшает на внутриклеточный запас глутатиона.
В декабре 1989 года сообщение трех врачей из Вены, опубликованное в престижном журнале The Lancet , произвело фурор . Они обнаружили большое количество D - пролина в молоке , что они нагреты до в микроволновой печи , который , по- видимому , произведенные рацемизации L - пролина . Кроме того, они приписали D- пролину нейротоксические , нефро- и гепатотоксические свойства. Публикация была письмом в редакцию, а не рецензируемой публикацией или даже контролируемым исследованием. Авторы также не назвали условия испытаний, при которых была достигнута такая степень рацемизации. Независимо от этого, отчет был опубликован в ежедневной и еженедельной прессе с драматическими формулировками и предупреждениями против использования микроволновых устройств. В августе 1990 года Федеральное управление здравоохранения разъяснило факты, которые, однако, не имели никакого общественного воздействия. Другие ученые указали, что D- пролин - это нормальный компонент повседневной пищи, который быстро расщепляется и выводится из организма после приема внутрь. Тем не менее, в августе 1991 года, например, появился журнал с заголовком «Микроволны отравляют нервы, печень и почки» . Подобные утверждения можно найти и сегодня на соответствующих сайтах.
Попытки других рабочих групп воспроизвести результаты венских врачей поначалу провалились. Даже после кипячения молока на плите в течение 30 минут невозможно было измерить увеличение D- пролина. Условия испытаний были опубликованы два года спустя. Авторы Lancet-Letter нагревали молоко в закрытом сосуде под давлением в течение 10 минут до 174–176 ° C - температурного диапазона, который не может быть достигнут в обычных домашних сосудах для нагрева молока. В своем заявлении о нейротоксичности D- пролина авторы Lancet Letter сослались на эксперименты 1978 года, в которых цыплятам вводили это вещество внутрижелудочково , то есть непосредственно в желудочек мозга . Последующие исследования токсичности D- пролина у крыс показали, что это соединение безвредно даже в высоких концентрациях.
Реальная опасность при нагревании молока с помощью микроволновой печи - особенно для маленьких детей - заключается в неравномерном нагревании содержимого бутылки, что часто приводит к клинически значимым ожогам.
D- изомеры непротеиногенных аминокислот
Невозможно сделать каких-либо общих заявлений о токсичности D- изомеров непротеиногенных аминокислот. Он очень индивидуален от аминокислоты к аминокислоте. Интересно, что некоторые соединения, содержащие D- аминокислоты, значительно менее токсичны, чем их L- изомеры. Примеры - циклосерин и пеницилламин . Например, значение LD 50 для перорального введения рацемата D- и L- пеницилламина в модельном организме крысы составляет 365 мг / кг. Однако для чистого D- пеницилламина нет никаких признаков токсичности даже при дозе 1200 мг / кг.
D пептиды
Общие утверждения о токсикологических свойствах D- пептидов невозможны. Чувствительность к протеазам значительно ниже, а иммуногенный потенциал значительно ниже, чем у соответствующих L- пептидов.
анализ
Классические процедуры
Поляриметр может быть использован для определения оптического угла поворота раствора аминокислоты, из которых содержание D и L может быть вычислены энантиомеры. Однако для этого необходимы стандартные условия (прежде всего концентрация, температура и растворитель). Кроме того, этот метод подходит только для отдельных аминокислот, а не для смесей различных аминокислот. В 1960-1980-х годах ионообменная хроматография также использовалась для разделения дериватизированных аминокислот. Анализируемые аминокислоты были преобразованы в диастереомерные дипептиды с L- аминокислотами перед разделением . Ферментативные методы, основанные на реакции со специфическими ферментами, такими как оксидаза L- и D- аминокислот, относятся к классическим методам определения энантиомеров аминокислот. Капиллярный электрофорез , помимо прочего, также подходит в качестве нехроматографического метода анализа D- аминокислот.
Хроматографический процесс
Количественный анализ даже сложных смесей аминокислот можно проводить с помощью хроматографических методов . Сначала отдельные компоненты смеси разделяются на неподвижной фазе, а затем измеряются детектором. УФ- или масс-спектрометры в основном используются в качестве детекторов , а детекторы пламенно-ионизации также используются в газовой хроматографии . Для разделения исходной смеси на стационарной фазе используются две разные стратегии. В простейшем случае два энантиомера разделены на хиральной неподвижной фазе, с которой два изомера взаимодействуют в разной степени и, таким образом, элюируются с разной скоростью . Разделение возможно только на ахиральной неподвижной фазе, если энантиомеры превращаются в диастереомеры. Газовая хроматография (ГХ) и высокоэффективная жидкостная хроматография (ВЭЖХ) зарекомендовали себя как аналитические методы. Чистоты энантиомера из D- аминокислот также могут быть проанализированы с помощью тонкослойной хроматографии .
Только разработка специальных хроматографических методов позволила обнаруживать и количественно определять D- аминокислоты в органах высших организмов.
Газовая хроматография
Аминокислоты невозможно испарить без разложения. Для разделения и анализа в газовой хроматографии их необходимо преобразовать в соединения, которые можно испарить без разложения. Для этого аминокислоты обычно подвергаются двухстадийному процессу дериватизации . Например, карбоксильная группа может быть этерифицирована этанолом на первой стадии, а затем, на второй стадии, аминогруппа может быть преобразована трифторуксусным ангидридом с образованием трифторацетильного производного (TFA). N -TFA / O - этил производное аминокислоты , образованной в процессе можно испарить без разложения в газовом хроматографе и разделяли на хиральной стационарной фазы. Дериватизация с помощью хиральных реагентов таит в себе повышенный риск рацемизации и то, что партнеры реакции имеют разную кинетику реакции. Оба могут исказить результат измерения.
Высокоэффективная жидкостная хроматография
В ВЭЖХ, по сравнению с газовой хроматографией, преобладала дериватизация с хиральными реагентами и использование нехиральных неподвижных фаз, например RP-18 . Например, L - N- ацетилцистеин используется вместе с фтальдиальдегидом для дериватизации . Полученная пара диастереомеров (D - L и L - L) имеет разные химические и физические свойства, что означает, что затем ее можно разделить на обычной колонке и затем обнаружить.
синтез
Большинство протеиногенных L- аминокислот производятся ферментацией . Этот микробиологический процесс не подходит для D- аминокислот. Для удовлетворения растущего спроса на D- аминокислоты были разработаны различные производственные процессы.
Классический химический синтез, такой как синтез Штрекера , всегда дает рацематы аминокислот. Отдельные аминокислоты могут быть либо отделенны от этих смесей в трудоемком способе ( рацемат ) или L - Аминых кислоты превращают ферментативно с помощью L - аминокислоты дезаминаз во кетокарбоновую кислоту, которая может быть отделена от сравнительно легко.
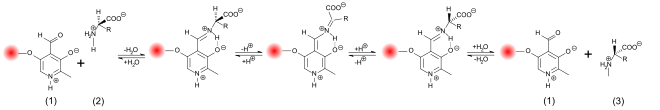
Синтез D- аминокислот через замещенные гидантоины более элегантен . Гидантоины могут быть получены в промышленных масштабах с использованием реакции Бюхерера-Бергса (также называемой синтезом гидантоина Бюхерера-Бергса ) из альдегидов, цианида калия и карбоната аммония . Образующаяся аминокислота определяется выбором используемого альдегида. Полученный таким образом гидантоин может быть далее преобразован в D- аминокислоту в так называемом гидантоиназном процессе . Этот мультиферментный процесс был разработан Degussa (теперь Evonik Degussa ) и состоит из трех этапов реакции. Во- первых, рацемическое производное гидантоина находится под каталитическим воздействием D - hydantoinase к N карбамоил- D гидролизуют аминокислоту. Во второй стадии N -carbamoyl- D- аминокислота далее гидролизуют до энантиомерно чистой аминокислоты с помощью D- carbamoylase . На третьей стадии непрореагировавший энантиомер производного гидантоина химически или ферментативно рацемизируется. Химическая рацемизация происходит при значениях pH> 8 и может быть значительно ускорена добавлением рацемазы. По сравнению с другими процессами гидантоиназный процесс производит энантиомерно чистые аминокислоты, начиная с рацемата, с теоретическим выходом до 100%.
использовать
Мировой спрос на D- аминокислоты непрерывно рос за последние несколько лет. На 2017 год прогнозируется объем рынка около 3,7 миллиарда долларов США.
D- аминокислоты являются важными строительными блоками, например, в подсластителях , инсектицидах , косметике и, прежде всего, в большом количестве пептидных препаратов, которые являются основным двигателем роста для развития рынка.
Ежегодно для синтеза пенициллинов ( например, амоксициллина ) и цефалоспоринов ( например, цефаклора ) требуется несколько тысяч тонн D- 4-гидроксифенилглицина и D- фенилглицина .
D- аминокислоты не только повышают устойчивость клеточных стенок бактерий к протеолитической деградации, но и целенаправленное включение в лекарственные препараты также увеличивает их стабильность, особенно при пероральном приеме . Изменение расположения функциональных групп ( конформации ) также предлагает дополнительную степень свободы в дизайне молекулярной структуры в молекулярной структуре, что может привести к улучшенным свойствам активного ингредиента. Ингибитор гонадорелина цетрореликс , аналог GnRH, используемый в репродуктивной медицине , состоит, например, из десяти аминокислот, пять из которых находятся в D- конфигурации. Цетрореликс полностью синтезирован из отдельных аминокислот. Другие ГнРГи аналоги , такие как лейпрорелин , бусерелин , Degarelix , гистрелин , нафарелин или абареликс также содержат по меньшей мере один D - аминокислоту.
Для лечения эректильной дисфункции используется тадалафил , более известный под торговой маркой Cialis , в синтезе D сконструированного триптофана. Противодиабетический натеглинид , из группы глиниды , изготовлен из D- фенилаланина и циса - 4-изопропил-циклогексан-карбоновая кислота. Фенилаланин используется как антидепрессант с 1970-х годов . Недорогой рацемат используется как лекарство. Значительная часть антидепрессивного и обезболивающего эффекта происходит за счет D- фенилаланина, который, по сравнению с L- фенилаланином, не метаболизируется в повышающий настроение L- тирозин, L- ДОФА или норэпинефрин , но в первую очередь ингибирует фермент энкефалиназу . Блокируя энкефалиназу, уровень энкефалинов в крови повышается, что вызывает болеутоляющий эффект, который также можно наблюдать . В дальнейшем в ходе процесса D- фенилаланин в основном метаболизируется до фенилэтиламина .
Инсектицид флувалинат из группы пиретроидов , одобренный, среди прочего, для борьбы с клещом варроа , производится из D- валина.
D- аланин является компонентом подсластителя алитама .
дальнейшее чтение
- Рюичи Конно, Ханс Брюкнер, Антимо Д'Аниелло, Джордж Фишер, Норико Фуджи, Хироши Хомма: D-аминокислоты: новый рубеж в исследованиях аминокислот и белков - практические методы и протоколы. Nova Science Publishers, 2007, ISBN 1-60021-075-9 , 629 стр.
- Лоредано Поллегиони, Стефано Серви (ред.): Неестественные аминокислоты. Humana Press, 2011, ISBN 1-61779-330-2 , 409 стр.
- Дьюла Пали, Лучано Калиоти, Клаудиа Зукки (ред.): Достижения в области биохиральности. Elsevier, 1999, ISBN 0-08-043404-5 ( ограниченный предварительный просмотр в Поиске книг Google).
веб ссылки
- D- и L-формы аминокислот
- Ханка Симманк: Функциональная и структурная характеристика бактериальных пептидных синтетаз. Департамент биологии, химии и фармации, Свободный университет Берлина, май 2002 г.
Индивидуальные доказательства
- ↑ a b Ганс-Дитер Белиц , Вернер Грош , Петер Шиберле : Учебник пищевой химии. 5-е издание, Springer Verlag, 2001. ISBN 3-540-41096-1 ( ограниченный предварительный просмотр в поиске книг Google).
- ↑ a b c d Уве Мейерхенрих : Аминокислоты и асимметрия жизни: в процессе формирования. Springer, 2008, ISBN 3-540-76885-8 , стр. 53–54 ( ограниченный предварительный просмотр в поиске книг Google).
- ↑ В.С. Ламзин, З. Даутер, К.С. Уилсон: Как природа взаимодействует со стереоизомерами. В: Современное мнение в структурной биологии. Том 5, номер 6, декабрь 1995 г., стр. 830-836, PMID 8749373 . (Рассмотрение).
- ↑ С.А. Фукс, Р. Бергер и др.: D-аминокислоты в центральной нервной системе при здоровье и болезнях. В кн . : Молекулярная генетика и метаболизм. Том 85, номер 3, июль 2005 г., стр. 168-180, DOI: 10.1016 / j.ymgme.2005.03.003 . PMID 15979028 . (Рассмотрение).
- ↑ Джойс Г.Ф., Виссер Г.М. и др.: Хиральный отбор в поли (С) -направленном синтезе олиго (G). В кн . : Природа. Volume 310, Number 5978, 1984 Aug 16-22, pp. 602-604, PMID 6462250 .
- ↑ В. В. Аветисов, В. И. Гольданский: Гомохиральность и стереоспецифическая активность: эволюционные аспекты. В: Биосистемы. Том 25, номер 3, 1991 г., стр. 141-149, PMID 1912384 .
- ↑ Н. Фуджи, Т. Сайто: Гомохиральность и жизнь. В: Химическая запись. Том 4, номер 5, 2004 г., стр. 267-278, DOI : 10.1002 / tcr.20020 . PMID 15543607 . (Рассмотрение).
- ^ WA Bonner: Экспериментальные доказательства бета-распада как источника хиральности с помощью энантиомерного анализа. В кн . : Истоки жизни. Том 14, номера 1-4, 1984, стр. 383-390, PMID 11536584 . (Рассмотрение).
- ^ WA Bonner: нарушение четности и эволюция биомолекулярной гомохиральности. В: Хиральность. Том 12, № 3, март 2000 г., стр 114-126,. DOI : 10.1002 / (SICI) 1520-636X (2000) 12: 3 <114 :: АИД-CHIR3> 3.0.CO; 2-N . PMID 10689289 . (Рассмотрение).
- ↑ JR Cronin, S. Pizzarello: Энантиомерные избытки метеоритных аминокислот. В кн . : Наука. Том 275, номер 5302, февраль 1997 г., стр. 951-955, PMID 9020072 .
- ↑ С. Пиццарелло, М. Золенский, К. А. Тюрк: Нерацемический изовалин в метеорите Мерчисон: хиральное распределение и минеральная ассоциация. В: Geochimica et Cosmochimica Acta. Том 67, Номер 8, 2003 г., стр. 1589-1595. DOI: 10.1016 / S0016-7037 (02) 01283-8 .
- ↑ П. Шмитт-Копплин , З. Габелика и др.: Высокое молекулярное разнообразие внеземного органического вещества в метеорите Мерчисон выявлено через 40 лет после его падения. В: PNAS. Том 107, номер 7, февраль 2010 г., стр. 2763-2768, DOI : 10.1073 / pnas.0912157107 . PMID 20160129 . PMC 2840304 (полный текст).
- ↑ Д.П. Главин, Ю.П. Дворкин: Обогащение аминокислоты L-изовалин путем водного изменения на материнских телах метеоритов CI и CM. В: PNAS. Том 106, номер 14, апрель 2009 г., стр. 5487-5492, DOI : 10.1073 / pnas.0811618106 . PMID 19289826 . PMC 2667035 (полный текст).
- ↑ PW Lucas, JH Hough et al.: УФ круговая поляризация в областях звездообразования: происхождение гомохиральности? В кн . : Истоки жизни и эволюция биосферы. Volume 35, Number 1, February 2005, pp. 29-60, PMID 15889649 .
- ↑ a b T. Carell : ( Страница больше не доступна , поиск в веб-архивах: Lecture Stereochemistry. ) Глава 9: Рацемизации LMU, Мюнхен, стр. 150.
- ↑ Элизабет Р. Несвальд: Термодинамика как поле культурной битвы: к истории увлечения энтропией, 1850-1915 гг. Ромбах, 2003, ISBN 3-7930-9448-0 , стр. 335.
- ↑ AS Kekulé: Ой, как хорошо, что никто не знает ... В: Tagesspiegel. 12 января 2011 г.
- ↑ Т. Огино, Х. Огино: Применение в судебной стоматологии рацемизации аспарагиновой кислоты в непрорезавшихся и дополнительных зубах. В кн . : Журнал стоматологических исследований. Том 67, номер 10, октябрь 1988 г., стр. 1319-1322, PMID 3170888 .
- ↑ Т. Огино, Х. Огино, Б. Надь: Применение рацемизации аспарагиновой кислоты в судебной стоматологии: посмертное определение возраста на момент смерти. В кн . : Международная криминалистика. Том 29, номера 3-4, 1985 г., стр. 259-267, PMID 4076954 .
- ^ С. Отани, Т. Ямамото: Стратегия оценки хронологического возраста с использованием метода рацемизации аспарагиновой кислоты с особым упором на коэффициент корреляции между отношениями D / L и возрастом. В кн . : Журнал судебной медицины. Volume 50, Number 5, 2005, pp. 1020-1027, PMID 16225206 . (Рассмотрение).
- ↑ JL Bada, B. Herrmann и др.: Рацемизация аминокислот в кости и кипение германского императора Лотара I. В: Прикладная геохимия. Том 4, номер 3, 1989 г., стр. 325-327, DOI: 10.1016 / 0883-2927 (89) 90036-X .
- ↑ а б Крис Макманус: Правая рука, левая рука - Истоки асимметрии в мозге, телах, атомах и культурах. Издательство Гарвардского университета, 2004 г., ISBN 0-674-01613-0 , стр. 130 ( ограниченный предварительный просмотр в поиске книг Google).
- ↑ PM Masters, M. Friedman: Рацемизация аминокислот в пищевых белках, обработанных щелочью. В кн . : Журнал сельскохозяйственной и пищевой химии. Том 27, номер 3, май-июнь 1979 г., стр. 507-511, PMID 447924 .
- ↑ JL Bada: Кинетика рацемизации аминокислот в зависимости от pH. В: Журнал Американского химического общества. Том 94, номер 4, февраль 1972 г., стр. 1371-1373, PMID 5060280 .
- ↑ Х. Франк, В. Войводе и др.: Определение скорости кислотно-катализируемой рацемизации белковых аминокислот. В: Liebigs Ann Chem. № 3, 1981, стр. 354-365. DOI: 10.1002 / jlac.198119810303 .
- ↑ Т. Гейгер, С. Кларк: Деамидирование, изомеризация и рацемизация по аспарагиниловым и аспартильным остаткам в пептидах. Связанные с сукцинимидом реакции, способствующие расщеплению белка. В кн . : Журнал биологической химии. Volume 262, Number 2, January 1987, pp. 785-794, PMID 3805008 .
- ↑ a b c d e f g Торстен Эрбе: Количественное определение изомеров аминокислот в пище с использованием хиральной газовой хроматографии-масс-спектрометрии с учетом актуальности и механизмов образования D-аминокислот. Диссертация, Университет Юстуса Либиха, Гиссен, 1999.
- ↑ А. Паке, М. Чинг-Юнг: Оценка рацемизации пищевых белков, обработанных щелочью, с использованием высокоэффективной жидкостной хроматографии. В: Исследования питания. Volume 9, Number 9, 1989, pp. 1053-1065. DOI: 10.1016 / S0271-5317 (89) 80066-1 .
- ↑ а б в М. Фридман: Химия, питание и микробиология D-аминокислот. В кн . : Журнал сельскохозяйственной и пищевой химии. Том 47, номер 9, сентябрь 1999 г., стр. 3457-3479, PMID 10552672 . (Рассмотрение).
- ^ JP Ричард, Т.Л. Эмиес: Перенос протона на углерод. В кн . : Современные взгляды на химическую биологию. Том 5, номер 6, декабрь 2001 г., стр. 626-633, PMID 11738171 . (Рассмотрение).
- ↑ JP Ричард, Т.Л. Эмис: О важности цвиттерионности: ферментативный катализ декарбоксилирования и депротонирования катионного углерода. В кн . : Биоорганическая химия. Том 32, номер 5, октябрь 2004 г., стр. 354-366, DOI: 10.1016 / j.bioorg.2004.05.002 . PMID 15381401 . (Рассмотрение).
- ↑ a b c d Daniel Björn Stein: Субстратная специфичность и функциональность доменов эпимеризации в синтезе нерибосомных пептидов. Диссертация, Филиппский университет в Марбурге, 2006 г., стр.29.
- ↑ С. Главас, М. Е. Таннер: Остатки активного сайта глутамат рацемазы. В кн . : Биохимия. Том 40, номер 21, май 2001 г., стр. 6199-6204, PMID 11371180 .
- ↑ LM Fisher, JG Belasco et al.: Энергетика пролинрацемазы: факторы фракционирования переходного состояния для двух протонов, участвующих в каталитических стадиях. В кн . : Биохимия. Том 25, номер 9, май 1986 г., стр. 2543-2551, PMID 3521738 .
- ↑ Джеффри Зубай: Истоки жизни: на Земле и в космосе. Academic Press, 2000, ISBN 0-12-781910-X , стр. 296 ( ограниченный предварительный просмотр в поиске книг Google).
- ↑ а б в Дж. Дж. Корриган: D-аминокислоты у животных. В кн . : Наука. Volume 164, Number 3876, April 1969, pp. 142-149, PMID 5774186 .
- ↑ Э. Абдерхальден : Fermentforschung. Том 16-17, С. Хирцель, 1942, с. 301.
- ↑ Рак HA: Исследования метаболизма аминокислот в организме животных. В кн .: Журнал Хоппе-Зейлера по физиологической химии. Том 217, 1933, с. 191.
- ↑ а б Х. А. Кребс: Метаболизм аминокислот: дезаминирование аминокислот. В кн . : Биохимический журнал. Том 29, номер 7, июль 1935 г., стр. 1620-1644, PMID 16745832 . PMC 1266672 (полный текст).
- ↑ а б Х. Блашко, Дж. Хокинс: Оксидаза D-аминокислот в печени моллюсков. В кн . : Биохимический журнал. Том 52, номер 2, октябрь 1952 г., стр. 306-310, PMID 13018226 . PMC 1197987 (полный текст).
- ↑ Ф. Эрлих : Об асимметричном и симметричном действии дрожжей на рацемические соединения встречающихся в природе аминокислот. В: Biochem Z.63 , 1914, стр. 379-401.
- ↑ Е.О. фон Липпманн : О наличии лейцина и тирозина в свекольной патоке. В: Ber Dtsch Chem Ges. Volume 17, 1994, pp. 2835-2840. DOI: 10.1002 / cber.188401702243 .
- ^ С. Френкель, Х. Галлия, А. Либстер, С. Розен: О продуктах длительного триптического переваривания казеина. В: Biochem Z. Volume 145, 1924, pp. 225-241.
- ↑ Э. Винтерштейн, К. Рейтер и Р. Королев: О химическом составе некоторых грибов и о продуктах, которые образуются при автолизе. В: Landw Versuchsstat. LXXIX - LXX, 1913, стр. 541-562.
- ↑ Дж. Х. Биркиншоу, Х. Рейстрик, Дж. Смит: Исследования по биохимии микроорганизмов: фумарил-dl-аланин (фумаромоно-dl-аланид), продукт метаболизма Penicillium resticulosum sp. Nov. В кн . : Биохимический журнал. Том 36, номера 10-12, декабрь 1942 г., стр. 829-835, PMID 16747516 . PMC 1266878 (полный текст).
- ↑ Т. Робинсон: D-аминокислоты в высших растениях. В кн . : Науки о жизни. Том 19, номер 8, октябрь 1976 г., стр. 1097-1102, PMID 792607 . (Рассмотрение).
- ↑ JL Frahn, RJ Illman: Встречаемость D-аланина и D-аланил-D-аланина в Phalaris tuberosa. В: Phytochem Volume 14, 1975, pp. 1464-1465. DOI: 10.1016 / S0031-9422 (00) 98674-6 .
- ↑ Y. Gogami, K. Ito et al.: Встречаемость D-серина в рисе и характеристика сериновой рацемазы риса. В кн . : Фитохимия. Том 70, номер 3, февраль 2009 г., стр. 380-387, DOI : 10.1016 / j.phytochem.2009.01.003 . PMID 19249065 .
- ↑ Т. Огава, М. Фукуда, К. Сасаока: Встречаемость N-малонил-D-аланина в проростках гороха. В: Biochimica et Biophysica Acta . Том 297, номер 1, январь 1973 г., стр. 60-69, PMID 4144329 .
- ↑ Х. Брюкнер, С. Хаасманн, А. Фридрих: Количественное определение D-аминокислот в моче человека с использованием ГХ-МС и ВЭЖХ. В: Аминокислоты. Том 6, 1994, стр. 205-211. DOI: 10.1007 / BF00805848 .
- ↑ EE Snell, BM Guirard: Некоторые взаимосвязи пиридоксина, аланина и глицина в их влиянии на определенные молочнокислые бактерии. В: PNAS. Том 29, номер 2, 1943 г., стр. 66-73, PMID 16588604 . PMC 1078561 (полный текст).
- ↑ J. Olivard, EE Snell: Рост и ферментативная активность аналогов витамина B6. I. Синтез D-аланина. В кн . : Журнал биологической химии. Volume 213, Number 1, March 1955, pp. 203-214, PMID 14353919 . PMC 1078561 (полный текст).
- ↑ EE Snell: Группа витаминов B6: VII. Замена витамина B6 для некоторых микроорганизмов на d (-) - аланин и неустановленный фактор казеина. В: J Biol Chem. Volume 158, 1945, pp. 497-503.
- ↑ Альберт Госсауэр: Структура и реакционная способность биомолекул. John Wiley & Sons, 2003, ISBN 3-906390-29-2 , стр. 347 ( ограниченный предварительный просмотр в поиске книг Google).
- ^ WA Wood, IC Gunsalus: образование D-аланина; рацемаза Streptococcus faecalis. В кн . : Журнал биологической химии. Volume 190, Number 1, May 1951, pp. 403-416, PMID 14841188 .
- ^ Дж. Джу, Х. Мисоно, К. Онниши: Направленная эволюция бактериальных аланинрацемаз с более высоким уровнем экспрессии. В кн . : Журнал бионауки и биоинженерии. Том 100, номер 3, сентябрь 2005 г., стр. 246-254, DOI: 10.1263 / jbb.100.246 . PMID 16243272 .
- ↑ RJ Thompson, HG Bouwer et al.: Патогенность и иммуногенность штамма Listeria monocytogenes, которому для роста необходим D-аланин. В кн . : Инфекция и иммунитет. Volume 66, Number 8, August 1998, pp. 3552-3561, PMID 9673233 . PMC 108386 (полный текст).
- ↑ Д. Биллот-Кляйн, Л. Гутманн и др.: Модификация предшественников пептидогликана является общей чертой низкоустойчивого к ванкомицину Enterococcus D366 типа VANB и естественно устойчивых к гликопептидам видов Lactobacillus casei, Pediococcus pentosaceus, Leuconostoc mesenteroides и Enterococcus gallinarum. В кн . : Бактериологический журнал. Volume 176, Number 8, April 1994, pp. 2398-2405, PMID 8157610 . PMC 205365 (полный текст).
- ↑ PE Reynolds, HA Snaith et al.: Анализ предшественников пептидогликана в устойчивом к ванкомицину Enterococcus gallinarum BM4174. В кн . : Биохимический журнал. Том 301, июль 1994 г., стр. 5-8, PMID 8037690 . PMC 1137133 (полный текст).
- ↑ CA Arias, M. Martín-Martinez et al.: Характеристика и моделирование VanT: новой мембраносвязанной сериновой рацемазы из устойчивого к ванкомицину Enterococcus gallinarum BM4174. В кн . : Молекулярная микробиология. Volume 31, Number 6, March 1999, pp. 1653-1664, PMID 10209740 .
- ↑ а б Норма Кристин Стэблер: Исследования образования D-аминокислот с помощью Corynebacterium glutamicum. Диссертация, Университет Генриха Гейне, Дюссельдорф, 2010 г., стр.7.
- ↑ MF Freeman, C. Gurgui et al.: Metagenome Mining показывает, что политеонамиды являются посттрансляционно модифицированными рибосомными пептидами. В кн . : Наука. [электронная публикация перед печатью] сентябрь 2012 г., DOI: 10.1126 / science.1226121 . PMID 22983711 .
- ↑ Т. Хамада, С. Мацунага и др.: Структура раствора политеонамида B, высокоцитотоксичного нерибосомного полипептида морской губки. В: Журнал Американского химического общества. Том 132, номер 37, сентябрь 2010 г., стр. 12941-12945, DOI : 10.1021 / ja104616z . PMID 20795624 .
- ↑ Д. Акерманн , М. Мор: Об азотистых компонентах печени акулы (Acanthias vulgaris). В: Z Biol. Volume 98, number 37, 1937, p. 26.
- ^ LR Lyle, JW Jutila: индукция оксидазы D-аминокислот в почках мышей без микробов. В кн . : Бактериологический журнал. Том 96, номер 3, сентябрь 1968 г., стр. 606-608, PMID 4389707 . PMC 252348 (полный текст).
- ↑ JL Auclair, RL Patton: О появлении D-аланина в гемолимфе молочая Oncopeltus fasciatus. В: Revue canadienne de biologie. Том 9, номер 1, апрель 1950 г., стр. 3-8, PMID 15417891 .
- ↑ a b Джанлука Молла, Лучано Пьюбелли и др.: Ферментативное определение D-аминокислот. В: Лоредано Поллегиони, Стефано Серви (ред.): Неестественные аминокислоты. Том 794, 2012, ISBN 978-1-61779-330-1 , стр. 273-289. DOI : 10.1007 / 978-1-61779-331-8_18 .
- ↑ NG Srinivasan, JJ Corrigan, A. Meister: Биосинтез D-серина у тутового шелкопряда Bombyx mori. (PDF; 665 kB) В: Журнал биологической химии. Том 240, февраль 1965 г., стр. 796-800, PMID 14275137 .
- ↑ JJ Corrigan, NG Srinivasan: Встречаемость определенных D-аминокислот у насекомых. В кн . : Биохимия. Том 5, номер 4, апрель 1966 г., стр. 1185-1190, PMID 5958195 .
- ↑ Y. Nagata, K. Yamamoto et al.: Наличие свободного D-аланина, D-пролина и D-серина у мышей. В: Biochimica et Biophysica Acta . Volume 1115, Number 3, January 1992, pp. 208-211, PMID 1346751 .
- ↑ П. Мельчиорри , Л. Негри: Семейство пептидов дерморфина. В кн . : Общая фармакология. Volume 27, Number 7, October 1996, pp. 1099-1107, PMID 8981054 . (Рассмотрение).
- ↑ A. Anastasi, V. Erspamer, JM Cei: Выделение и аминокислотная последовательность физалаемина, основного активного полипептида кожи Physalaemus fuscumaculatus. В кн . : Архивы биохимии и биофизики. Том 108, ноябрь 1964 г., стр. 341-348, PMID 14240587 .
- ↑ Ребекка Джо Джекуэй: Биологически активные пептиды австралийских амфибий. Докторская диссертация, Университет Аделаиды, 2008 г., стр. 165.
- ↑ буквально: В настоящее время нет убедительных доказательств присутствия D-аминокислот в белках растений и животных. Альтон Мейстер: Биохимия аминокислот Academic Press, 1965.
- ↑ М. Броккардо, В. Эрспамер и др.: Фармакологические данные о дерморфинах, новом классе сильнодействующих опиоидных пептидов из кожи амфибий. В: Британский журнал фармакологии. Выпуск 73, номер 3, июль 1981 г., стр. 625-631, PMID 7195758 . PMC 2071698 (полный текст).
- ^ В. Эрспамер, П. Мельчиорри и др.: Дельторфины: семейство природных пептидов с высоким сродством и селективностью в отношении сайтов связывания дельта-опиоидов. В: PNAS. Том 86, номер 13, июль 1989 г., стр. 5188-5192, PMID 2544892 . PMC 297583 (полный текст).
- ↑ М. Амиче, А. Дельфур, П. Николас: Опиодные пептиды из кожи лягушки. В: Пьер Жоллес (ред.): D-аминокислоты в последовательностях секретируемых пептидов многоклеточных организмов. Springer, 1998, ISBN 3-7643-5814-9 , стр. 57-72 ( ограниченный предварительный просмотр в поиске книг Google).
- ↑ LH Lazarus, M. Attila: Жаба, уродливая и ядовитая, носит драгоценный камень в коже. В кн . : Успехи нейробиологии. Том 41, номер 4, октябрь 1993 г., стр. 473-507, PMID 8210414 . (Рассмотрение).
- ^ G. Kreil: Пептиды лягушек и моллюсков, содержащие D-аминокислоту. В кн . : Журнал биологической химии. Volume 269, Number 15, April 1994, pp. 10967-10970, PMID 8157620 . (Рассмотрение).
- ↑ SD Heck, WS Faraci et al.: Посттрансляционная эпимеризация аминокислот: катализируемая ферментами изомеризация аминокислотных остатков в пептидных цепях. В: PNAS. Volume 93, Number 9, April 1996, pp. 4036-4039, PMID 8633012 . PMC 39482 (полный текст).
- ↑ Р. Лиардон, Р. Йост: рацемизация свободных и связанных с белками аминокислот в сильной минеральной кислоте. В: Международный журнал исследований пептидов и белков. Том 18, номер 5, ноябрь 1981 г., стр. 500-505, PMID 7341532 .
- ↑ Х. Брюкнер, Т. Вестхаузер, Х. Гёдел: Жидкостное хроматографическое определение D- и L-аминокислот путем дериватизации с о-фтальдиальдегидом и N-изобутирил-L-цистеином. Приложения, относящиеся к анализу пептидных антибиотиков, токсинов, лекарств и фармацевтически используемых аминокислот. В кн . : Журнал хроматографии. A. Том 711, номер 1, сентябрь 1995 г., стр. 201-215, PMID 7496491 .
- ↑ Р. Х. Бак, К. Круммен: Высокоэффективное жидкостное хроматографическое определение энантиомерных аминокислот и аминоспиртов после дериватизации с о-фталевым диальдегидом и различными хиральными меркаптанами. Применение к пептидным гидролизатам. В кн . : Журнал хроматографии. Том 387, январь 1987 г., стр. 255–265, PMID 3558624 .
- ^ А. Хашимото, Т. Нишикава и др .: Присутствие свободного D-серина в головном мозге крысы. В: Письма ФЕБС. Том 296, номер 1, январь 1992 г., стр. 33-36, PMID 1730289 .
- ↑ a b Н. В. Клекнер, Р. Дингледин: Потребность в глицине для активации рецепторов NMDA, экспрессируемых в ооцитах Xenopus. В кн . : Наука. Том 241, номер 4867, август 1988 г., стр. 835-837, PMID 2841759 .
- ↑ а б Х. Волоскер, С. Блэкшоу, Ш. Снайдер: Серин рацемаза: глиальный фермент, синтезирующий D-серин для регулирования нейротрансмиссии глутамат-N-метил-D-аспартата. В: PNAS. Выпуск 96, номер 23, ноябрь 1999 г., стр. 13409-13414, PMID 10557334 . PMC 23961 (полный текст).
- ↑ Х. Волоскер, Э. Думин и др.: D-аминокислоты в головном мозге: D-серин в нейротрансмиссии и нейродегенерации. В: Журнал FEBS. Том 275, номер 14, июль 2008 г., стр. 3514-3526, DOI : 10.1111 / j.1742-4658.2008.06515.x . PMID 18564180 . (Рассмотрение).
- ↑ С. Сакки, М. Бернаскони и др.: PLG72 модулирует внутриклеточные уровни D-серина посредством взаимодействия с оксидазой D-аминокислот: влияние на восприимчивость к шизофрении. В кн . : Журнал биологической химии. Том 283, номер 32, 2008 г., стр. 22244-22256, DOI : 10.1074 / jbc.M709153200 . PMID 18544534 .
- ↑ HJ Ryu, JE Kim et al.: Возможные роли D-серина и серинрацемазы в экспериментальной височной эпилепсии. В: Журнал исследований нейробиологии. Том 88, номер 11, 2010 г., стр. 2469-2482, DOI : 10.1002 / jnr . 22415 . PMID 20623543 .
- ^ SA Fuchs, R. Berger, TJ de Koning: D-серин: правильная или неправильная изоформа? В кн . : Исследования мозга. Том 1401, июль 2011 г., стр. 104-117, DOI: 10.1016 / j.brainres.2011.05.039 . PMID 21676380 . (Рассмотрение).
- ↑ Джулия Шарлау: Исследования эффектов хронического лечения каннабиноидами подростков на мышиной модели шизофрении. (PDF; 827 kB) Диссертация, Боннский университет им. Фридриха Вильгельма, 2012, стр.16.
- ↑ Э. Картвелишвили, М. Шлепер и др.: Высвобождение D-серина из нейронов обеспечивает новое средство активации рецепторов N-метил-D-аспартата. В кн . : Журнал биологической химии. Том 281, номер 20, май 2006 г., стр. 14151-14162, DOI : 10.1074 / jbc.M512927200 . PMID 16551623 .
- ↑ К. Мия, Р. Иноуэ и др.: Сериновая рацемаза преимущественно локализуется в нейронах головного мозга мышей. В кн . : Журнал сравнительной неврологии. Том 510, номер 6, октябрь 2008 г., стр. 641-654, DOI : 10.1002 / cne.21822 . PMID 18698599 .
- ↑ Л. Поллегиони, С. Сакки: Метаболизм нейромодулятора D-серина. В кн . : Клеточные и молекулярные науки о жизни. Том 67, номер 14, июль 2010 г., стр. 2387-2404, DOI : 10.1007 / s00018-010-0307-9 . PMID 20195697 . (Рассмотрение).
- ↑ JT Kantrowitz, DC Javitt: Дисфункция или нарушение регуляции рецептора N-метил-d-аспартата (NMDA): последний общий путь на пути к шизофрении? В: Бюллетень исследований мозга. Том 83, номер 3–4, сентябрь 2010 г., стр. 108–121, DOI : 10.1016 / j.brainresbull.2010.04.006 . PMID 20417696 . PMC 2941541 (полный текст). (Рассмотрение).
- ↑ Дж. Т. Койл: Глутамат и шизофрения: за пределами допаминовой гипотезы. В кн . : Клеточная и молекулярная нейробиология. Том 26, номера 4-6, июль-август 2006 г., стр. 365-384, DOI : 10.1007 / s10571-006-9062-8 . PMID 16773445 . (Рассмотрение).
- ↑ И. Чумаков, М. Блюменфельд и др.: Генетические и физиологические данные о причастности нового человеческого гена G72 и гена оксидазы D-аминокислот к шизофрении. В: PNAS. Том 99, номер 21, октябрь 2002 г., стр. 13675-13680, DOI : 10.1073 / pnas.182412499 . PMID 12364586 . PMC 129739 (полный текст).
- ^ А. Корвин, К. А. МакГи и др.: Доказательства ассоциации и эпистаза в локусах DAOA / G30 и D-аминокислотной оксидазы в образце ирландской шизофрении. В: Американский журнал медицинской генетики. Том 144B, номер 7, октябрь 2007 г., стр. 949-953, DOI : 10.1002 / ajmg.b.30452 . PMID 17492767 .
- ↑ Т. Охнума, Н. Шибата и др.: Анализ ассоциации генов, связанных с глицином и серином, в популяции пациентов с шизофренией в Японии. В кн . : Прогресс нейропсихофармакологии и биологической психиатрии. Том 33, номер 3, апрель 2009 г., стр. 511-518, DOI : 10.1016 / j.pnpbp.2009.02.004 . PMID 19223009 .
- ↑ К. Хашимото, Т. Фукусима и др.: Снижение сывороточных уровней D-серина у пациентов с шизофренией: данные в поддержку гипотезы шизофрении о гипофункции рецептора N-метил-D-аспартата. В кн . : Архив общей психиатрии. Том 60, номер 6, июнь 2003 г., стр. 572-576, DOI : 10.1001 / archpsyc.60.6.572 . PMID 12796220 .
- ↑ Бендиков И., Надри и а.: ЦСЖ и посмертное исследование параметров метаболизма D-серина при шизофрении в мозге. В кн . : Исследование шизофрении. Том 90, номер 1–3, февраль 2007 г., стр. 41–51, DOI: 10.1016 / j.schres.2006.10.010 . PMID 17156977 .
- ↑ К. Хашимото, Г. Энгберг и др.: Снижение отношения D-серина к общему серину в спинномозговой жидкости больных шизофренией, ранее не принимавших лекарственные препараты. В кн . : Прогресс нейропсихофармакологии и биологической психиатрии. Том 29, номер 5, июнь 2005 г., стр. 767-769, DOI : 10.1016 / j.pnpbp.2005.04.023 . PMID 15939521 .
- ↑ Л. Верралл, М. Уокер и др.: D-Аминокислотная оксидаза и серинрацемаза в мозге человека: нормальное распределение и измененная экспрессия при шизофрении. В: Европейский журнал нейробиологии. Том 26, номер 6, сентябрь 2007 г., стр. 1657-1669, DOI: 10.1111 / j.1460-9568.2007.05769.x . PMID 17880399 . PMC 2121142 (полный текст).
- ↑ Л. Верралл, П. У. Бернет и др.: Нейробиология оксидазы D-аминокислот и ее участие в шизофрении. В кн . : Молекулярная психиатрия. Том 15, номер 2, февраль 2010 г., стр. 122-137, DOI : 10.1038 / mp.2009.99 . PMID 19786963 . PMC 2811712 (полный текст). (Рассмотрение).
- ↑ R. Kapoor, KS Lim et al.: Предварительные доказательства связи между шизофренией и метаболическими ферментами лиганда рецептора NMDA-глицинового сайта, оксидазой d-аминокислот (DAAO) и кинуренинаминотрансферазой-1 (KAT-1). В кн . : Исследования мозга. Том 1106, номер 1, август 2006 г., стр. 205-210, DOI: 10.1016 / j.brainres.2006.05.082 . PMID 16828464 .
- ↑ К. Мадейра, М. Е. Фрейтас и др.: Повышенная активность оксидазы D-аминокислот в головном мозге (DAAO) при шизофрении. В кн . : Исследование шизофрении. Том 101, номер 1-3, апрель 2008 г., стр. 76-83, DOI: 10.1016 / j.schres.2008.02.002 . PMID 18378121 .
- ^ JT Coyle, G. Tsai, DC Goff: Ионотропные рецепторы глутамата как терапевтические мишени при шизофрении. В: Текущие мишени для лекарств. Volume 1, Number 2, April 2002, pp. 183-189, PMID 12769626 . (Рассмотрение).
- ↑ Г. Цай, П. Ян и др.: D-серин добавлен к нейролептикам для лечения шизофрении. В кн . : Биологическая психиатрия. Том 44, номер 11, декабрь 1998 г., стр. 1081-1089, PMID 9836012 .
- ^ HJ Tuominen, J. Tiihonen, K. Wahlbeck: Глутаматергические препараты от шизофрении. В: Кокрановская база данных систематических обзоров (онлайн). Номер 2, 2006 г., S. CD003730, DOI : 10.1002 / 14651858.CD003730.pub2 . PMID 16625590 . (Рассмотрение).
- ↑ Д.В. Феррарис, Т. Цукамото: Последние достижения в открытии ингибиторов оксидазы D-аминокислот и их терапевтического применения при шизофрении. В: Современный фармацевтический дизайн. Volume 17, Number 2, 2011, pp. 103-111, PMID 21361869 . (Рассмотрение).
- ↑ CA Strick, C. Li et al.: Модуляция функции рецептора NMDA путем ингибирования оксидазы D-аминокислот в головном мозге грызунов. В кн . : Нейрофармакология. Том 61, номер 5-6, октябрь-ноябрь 2011 г., стр. 1001-1015, DOI : 10.1016 / j.neuropharm.2011.06.029 . PMID 21763704 .
- ↑ T. Sparey, P. Abeywickrema и др.: Открытие конденсированных пирролкарбоновых кислот в качестве новых мощных ингибиторов оксидазы D-аминокислот (DAO). В: Письма по биоорганической и медицинской химии. Том 18, номер 11, июнь 2008 г., стр. 3386-3391, DOI : 10.1016 / j.bmcl.2008.04.020 . PMID 18455394 .
- ↑ Берри Дж. Ф., Феррарис Д. В., Дюваль Б. и др. : Синтез и SAR 1-гидрокси-1H-бензо [d] имидазол-2 (3H) -онов как ингибиторов D-аминокислотной оксидазы . В: ACS Med Chem Lett . 3, № 10, 2012, стр. 839-843. DOI : 10.1021 / ml300212a . PMID 23243487 .
- ↑ Sacchi S, Rosini E, Pollegioni L, Molla G: Ингибиторы D-аминокислотной оксидазы как новый класс лекарств для терапии шизофрении . В: Curr. Pharm. Des. . 2012. PMID 23116391 .
- ↑ Paul P, de Belleroche J: Роль D-аминокислот в патогенезе бокового амиотрофического склероза: обзор . В: Аминокислоты . 43, No. 5, 2012, pp. 1823-1831. DOI : 10.1007 / s00726-012-1385-9 . PMID 22890612 .
- ↑ Сасабе Дж., Чиба Т., Ямада М. и др. : D-серин является ключевым фактором токсичности глутамата при боковом амиотрофическом склерозе . В: EMBO J. . 26, No. 18, 2007, pp. 4149-4159. DOI : 10.1038 / sj.emboj.7601840 . PMID 17762863 . PMC 2230675 (полный текст).
- ↑ DS Dunlop и др. Neidle. A .: Наличие свободной D-аспарагиновой кислоты у грызунов и человека. В кн . : Сообщения о биохимических и биофизических исследованиях. Том 141, номер 1, ноябрь 1986 г., стр. 27-32, PMID 3801000 .
- ↑ Х. Волоскер, А. Д'Аниелло, Ш. Снайдер: Распределение D-аспартата в нейрональных и эндокринных тканях: онтогенез, биосинтез и высвобождение. В кн . : Неврология. Volume 100, Number 1, 2000, pp. 183-189, PMID 10996468 .
- ↑ М. Катане, Х. Хомма: D-аспартатоксидаза: единственный катаболический фермент, действующий на свободный D-аспартат у млекопитающих. В кн . : Химия и биоразнообразие. Том 7, номер 6, июнь 2010 г., стр. 1435-1449, DOI: 10.1002 / cbdv.200900250 . PMID 20564562 . (Рассмотрение).
- ↑ а б Х. Охиде, Ю. Миёси и др.: Метаболизм D-аминокислот у млекопитающих: биосинтез, деградация и аналитические аспекты исследования метаболизма. В кн . : Журнал хроматографии. B Том 879, номер 29, ноябрь 2011 г., стр. 3162-3168, DOI : 10.1016 / j.jchromb.2011.06.028 . PMID 21757409 . (Рассмотрение).
- ↑ а б П. М. Ким, X. Дуан и др.: Аспартатрацемаза, вырабатывающая нейрональный D-аспартат, регулирует нейрогенез у взрослых. В: PNAS. Том 107, номер 7, февраль 2010 г., стр. 3175-3179, DOI : 10.1073 / pnas.0914706107 . PMID 20133766 . PMC 2840285 (полный текст).
- ↑ Y. Mori, K. Aki et al.: УФ-B-облучение усиливает рацемизацию и изомеризацию аспартильных остатков и выработку N? -Карбоксиметиллизина (CML) в кератине кожи. В: Журнал хроматографии B. Том 879, номер 29, ноябрь 2011 г., стр. 3303-3309, DOI : 10.1016 / j.jchromb.2011.05.010 . PMID 21636332 .
- ↑ Н. Фуджи, Ю. Каджи и др.: Коллапс гомохиральности аминокислот в белках из различных тканей во время старения. В кн . : Химия и биоразнообразие. Том 7, номер 6, июнь 2010 г., стр. 1389-1397, DOI: 10.1002 / cbdv.200900337 . PMID 20564552 . (Рассмотрение).
- ↑ Н. Фуджи: D-аминокислота в тканях пожилого возраста. В: Биологический и фармацевтический вестник. Том 28, номер 9, сентябрь 2005 г., стр. 1585-1589, PMID 16141520 . (Рассмотрение).
- ↑ Грэм С. Барретт, Дональд Тревор Элмор: Аминокислоты и пептиды. Cambridge University Press, 1998, ISBN 0-521-46292-4 , стр. 15-16 ( ограниченный предварительный просмотр в Поиске книг Google).
- ^ С. Ритц-Тимм , MJ Коллинз: рацемизация аспарагиновой кислоты в человеческих белках. В: Обзоры исследований старения. Том 1, номер 1, февраль 2002 г., стр. 43-59, PMID 12039448 . (Рассмотрение).
- ↑ Х. Мори, К. Исии и др.: Рацемизация: ее биологическое значение в нейропатогенезе болезни Альцгеймера. В: Журнал экспериментальной медицины Тохоку. Том 174, номер 3, ноябрь 1994 г., стр. 251-262, PMID 7761990 .
- ^ Р. Шапира, Г. Е. Остин, С. С. Мирра: Амилоид невритной бляшки при болезни Альцгеймера сильно рацемизирован. В: Журнал нейрохимии. Том 50, номер 1, январь 1988 г., стр. 69-74, PMID 3121789 .
- ↑ AE Raw, JD Lowenson ua .: Структурные изменения в пептидном скелете бета-амилоидного корового белка могут объяснить его отложение и стабильность при болезни Альцгеймера. В кн . : Журнал биологической химии. Volume 268, Number 5, February 1993, pp. 3072-3083, PMID 8428986 .
- ↑ а б Т. Томияма, С. Асано и др.: Рацемизация остатка Asp23 влияет на агрегационные свойства аналогов белка бета-амилоида Альцгеймера. В кн . : Журнал биологической химии. Volume 269, Number 14, April 1994, pp. 10205-10208, PMID 8144598 .
- ^ Патрик Р. Хоф, Чарльз В. Моббс: Справочник по неврологии старения. Academic Press, 2009, ISBN 0-12-374898-4 , стр. 41 ( ограниченный предварительный просмотр в Поиске книг Google).
- ↑ М.Л. Моро, М.Дж. Коллинз, Э. Каппеллини: болезнь Альцгеймера и отложение бета-пептида амилоида в головном мозге: вопрос «старения»? В: Труды Биохимического общества. Том 38, номер 2, апрель 2010 г., стр. 539-544, DOI : 10.1042 / BST0380539 . PMID 20298218 . (Рассмотрение).
- ^ Гюнтер Вестфаль, Герхард Гербер, Бодо Липке: Белки - питательные и функциональные свойства. Springer, 2003 ISBN 3-540-00232-4 , стр. 125 ( ограниченный предварительный просмотр в поиске книг Google).
- ^ Герхард Г. Хабермель , Питер Э. Хамманн и другие: химия природных веществ. 3-е издание, Springer, 2008 г., ISBN 3-540-73732-4 , стр. 252 ( ограниченный предварительный просмотр в поиске книг Google).
- ↑ Беневенга Н.Дж., Стил Р.Д.: Побочные эффекты чрезмерного потребления аминокислот. В: Ежегодный обзор питания. Том 4, 1984, стр. 157-181, DOI : 10.1146 / annurev.nu.04.070184.001105 . PMID 6235826 . (Рассмотрение).
- ↑ Дж. Загон, Л.-И. Дене, К.-В. Bögl: D-аминокислоты в организмах и продуктах питания. В: Nutr Res. Volume 14, 1994, pp. 445-463.
- ↑ Вернер Балтес , Рейнхард Матиссек : Lebensmittelchemie, 7-е издание, Springer, 2011 г., ISBN 3-642-16538-9 , стр. 164 ( ограниченный предварительный просмотр в поиске книг Google).
- ↑ W. Leuchtenberger, K. Huthmacher, K. Drauz: Биотехнологическое производство аминокислот и производных: современное состояние и перспективы. В кн . : Прикладная микробиология и биотехнология . Том 69, номер 1, ноябрь 2005 г., стр. 1-8, DOI: 10.1007 / s00253-005-0155-y . PMID 16195792 . (Рассмотрение).
- ^ FH Leibach, V. Ganapathy: транспортеры пептидов в кишечнике и почках. В: Ежегодный обзор питания. Том 16, 1996, стр. 99-119, DOI : 10.1146 / annurev.nu.16.070196.000531 . PMID 8839921 . (Рассмотрение).
- ↑ а б в М. Фридман: Происхождение, микробиология, питание и фармакология D-аминокислот. В кн . : Химия и биоразнообразие. Том 7, номер 6, 2010 г., стр. 1491-1530, DOI: 10.1002 / cbdv.200900225 . PMID 20564567 . (Рассмотрение).
- ^ W. Heine, K. Wutzke, U. Drescher: использование D-аминокислот у младенцев, измеренное с помощью метода 15N-метки. В кн . : Лечебное питание. Том 2, номер 1, апрель 1983 г., стр. 31-35, PMID 16829405 .
- ↑ М. Фридман, Р. Лиардон : Кинетика рацемизации аминокислотных остатков в соевых белках, обработанных щелочью. В: J. Agric Food Chem. Volume 33, 1985, pp. 666-672.
- ^ JC Crawhall, DF Elliott: Примечание о рацемизации серина. В кн . : Биохимический журнал. Том 48, номер 2, февраль 1951 г., стр. 237-238, PMID 14820833 . PMC 1275510 (полный текст).
- ^ М. Люпке, Х. Брюкнер: Газохроматографическая оценка эпимеризации аминокислот в процессе производства и обработки желатина. В: Журнал исследований и исследований в области пищевых продуктов A. Том 206, номер 5, 1998 г., стр. 323–328. DOI: 10.1007 / s002170050266 .
- ↑ Nutrition Report 1996. German Society for Nutrition , 1996, ISBN 3-921606-33-0 , S. 149th.
- ^ A b c Иоганн Фридрих Диль : Химия в продуктах питания. John Wiley & Sons, 2012, ISBN 3-527-66084-4 , стр. 95 ( ограниченный предварительный просмотр в поиске книг Google).
- ↑ Х. Лапьер, Г. Холтроп и др.: Биодоступен ли D-метионин молочной корове? В кн . : Журнал молочной науки. Том 95, номер 1, январь 2012 г., стр. 353-362, DOI: 10.3168 / jds.2011-4553 . PMID 22192214 .
- ^ WH Фишман, С. Артом: сериновая травма. В: J Biol Chem. Volume 145, 1942, pp. 345-346.
- ^ RP Morehead, C. Artom, WH Fishman: нефротоксическое действие серина. В кн . : Известия. Американская федерация клинических исследований. Том 2, 1945, с. 81, PMID 20275626 .
- ↑ FA Carone, CE Ganote: нефротоксичность D-серина. Природа протеинурии, глюкозурии и аминоацидурии при остром некрозе канальцев. В кн . : Архив патологии. Том 99, номер 12, декабрь 1975 г., стр. 658-662, PMID 1203037 .
- ↑ RE Williams, EA Lock: нефротоксичность, вызванная D-серином: возможное взаимодействие с метаболизмом тирозина. В кн . : Токсикология. Том 201, номер 1-3, сентябрь 2004 г., стр. 231-238, DOI : 10.1016 / j.tox.2004.05.001 . PMID 15297036 .
- ↑ Д.Р. Петерсон, Ф.А. Кароне: Регенерация почек после индуцированного d-серином острого канальцевого некроза. В: Анатомическая запись. Том 193, номер 3, март 1979 г., стр. 383-388, DOI: 10.1002 / ar.1091930305 . PMID 426302 .
- ↑ CE Ganote, DR Peterson, FA Carone: Природа нефротоксичности, вызванной D-серином. В кн . : Американский журнал патологии. Том 77, номер 2, ноябрь 1974 г., стр. 269-282, PMID 4447130 . PMC 1910915 (полный текст).
- ↑ MS Pilone, L. Pollegioni: Оксидаза D-аминокислот как промышленный биокатализатор. В кн . : Биокатализ и биотрансформация. Volume 20, Number 3, 2002, стр. 145-159. DOI: 10.1080 / 10242420290020679 .
- ↑ AW Krug, K. Völker et al.: Почему D-серин нефротоксичен, а альфа-аминоизомасляная кислота защищает? ( Memento из в оригинале с 16 января 2016 года в Internet Archive ) Info: архив ссылка была вставлена автоматически и еще не была проверена. Пожалуйста, проверьте исходную и архивную ссылку в соответствии с инструкциями, а затем удалите это уведомление. В: Американский журнал физиологии - физиология почек. Том 293, номер 1, 2007 г., стр. F382-F390, DOI: 10.1152 / ajprenal.00441.2006 . PMID 17429029 .
- ↑ Г. Любек, К. Вольф, Б. Бартош: Изомеризация аминокислот и микроволновое воздействие. В кн . : Ланцет. Том 334, номер 8676, декабрь 1989 г., стр. 1392-1393, PMID 2574327 .
- ^ Карл С. Крушельницкий: Микроволны повреждают пищу. В: Азбука науки. 23 марта 2006 г.
- ^ W. Segal: Микроволновое нагревание молока. В кн . : Ланцет. Том 335, номер 8687, февраль 1990 г., стр. 470, PMID 1968186 .
- ↑ Воздействие на растения воды, облученной микроволнами. Проверено 24 августа 2012 года.
- ↑ Опасные микроволны. 24 октября 2008 г., по состоянию на 28 сентября 2012 г.
- ↑ П. Фриц, Л. И. Дене, Дж. Загон, К. В. Бёгл: К вопросу об изомеризации аминокислот в микроволновом поле: результаты модельного эксперимента со стандартными растворами. В: Журнал диетологии. Том 31, номер 3, 1992 г., стр. 219-224.
- ↑ Л. И. Дене, П. Фриц: Изомеризация аминокислот с помощью микроволнового нагрева? В: Федеральный вестник здравоохранения. Том 35, 1992, стр. 463-464.
- ↑ П. Зибер, П. Эберхард, П.У. Галлманн: Термическая обработка молока в домашних микроволновых печах. В: Int Dairy Journal. Том 6, 1996, стр. 231-246, DOI : 10.1016 / 0958-6946 (95) 00009-7 .
- ↑ Дж. Загон, Л. Дене, К.-В. Bögl: Изомеризация аминокислот в пище. Часть I: Механизмы и распределение изомеризации аминокислот в организмах и пищевых продуктах. В: Обзор питания. Том 38, 1991, стр. 275-278 и 324-328.
- ↑ А. Черкин, Дж. Л. Дэвис, М. В. Гарман: D-пролин: стереоспецифичность и зависимость летальной судорожной активности у цыплят от хлорида натрия. В кн . : Фармакология, биохимия и поведение. Том 8, номер 5, май 1978 г., стр. 623-625, PMID 674269 .
- ^ А. Шибер, Х. Брюкнер и др.: Оценка уровней D-аминокислот у крыс с помощью газовой хроматографии, выбранной ионной масс-спектрометрии: нет доказательств подострой токсичности перорального приема D-пролина и D-аспарагиновой кислоты. В кн . : Журнал хроматографии. Volume 691, Number 1, March 1997, pp. 1-12, PMID 9140753 .
- ↑ С. Н. Али, Г. О'Тул, М. Тайлер: Горит бутылка с молоком. В кн . : Журнал ожоговой терапии и реабилитации. Том 25, номер 5, 2004 г., стр. 461-462, PMID 15353942 .
- ^ IA Jaffe, K. Altman, P. Merryman: антипиридоксиновый эффект пеницилламина у человека. В: Журнал клинических исследований. Том 43, октябрь 1964 г., стр. 1869-1873, DOI: 10.1172 / JCI105060 . PMID 14236210 . PMC 289631 (полный текст).
- ↑ TN Schumacher, LM Mayr et al.: Идентификация D-пептидных лигандов с помощью зеркального фагового дисплея. В кн . : Наука. Volume 271, Number 5257, March 1996, pp. 1854-1857, PMID 8596952 .
- ↑ Катя Визехан: Идентификация и характеристика специфического лиганда для амилоид-β-пептида (Aβ) болезни Альцгеймера. (PDF; 11,1 МБ) Диссертация, Байройтский университет, 2003 г., стр.21.
- ↑ Дж. М. Маннинг, С. Мур: Определение D- и L-аминокислот с помощью ионообменной хроматографии в виде дипептидов LD и LL. В кн . : Журнал биологической химии. Том 243, номер 21, ноябрь 1968 г., стр. 5591-5597, PMID 5699053 .
- ↑ K. Soda: Микроопределение D-аминокислот и оксидазной активности D-аминокислот с помощью гидрохлорида 3, метил-2-бензотиазолон гидразона. В кн . : Аналитическая биохимия. Том 25, номер 1, октябрь 1968 г., стр. 228-235, PMID 4387536 .
- ↑ DOI: 10.1002 / ardp.19863190515 .
- ↑ Д.Л. Киршнер, Т.К. Грин: Разделение и чувствительное обнаружение D-аминокислот в биологических матрицах. В кн . : Журнал сепарационной науки. Том 32, номер 13, июль 2009 г., стр. 2305-2318, DOI : 10.1002 / jssc.200900101 . PMID 19569111 . (Рассмотрение).
- ↑ К. Хамасе, А. Морикава и др.: Анализ небольших количеств D-аминокислот и изучение их физиологических функций у млекопитающих. В кн . : Аналитические науки. Том 25, номер 8, август 2009 г., стр. 961-968, PMID 19667471 . (Рассмотрение).
- ↑ Кларисса Дороти Марзини: Пределы количественного энантиомерного анализа альфа-аминокислот. (PDF; 1,7 МБ) Диссертация, Тюбингенский университет Эберхарда Карла, 2007, стр. 20–21.
- ↑ Н. Нимура, Т. Киношита: О-фтальдиальдегид N-ацетил-L-цистеин как реагент хиральной дериватизации для жидкостного хроматографического оптического разделения энантиомеров аминокислот и его применение в обычном аминокислотном анализе. В: Journal of Chromatography A. Volume 352, 1986, pp. 169-177. DOI: 10.1016 / S0021-9673 (01) 83377-X .
- ↑ Биргит Гееке: Новые оксидазы аминокислот из Rhodococcus opacus и Arthrobacter protophormiae: Исследования биохимических характеристик, клонирования и экспрессии. (PDF; 9,6 МБ) Диссертация, Дюссельдорфский университет имени Генриха Гейне, 2002 г., стр.1.
- ↑ Э. Такахаши, М. Фуруи и др.: Производство D-лизина из L-лизина путем последовательной химической рацемизации и микробной асимметричной деградации. В кн . : Прикладная микробиология и биотехнология . Volume 47, Number 4, April 1997, pp. 347-351, PMID 9163947 .
- ↑ К. Изобе, Х. Тамаучи и др.: Простой ферментативный метод производства широкого спектра D-аминокислот с использованием L-аминокислотной оксидазы из Rhodococcus sp. АИУ З-35-1. В кн . : Ферментные исследования. Том 2010, 2010, стр. 567210, DOI: 10.4061 / 2010/567210 . PMID 21048866 . PMC 2962901 (полный текст).
- ↑ Керстин Рагниц: Иммобилизация и стабилизация гидантоиназы и LN карбамоилазы из Arthrobacter aurescens DSM 3747. (PDF; 997 kB) Диссертация, Штутгартский университет, 2000, стр. 4.
- ↑ Согласно новому отчету Global Industry Analysts, Inc., глобальный рынок D-аминокислот к 2017 году достигнет 3,7 миллиарда долларов. На сайте prweb.com, 25 августа 2011 года.
- ↑ С. Мартинес-Родригес, А. И. Мартинес-Гомес и др.: Естественное распространение и промышленное применение D-аминокислот: обзор. В кн . : Химия и биоразнообразие. Том 7, номер 6, июнь 2010 г., стр. 1531-1548, DOI: 10.1002 / cbdv.200900245 . PMID 20564568 . (Рассмотрение).
- ↑ a b Маркус Вернер: Клонирование D-карбамоилазы из Arthrobacter crystallopoietes DSM 20117. Диссертация, Штутгартский университет, 2001.
- ↑ Б. Кучер, М. Бернд: Химия и молекулярная биология в поисках новых антагонистов LHRH. В: Angew Chem. Volume 109, number 20, 1997, pp. 2240-2254, DOI : 10.1002 / ange.19971092005 .
- ↑ T. Beckers, M. Bernd et al.: Исследования структурно-функциональных функций линейных и циклизованных пептидных антагонистов рецептора GnRH. В кн . : Сообщения о биохимических и биофизических исследованиях. Том 289, номер 3, декабрь 2001 г., стр. 653-663, DOI: 10.1006 / bbrc.2001.5939 . PMID 11726197 .
- ↑ Алаа А.-М. Абдель-Азиз, Юсиф А. Асири и другие: Тадалафил. ( Memento из в оригинале с 24 декабря 2012 года в Internet Archive ) Info: архив ссылка автоматически вставляется и еще не была проверена. Пожалуйста, проверьте исходную и архивную ссылку в соответствии с инструкциями, а затем удалите это уведомление. (PDF; 4,4 МБ) В: Гарри Г. Бриттен (ред.): Профили лекарственных веществ, вспомогательных веществ и связанных с ними методологий. Academic Press, 2011, ISBN 0-12-387702-4 , стр. 287–329 ( ограниченный предварительный просмотр в Поиске книг Google).
- ↑ Э. Фишер, Б. Хеллер и др.: Терапия депрессии фенилаланином. Предварительное примечание. В кн . : Исследования лекарственных средств. Том 25, номер 1, январь 1975 г., стр.132 , PMID 1173765 .
- ↑ С. Эренпрейс: D-фенилаланин и другие ингибиторы энкефалиназы в качестве фармакологических агентов: значение для некоторых важных терапевтических приложений. В: Действия / злоупотребление психоактивными веществами и алкоголем. Том 3, номер 4, 1982, стр. 231-239, PMID 6301083 .
- ↑ Митчелл Бебель Старгроув, Джонатан Треже, Дуайт Л. Макки: Взаимодействие трав, питательных веществ и лекарств. Elsevier Health Sciences, 2008, ISBN 0-323-02964-7 , стр. 682 ( ограниченный предварительный просмотр в поиске книг Google).
- ^ Фенилаланины. Медицинский центр Университета Мэриленда, по состоянию на 21 сентября 2012 г.
- ^ DL Уильямс: Ветеринарный подход к европейской медоносной пчеле (Apis mellifera) В: Ветеринарный журнал. Том 160, номер 1, июль 2000 г., стр. 61-73, DOI: 10.1053 / tvjl.2000.0474 . PMID 10950136 . (Рассмотрение).