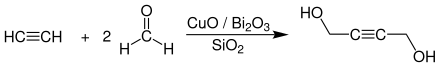формальдегид
| Структурная формула | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Общий | ||||||||||||||||||||||
| Фамилия | формальдегид | |||||||||||||||||||||
| другие имена |
|
|||||||||||||||||||||
| Молекулярная формула | CH 2 O | |||||||||||||||||||||
| Краткое описание |
бесцветный, резкий, проникающий пахнущий газ |
|||||||||||||||||||||
| Внешние идентификаторы / базы данных | ||||||||||||||||||||||
| ||||||||||||||||||||||
| характеристики | ||||||||||||||||||||||
| Молярная масса | 30,03 г моль -1 | |||||||||||||||||||||
| Физическое состояние |
газообразный |
|||||||||||||||||||||
| плотность |
0,815 г см -3 (-20 ° С) |
|||||||||||||||||||||
| Температура плавления |
−117 ° С |
|||||||||||||||||||||
| точка кипения |
−19 ° С |
|||||||||||||||||||||
| Давление газа |
0.43-0.44 М Па (20 ° С) |
|||||||||||||||||||||
| растворимость |
легко растворим в воде |
|||||||||||||||||||||
| правила техники безопасности | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
DFG / Швейцария: 0,3 мл м -3 или 0,37 мг м -3 |
|||||||||||||||||||||
| Токсикологические данные | ||||||||||||||||||||||
| Термодинамические свойства | ||||||||||||||||||||||
| ΔH f 0 |
-108,6 кДж / моль |
|||||||||||||||||||||
| Насколько это возможно и общепринято, используются единицы СИ . Если не указано иное, приведенные данные относятся к стандартным условиям . | ||||||||||||||||||||||
Формальдегид ( IPA : [fɔɐ̯m.aldehyːt] , , также [fɔʁm.aldeˈhyːt] , , систематическое название метаналь ) представляет собой органическое химическое соединение с эмпирической формулой CH 2 O и простейшим членом группа веществ альдегиды . В стандартных условиях формальдегид - это газ с резким запахом.
При ежегодном производстве около 21 миллиона тонн (по состоянию на 2019 год, исходя из 100% формальдегида) формальдегид является одним из наиболее широко производимых органических химикатов. Техническая продукция формальдегида имеет место каталитически за счет окисления или дегидрирования из метанола , например , в процессе каталитического серебра или в процессе Formox . В химической промышленности он используется, в частности, в качестве сырья при производстве фенольных и карбамидных смол . Другой полимер - параформальдегид , который, помимо прочего, используется в клеточной биологии. Это мощный антисептик и дезинфицирующее средство , которое доступно в виде 40-процентного раствора альдегида в воде и используется как фунгицид и консервант .
В природе формальдегид встречается как продукт окисления терпенов и как продукт метаболизма бактерий , которые аэробно метаболизируют субстраты с атомом углерода, такие как метанол, метан или метиламин, с образованием диоксида углерода . Формальдегид является частью метаболизма человека. Классифицируется как канцероген.
номенклатура
Систематическое название метаналь по ИЮПАК для молекулярного формальдегида происходит от метана путем добавления суффикса -al для альдегидов. Предпочтительное название IUPAC « формальдегид» происходит от латинского слова « formica », обозначающего муравей , поскольку формальдегид может быть преобразован в муравьиную кислоту путем окисления .
Водный раствор формальдегида известен как формалин или, реже, формол . В 1893 году он продавался как «Формалин» от Шеринга и как «Формол» от Хёхст . Насыщенный водный раствор содержит около 40% по объему или 37% по массе и называется «100% формалин». Стабилизатор, такой как метанол , часто добавляют к нему, чтобы подавить полимеризацию . Типичный коммерческий формалин может содержать до 12% метанола. Показатели производства формальдегида обычно приводятся из расчета 37% массовой доли раствора формалина.
В водном растворе формальдегид находится в гидратированной форме в виде метандиола с формулой CH 2 (OH) 2 . В зависимости от концентрации и температуры это соединение находится в равновесии с различными олигомерами, называемыми параформальдегидом, с типичной степенью полимеризации от 8 до 100 единиц. Нагревание обращает реакцию и снова высвобождает формальдегид из параформальдегида. Под торговым названием Formcel от Celanese представлены растворы формальдегида в метаноле (Methyl Formcel) с 55,0% массовой долей формальдегида, 34,5% массовой доли метанола и 10,5% массовой доли воды, а также растворы в бутаноле и изобутаноле (Butyl Formcel) с 40% Доступны массовая доля формальдегида, 53% массовая доля бутанола и 7% массовая доля воды. Триоксан - тример молекулярного формальдегида.
история
Александр Михайлович Бутлеров синтезировал формальдегид или параформальдегид в 1855 году путем преобразования дииодметана с ацетатом серебра . Он омылял ацетат, первоначально образовавшийся путем кипячения его с водой, и концентрировал полученный раствор в вакууме. Бутлеров, назвавший это вещество «диоксиметиленом», не узнал, что он произвел параформальдегид. Он исследовал химию формальдегида и в 1861 году открыл формозную реакцию , при которой смесь сахаров образуется из формальдегида.
Разработка технического синтеза
В своих поисках первого члена альдегидной серии Август Вильгельм фон Хофманн выполнил первое целевое изображение в 1867 году путем дегидрирования метанола на светящейся платиновой проволоке . Этот лабораторный процесс позволил произвести несколько литров раствора формальдегида из метанола и, таким образом, провести дальнейшие исследования химии этого альдегида. В 1872 году Адольф фон Байер обнаружил его конденсацию с фенолом с образованием фенолформальдегидных смол , но дальше этого открытия не предпринимал.
Бернхард Толленс оптимизировал выход, регулируя соотношение метанола к воздуху; Чтобы избежать взрывов, он разработал пламегаситель в виде асбестовой прокладки , которую он вставил между резервуаром для метанола и платиновой спиралью . Оскар Лоу улучшил синтез формальдегида, используя сначала оксид железа (III), а затем медь в качестве катализатора.
В 1888 году компания Mercklin & Lösekann в Зельце начала коммерческое производство формальдегида. С 1889 года потребность в формальдегиде для производства красителей увеличилась . Так можно получить акридин по реакции дифениламина с формальдегидом, катализируемый хлорид цинка . Акридин является основным веществом для акридиновых красителей, таких как акридиновый оранжевый и акридиновый желтый , которые до этого получали только из каменноугольной смолы .
Компания Meister, Lucius and Brüning , которая в 1890 году получила патент на производство формальдегида у Жана Жозефа Огюста Трилья , проявляла значительный интерес к разработке медицинских приложений для водных растворов формальдегида. В 1892 году они поручили франкфуртскому врачу Фердинанду Блюму исследовать антисептические свойства формальдегида. Блюм продемонстрировал бактерицидные свойства 4-процентного раствора формальдегида на таких бактериях, как Bacillus anthracis и Staphylococcus aureus . Случайно в ходе своих экспериментов он обнаружил возможность фиксации образцов тканей формальдегидом.
Пластмассы из формальдегида
Формальдегид нашел свое первое техническое применение благодаря изобретению Галалита , термореактивного пластика на основе казеина и формальдегида, запатентованного Адольфом Шпиттелером и Вильгельмом Крише в 1897 году . Пластик успешно продавался и использовался для изготовления гребней и аксессуаров для волос , вязальных спиц, ручек, ручек зонтов, белых клавиш пианино, электроприборов и многого другого. В Германском рейхе в 1913 году около 6% всего производства молока использовалось для производства галалита.
Работы Байера по конденсации фенола и формальдегида были подхвачены различными химиками, например Артуром Смитом в 1899 г., А. Люфтом в 1902 г., Ф. Хенше в 1903 г., который исследовал конденсацию, катализируемую щелочью, и в 1905 г. Х. Рассказ. Но только Лео Бэкеланд осознал потенциал этого синтеза в 1907 году с производством бакелита , первого полностью синтетического пластика. Его компания General Bakelit начала техническое производство бакелита в 1910 году.
Однако бакелитовые продукты имели тенденцию к потемнению, и в 1918 году в поисках более прозрачных пластиков химик Ганс Джон обнаружил смолы мочевины. Из-за спроса на мочевину и фенольные смолы спрос на формальдегид резко вырос.
Масштабное производство
Он не был до Мэттиас Пирс и Алвин Митташ не освоено производство метанола из синтез - газа в процессе высокого давления на оксид цинка - оксид хрома катализаторов от Matthias пирса и Алвин Митташ в 1920 - х годах , что развитие крупномасштабного производства было начато. До этого момента коммерческое производство метанола было лишь побочным продуктом производства древесного угля , которое было начато в Германии в 1857 году компанией Dietze, Morano & Cie. началось в Лорч , в результате чего в дополнение к древесным углем и метанола, уксусной кислоты и метил ацетат были получены в качестве дополнительных продуктов .
В 1930 - х годах, Гомер Бартон Adkins и Уэсли Р. Петерсон разработали в реакцию Адкинс-Петерсон для прямого окисления метанола до формальдегида. Адкинс, который в то время работал в Bakelite Corporation, использовал для этого железо-молибденовый катализатор. Годовой объем производства составлял около 25000 тонн в 1931 году и увеличился в четыре раза до 100000 тонн к 1943 году.
Использование в деревообрабатывающей промышленности
В 1940-х годах завод в Бремене произвел первую древесно-стружечную плиту с использованием карбамидоформальдегидных смол, что вызвало большой спрос в строительной и мебельной промышленности. Благодаря этому переработка древесной щепы повысила степень использования деревьев с 40% до 80%.
Вхождение
Биологическое происхождение
В природе, например, формальдегид встречается как промежуточный продукт в клетках млекопитающих во время нормального метаболизма . Таким образом, у человека образуется от 878 до 1310 миллиграммов на килограмм веса тела в день . Для человека весом 70 килограммов это соответствует от 61 до 92 граммов формальдегида в день. Период полувыведения составляет от 1 до 1,5 минут. Люди выдыхают около 0,001–0,01 мг / м 3 формальдегида, без существенной разницы между курильщиками и некурящими. Уровень формальдегида в крови колеблется от 0,4 до 0,6 мкг см -3, а в моче от 2,5 до 4,0 мкг см -3 . Суточная доза составляет до 14 мг. Формальдегид также содержится в древесине и в небольших количествах выходит наружу.
Метилотрофные бактерии, такие как Methylophilaceae, или метанотрофные бактерии, такие как Methylococcaceae, метаболизируют ряд соединений только с одним атомом углерода, таких как метанол, метан , метиламин и дихлорметан, в качестве источника энергии. Эти соединения метаболизируются через цитотоксин формальдегид. Окисление формальдегида до диоксида углерода является важной частью метаболизма этих аэробных бактерий.
Еда и роскошные продукты
Формальдегид естественным образом содержится во фруктах, таких как яблоки и виноград . Самая низкая концентрация формальдегида в продуктах питания может быть измерена в свежем молоке: от 0,013 до почти 1 мг / кг. Самый высокий уровень был измерен в замороженном хеке - 232–293 мг / кг.
При потреблении одной пачки сигарет курильщик поглощает около 3 мг формальдегида в день. Некоторые электронные сигареты содержат такие вещества, как пропиленгликоль, которые могут выделять формальдегид при испарении. Курильщик электронных сигарет потребляет около 14 мг формальдегида в день при том же потреблении.
В процессе сохранения , такие как курение , пиролиз из лиственных высвобождает формальдегид. Обладает микробиоцидным действием против дрожжей и плесени, а также сшивает белки .
| еда | Формальдегид в [мг / кг] |
|---|---|
| Мясо и птица | 5,7-20 |
| рыба | 6.4-293 |
| молоко и молочные продукты | 0,01-0,80 |
| Сахар и подсластители | 0,75 |
| фрукты и овощи | 6-35 |
| кофе | 3,4–16 |
| Алкогольные напитки | 0,27–3,0 |
Атмосферные явления
Формальдегид - это повсеместно присутствующее следовое химическое вещество и самое распространенное карбонильное соединение в атмосфере. Он возникает в результате фотохимической реакции углеводородов или неполного сгорания ископаемого топлива и биомассы . Сжигание топлива и древесины являются преобладающими источниками антропогенного атмосферного формальдегида, причем большие выбросы происходят из биогенных источников, таких как окисление метана и изопрена .
Фотолиз формальдегида может играть роль в загрязнении воздуха в городской среде. Для фотолитического распада предполагается два пути реакции, один из которых протекает через образование водорода и окиси углерода.
Второй путь приводит к образованию водородного и формильного радикалов.
Важность этого пути реакции обусловлена тем фактом, что эти радикалы играют важную роль в окислении оксида азота до диоксида азота и образовании озона . Атмосферные поглотители формальдегида - это реакции с гидроксильными радикалами и фотолиз . Важным естественным источником выбросов формальдегида является атмосферное окисление метана. В тропической атмосфере Земли концентрация составляет около 1 ppb. Одним из основных источников здесь является окисление метана. Считается, что фотохимические процессы в первичной атмосфере привели к образованию около 3 миллионов тонн формальдегида в год. Осаждение формальдегида и последующие реакции формальдегида в первобытных водах, возможно, привели к абиотическому синтезу сложных органических молекул и, таким образом, возможно, сделали возможным возникновение жизни.
Внеземные явления
Радиоастрономы обнаружили формальдегид как первую многоатомную органическую молекулу в межзвездной среде во многих регионах нашей галактики посредством перехода вращения в основное состояние на частоте 4830 МГц, в основном вблизи молодых массивных звездных объектов. Изучение выбросов формальдегида полезно для определения пространственной плотности и кинетической температуры плотного газа в Млечном Пути и других галактиках, таких как NGC 660 .
Согласно радиоастрономическим измерениям вращательного перехода формальдегида в основном состоянии, отношение 12 C к 13 C в галактическом диске составляет от 5 до 8 килопарсек, примерно 50. Это в 2 раза меньше, чем в местной межзвездной среде. и качественно согласуется с предсказаниями моделей галактической эволюции, которые предсказывают более высокую металличность газа во внутреннем галактическом диске.
Считается, что формальдегид является важным предшественником большого количества более сложных органических молекул, таких как аминокислоты, в межзвездной среде. С помощью масс-спектрометра на борту зонда Rosetta был обнаружен формальдегид в хвосте кометы Чурюмова-Герассименко . Распределение формальдегида в коме комет C / 2012 F6 (Lemmon) и C / 2012 S1 (ISON) было измерено и подробно описано с помощью большой миллиметровой / субмиллиметровой матрицы Атакамы . Многомерная твердотельная ЯМР-спектроскопия выявила функциональные группы в нерастворимом органическом веществе углеродсодержащих хондритов , которые могут быть продуктами полимеризации формальдегида. Внеземной формальдегид обсуждается как возможный источник органических соединений, которые привели к возникновению жизни на Земле.
Производство
В настоящее время крупномасштабное производство формальдегида происходит почти исключительно с использованием двух установленных технологических принципов, оба из которых основаны на исходном метаноле и были модифицированы по-разному в зависимости от производителя: окислительное дегидрирование и окисление метанола.
В 1970 - х и 1980 - х годах, формальдегид был произведен в США через радикальное окисление из пропана и бутана (С3 / С4 вырезания). Некоторое время , особенно в Японии, формальдегид производился окислением диметилового эфира . Из-за неудовлетворительной селективности и высоких производственных затрат эти два процесса не смогли оправдать себя в долгосрочной перспективе и больше не выполняются сегодня. Мировое годовое производство формальдегида в 2019 году составило около 21 миллиона тонн (на основе 100% формальдегида). Самыми крупными производственными регионами были Азиатско-Тихоокеанский регион , за которым следуют Европейский Союз и США . Производство формальдегида обычно происходит в непосредственной близости от промышленного потребителя, поскольку при транспортировке на большие расстояния могут возникнуть проблемы со стабильностью. Товар обычно доходит до потребителей по трубопроводной сети. Мировая торговля формальдегидом невелика по сравнению с объемом производства. Крупнейшие производители в 2017 году включали Dynea Chemicals , Perstorp , Georgia-Pacific , Celanese , Ercros , BASF и многие другие.
Окисление метанола (процесс Formox)
Первый принцип процесса основан на простой реакции окисления. Метанол затем воздух кислород при температурах 350-450 ° С без давления на железе (III) , оксид - и молибден (VI) , оксид - катализаторы в реакторах кожухотрубных преобразуются в формальдегид.
Превращение происходит в газовой фазе и при большом избытке атмосферного кислорода. Значительная теплота реакции (H R = -159 кДж · моль -1 ) в рассеиваются с помощью из охлаждающих жидкостей , такие как расплавленная соль , вода под давлением или масла, которые текут вокруг трубы, и используется для генерации перегретого пара высокого давления . Катализатор расположен в реакторе в виде неподвижного слоя . Каталитически активным соединением является молибдат железа (III) [Fe 2 (MoO 4 ) 3 ], который образуется из предшественника катализатора во время реакции. Он действует как переносчик кислорода и окисляет образующийся водород до воды . Восстановленный катализатор регенерируют одновременно с кислородом воздуха. Таким образом достигается срок службы катализатора около двух лет. Единственная крупная побочная реакция, которая происходит, - это полное окисление (сгорание) формальдегида до диоксида углерода и воды. Конверсии метанола составляет около 95-99% , а селективность формальдегида достигает 91-94%. Доминирующий метод в настоящее время окисления метанола из Персторпа разработан и Reichhold и используется в качестве процесса Formox (от формы альдегида с помощью вола указано idation).
С помощью процесса Formox можно легко производить мочевино-формальдегидные концентраты, но водный раствор формальдегида в процессе получения серебра имеет более высокое качество из-за более низкого содержания муравьиной кислоты.
Окислительное дегидрирование метанола
Второй процесс относится к окислительному дегидрированию метанола, также известному как процесс серебряного или серебряного катализатора. На первом этапе метанол дегидрируют до формальдегида на металлических серебряных катализаторах при температурах 600–720 ° C.
Серебряный катализатор размещается в реакторе в виде неподвижного слоя , в основном в виде кристаллов , сеток или пропитанного карбидом кремния . Реакция дегидрирования является эндотермической реакцией (ΔH R = +84 кДж · моль -1 ), и ей способствует повышенная температура.
На вторичной стадии произведенный водород сжигается с кислородом воздуха в экзотермической реакции (ΔH R = –243 кДж · моль -1 ) с образованием воды.
Окисления контролируются с помощью добавленного количества кислорода для того , чтобы достичь в адиабатический режиме работы. Срок службы каталитического нейтрализатора 2-4 месяца. В результате катализатор приходится менять значительно чаще, чем при использовании процесса Formox . С другой стороны, серебряный катализатор может быть очень легко электролитически регенерирован без потери материала.
Из-за быстрого термического разложения и дальнейшего окисления формальдегида до муравьиной кислоты необходимо соблюдать чрезвычайно короткое время пребывания (менее 0,01 с). По этой причине предпочтительны сетчатые катализаторы, которые обеспечивают короткое время контакта с тонким слоем катализатора и быстрое охлаждение за 0,1-0,3 с примерно до 150 ° C. Кроме того, из-за низкой потери давления при использовании таких катализаторов могут быть достигнуты очень высокие скорости потока , что обеспечивает эффективное рассеивание тепла.
Существуют варианты процесса согласно BASF , Bayer , Borden, Celanese , Degussa , DuPont , ICI и Mitsubishi , которые различаются типом катализатора, температурой реакции и обработкой формальдегида.
Три распространенных типа процесса с использованием серебряного катализатора - это процесс BASF с впрыском воды и почти полной конверсией, неполная конверсия с последующей дистилляцией в соответствии с процессом ICI и процесс рециркуляции газа, используемый в основном в Китае.
Согласно варианту процесса BASF метанол и вода смешиваются с воздухом и через испаритель (1) подают в реактор (2 ) . Серебряный катализатор расположен в нем в виде неподвижного слоя (например, сеток, кристаллов), а температура поддерживается на уровне 680-720 ° C. После завершения реакции, горячие реакционные газы в газовом охладителе (3) быстро охлаждают до 150 ° С Это делается косвенно через систему теплообменника, которая подключена как к испарителю, так и к реактору. Охлаждение происходит водой. Оптимальное управление реакцией позволяет производить около 70 кг водяного пара на тонну формальдегида , который можно использовать внутри завода или в сети завода . Затем охлажденные реакционные газы проходят в две абсорбционные колонны (4) и (5), в которых формальдегид вымывается противотоком с водой или циркулирующим раствором формальдегида. Получают 44% -ный водный раствор формальдегида. Выхлопные газы из второй абсорбционной колонны либо сжигаются напрямую (выработка энергии), либо часть из них возвращается в испаритель.
Выход в этом процессе составляет от 86,5 до 90,5 мол.%. Водный раствор формальдегида все еще содержит 1-2 мас.% Метанола и 0,01 мас.% Муравьиной кислоты, но это не проблема качества, и с ним обычно обращаются как с товарным продуктом.
Окисление продуктов парового крекинга
Формальдегид можно получить окислением продуктов парового крекинга. Отрезок C3, содержащий молекулы с тремя атомами углерода, такие как пропан и пропен , и фрагмент C4, содержащий молекулы с четырьмя атомами углерода, такие как бутан , бутен и бутадиен , окисляются. Окисление фракции C3 / C4 можно проводить с катализатором или без него. Формальдегид получается в дополнение к другим кислородсодержащим компонентам, таким как метанол, ацетальдегид , уксусная кислота и ацетон . Во избежание взрывов этот процесс необходимо проводить либо при большом избытке воздуха, либо при избытке углеводородов. Пар - еще один подходящий разбавитель. Чтобы избежать вторичных реакций, реакционную смесь необходимо быстро охладить до температуры ниже примерно 150 ° C. Это делается закачкой закачанной водой.
В целом реакции являются экзотермическими - соответствующую горячую газовую смесь необходимо быстро охладить, чтобы избежать побочных реакций. Образующийся газообразный формальдегид затем экстрагируется в газоочистителях с использованием воды или раствора мочевины , водного раствора формальдегида или производимого мочевино-формальдегидного концентрата . Помимо непрореагировавшего метанола, полученные растворы также содержат небольшие количества (около 100–300 ppm) муравьиной кислоты (HCOOH).
характеристики
Физические свойства
Формальдегид - это бесцветное вещество с резким запахом, газообразное при комнатной температуре . Как газ, его запах все еще ощущается при концентрациях 0,05–1 мл / м 3 . Кипит при −19 ° C. Плотность жидкого формальдегида составляет 0,815 грамма на кубический сантиметр (г · см -3 ) при -20 ° C. Температура плавления −118 ° C.
Жидкий и газообразный формальдегид легко полимеризуется до температуры 80 ° C, при более высоких температурах он является мономерным. Скорость полимеризации зависит от многих факторов, таких как давление или влажность, и катализируется следами кислоты. Формальдегид легко воспламеняется и воспламеняется при температуре 430 ° C. Образует с воздухом взрывоопасные смеси в широком диапазоне концентраций. Диапазон взрываемости составляет от 7% по объему (87 г / м 3 ) в качестве нижнего предела взрываемости (НПВ) до 73% по объему (910 г / м 3 ) в качестве верхнего предела взрываемости (ВПВ).
Дипольный момент формальдегида 2,330 Дебай (Д), энергия образования -104,7 кДж на моль (кДж моль -1 ). Критическая температура составляет 134,85 ° С, критическое давление 65,9 бар .
Кристаллическая структура формальдегида определ ли при температуре 15 градусов Кельвина по нейтронной дифрактометрии . Формальдегид кристаллизуется в тетрагональной кристаллической системе с пространственной группой P 4 2 1 c с восемью молекулами на элементарную ячейку. Молекулы расположены в четырехчленных квадратах с прочными связями CO, которые соединяют элементы квадрата.
Молекулярные свойства
Электронная плотность в кислороде формальдегида на занятой π-орбитали, ВЗМО , значительно увеличена по сравнению с углеродом. С другой стороны, орбитали на незанятой π * -орбитали, НСМО, больше у углерода, поэтому формальдегид является хорошим электрофилом . В реакциях формальдегида с сильными нуклеофилами, такими как тиолы , амины или амиды , кислотный катализ часто не требуется. Образующиеся гидроксиметилпроизводные обычно вступают в дальнейшую реакцию. В присутствии кислот он реагирует в реакциях электрофильного ароматического замещения с ароматическими соединениями, которые приводят к гидроксиметилированным производным.
Формальдегид - это плоская молекула с осью вращения и двумя взаимно перпендикулярными зеркальными плоскостями, которую Артур Мориц Шёнфлис назвал C 2v -симметричной. Длина связи C = O составляет 120 пикометров , длина связи CH - 110 пикометров. Угол HCH составляет 116,16 °, угол HCO соответственно 121,92 °.
Волновое число СН растяжения вибрации 2782, что из C = O растяжение вибрации 1746 см -1 . Волновое число изгибного колебания CH 2 составляет 1500 см -1 .
Химические свойства
Формальдегид реагирует с самим собой и с другими реагентами в ряде синтезов с образованием различных продуктов. Среди этих реакций - реакции окисления-восстановления, реакции присоединения или конденсации с органическими и неорганическими веществами и реакции самополимеризации.
Окислительно-восстановительные реакции
В присутствии оснований формальдегид диспропорционирует с образованием формиата и метанола в реакции Канниццаро .
Формальдегид реагирует с альдегидами без водорода в α-положении к карбонильной группе в перекрестной реакции Канниццаро с образованием спирта и формиата.
В образце Толленса формальдегид реагирует с растворимым комплексом диамминсеребра (I) ([Ag (NH 3 ) 2 ] + ) в щелочном растворе с образованием муравьиной кислоты, серебра и аммиака. Эта реакция является общей реакцией обнаружения альдегидов.
Реакции присоединения и конденсации
Как простейший альдегид, формальдегид занимает особое положение в своем химическом поведении, поскольку альдегидная группа связана только с водородом. Некоторые из типичных альдегидных реакций являются нормальными, например, синтез циангидрина в гликолонитрил .
С другой стороны, с аммиаком образуется не имин , а гексаметилентетрамин .
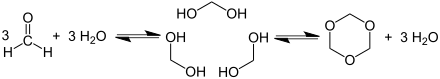
Формальдегид хорошо растворяется в этаноле , диэтиловом эфире и воде. Гидрат альдегида (метандиол) образуется в водном растворе , благодаря чему эта реакция является равновесной - в отличие от z. Б. Этаналь - почти 100% на стороне гидрата. Гидрат имеет слабокислотную реакцию (pK s 13,3).
Формальдегид вступает в ряд других реакций конденсации с широким спектром реагентов, таких как сульфометилирование или реакция Манниха . Реакция Манниха представляет собой аминоалкилирование CH-кислотного соединения формальдегидом и первичным или вторичным амином или аммиаком . Продукт представляет собой β-амино-карбонильное соединение, известное как основание Манниха.
Нитрометан реагирует в реакции Генри в избытке формальдегида с образованием 2-нитро-1,3-дигидрокси-2-гидроксиметилпропана . Основные соединения, такие как амины, катализируют реакцию.
Формальдегид реагирует с бензолом и хлористым водородом в реакции Бланка , катализируемой хлоридом цинка или другими кислотами Льюиса , с образованием хлорметиларенов.
Формальдегид реагирует с карбонилгидридом кобальта по реакции, аналогичной гидроформилированию .
Путем введения моноксида углерода в связь кобальт-углерод образуется ацильный комплекс, который реагирует с другим эквивалентом карбонилгидрида кобальта с образованием гликолевого альдегида и октакарбонила дикобальта .
В 1960-х годах в результате реакции формальдегида, окиси углерода, воды и серной кислоты образовалась гликолевая кислота. Этерификация метанолом и последующее гидрирование дали этиленгликоль . Годовое производство с использованием этого процесса составляло около 60 000 тонн в год в середине 1960-х годов, но было прекращено в 1968 году по соображениям экономии.
В перекрестных альдольных реакциях формальдегид действует как акцептор енолятного аниона. Формальдегид реагирует с ацетоном с образованием 4-гидрокси-2-бутанона . Формальдегид реагирует с соединениями Гриньяра с образованием спиртов после гидролиза.
Формальдегид реагирует с одним или двумя эквивалентами спирта с образованием полу- или полных ацеталей .
Реакции самополимеризации
В формозной реакции сахара образуются в результате самоконденсации формальдегида. Основания двухвалентных металлов, таких как гидроксид кальция или гидроксид бария, катализируют эту реакцию. Рональд Бреслоу предложил каталитический цикл в 1959 году. Последовательность реакций включает альдольные реакции , ретроальдольные реакции и перегруппировки Лобри-де-Брюна-Альберда-ван-Экенштейна с образованием промежуточных продуктов, таких как гликолевый альдегид , глицеральдегид , дигидроксиацетон и тетрозы . Термин формоса - это основное слово, состоящее из форм альдегид и альдоза.
Формальдегид легко полимеризуется в присутствии следов кислоты с образованием полиоксиметиленов или тримеризуется с образованием триоксана . Реакция обратима: при более высоких температурах полимеры и олигомеры снова распадаются на формальдегид.
использовать
Формальдегид является одним из важнейших органических сырьевых материалов в химической промышленности и используется в качестве сырья для многих других химических соединений. Безусловно, самый большой рынок находится в области карбамидоформальдегидных смол, фенопластов, полиоксиметиленов и ряда других химических промежуточных продуктов, таких как пентаэритрит . Формальдегид используется, среди прочего, в производстве красок , фармацевтических препаратов и в отделке текстиля . Поскольку формальдегид, как и все альдегиды, является сильным восстановителем , он используется для уничтожения микробов. В лаборатории используют формальдегид, среди прочего, как часть реакции Манниха и реакции Blanc .
Производство полимеров
Аминопласты
С мочевиной формальдегид реагирует на карбамидоформальдегидные смолы (UF-смолы U REA F , с ормальдегидом), меламин на меламино-формальдегидные смолы (MF-смолы), включая аминопласты . На первом этапе производятся монометилолмочевина и диметилолмочевина:
Дальнейшая конденсация приводит к образованию цепочечных полимеров, которые необязательно могут быть сшиты. Смолы на основе карбамидоформальдегида являются наиболее важными типами клеящих смол для производства материалов на основе древесины, таких как ДСП, ДВП и фанера из твердой древесины. Отсутствие водостойкости отвержденной смолы из-за обратимости аминометиленовой связи можно исправить путем добавления таких веществ, как меламин .
До сих пор самая большая область применения формальдегида является производством карбамидо-формальдегидных смол, которые используются в качестве связующих для неструктурных древесных материалов , таких как древесно - стружечных плит и средней плотности ДВП (MDF).
Меламиноформальдегидные смолы используются в качестве пропиточных смол с повышенными требованиями к влагостойкости, например, для нанесения декоративной бумаги на ламинатные полы или в качестве компонента бамбуковой посуды . Смолы MF в виде прозрачных лаков используются в автомобильной промышленности.
Соединения N-метилола из формальдегида и мочевины, такие как метилолмочевина, которые образуют аминопласты в волокне в результате дальнейшей конденсации, используются в качестве вспомогательных текстильных веществ в целлюлозных волокнах, таких как хлопковые волокна или вискозные волокна . Они служат для улучшения свойств смятия и усадки и, таким образом, повышения стабильности размеров текстильных изделий. Поликонденсация соединений N-метилола обычно происходит в кислой среде при повышенной температуре. Во время конденсации в определенной степени образуется формальдегид. Количество сохраняемых аминопластов составляет около 8% от веса ткани. С точки зрения здоровья, при отделке текстильных изделий необходимо соблюдать небольшое количество свободного и высвобождаемого формальдегида. Текстильные изделия, контактирующие с кожей при использовании по назначению и содержащие более 0,15% свободного формальдегида, должны иметь соответствующую маркировку.
Фенопласты
Фенол-формальдегидные смолы (PF) или фенопласты представляют собой синтетические полимеры , полученные по реакции конденсации из фенола или фенола , замещенного с формальдегидом. В зависимости от того, является ли конденсация кислотной или основной, образуются новолаки или резолы . Новолаки - это низкомолекулярные полимеры, которые получают кислотно-катализируемой конденсацией формальдегида со смесью крезолов . Новолаки используются как фоторезистивные материалы в микроэлектронике.
Резолы - это продукты реакции фенолформальдегидной конденсации, катализируемой основанием. Они сделаны с избытком формальдегида по отношению к фенолу. Реактивные частицы представляют собой фенаты , которые образуются при депротонировании фенола. Будучи термореактивными , гидроксиметилфенолы образуют поперечные связи при нагревании примерно до 120 ° C, образуя метиленовые и метиленовые эфирные мостики с удалением воды. Высокая степень сшивки на уровнях Resitol и Resit придает Resoles твердость, термическую стабильность и химическую стойкость.
Фенолформальдегидные смолы добавляют к гексаметилентетрамину в качестве отверждающего компонента. Его производят в промышленных масштабах путем взаимодействия шести эквивалентов формальдегида с четырьмя эквивалентами аммиака.
Совместная конденсация фенола, фенолсульфоновой кислоты и формальдегида создает катиониты . Эти сетчатые полимеры имеют прочно связанные анионные сульфатные группы, а также свободно движущиеся катионы.
Полиоксиметилен
Полиоксиметилен - это термопласт, используемый в прецизионных деталях, требующих низкого трения и высокой стабильности размеров. Полиоксиметилен отличается высокой прочностью , твердостью и жесткостью . Из-за высокой кристалличности он бесцветный, непрозрачный белый. В автомобильной и электронной промышленности литье под давлением используется для изготовления технических компонентов, таких как шестерни, шарикоподшипники и крепежные детали.
Производство пентаэритрита
Пентаэритритол получают посредством реакции полиприсоединения, катализируемой основанием, между ацетальдегидом и тремя эквивалентами формальдегида. Промежуточный продукт реагирует в перекрестной реакции Канниццаро с четвертым эквивалентом формальдегида с образованием пентаэритрита.
Он в основном используется для изготовления полифункциональных соединений и может быть найден в пластмассах, красках, косметике и многих других областях. Он также используется для производства взрывчатых веществ, таких как нитропента и тринитрат пентаэритрита .
Метилендифенилизоцианат
Первым этапом производства метилендифенилизоцианатов (МДИ) является реакция анилина и формальдегида с использованием соляной кислоты в качестве катализатора.
Получают смесь предшественников диаминов и соответствующих полиаминов. В 2018 году мировое производство метилендифенилизоцианатов составило около 9,8 млн тонн, для чего требовалось около 1,2 млн тонн формальдегида. Производство метилендифенилизоцианатов - быстрорастущий рынок формальдегида. Основные области применения - пенополиуретан , краски , клеи , эластомеры и герметики, которые используются в строительстве , бытовой технике, обуви и других товарах народного потребления, а также в автомобильной промышленности.
1,4-бутандиол
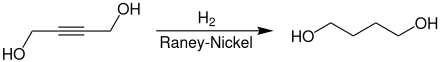
Промышленный синтез 1,4-бутандиола происходит по реакции ацетилена с двумя эквивалентами формальдегида.
2-бутин-1,4-диол, образующийся на первой стадии, дает 1,4-бутандиол путем гидрирования.
1,4-Бутандиол используется в качестве растворителя и в производстве пластмасс, эластичных волокон и полиуретанов. При более высоких температурах в присутствии фосфорной кислоты он циклизуется с отщеплением воды до тетрагидрофурана , важного вторичного продукта.
Выделители формальдегида
Формальдегид используется в качестве биоцидного активного ингредиента, особенно в косметических продуктах, в основном в форме высвобождающего формальдегид агента . Это продукты конденсации формальдегида, такого как диазолидинилмочевина, или диолов, таких как бронопол , которые медленно выделяют формальдегид. Таким образом, можно очень точно установить концентрацию свободного формальдегида, которая будет практически постоянной в течение всего срока службы продукта. Поскольку депо активных ингредиентов израсходовано даже без заражения микробами, продукты, сохраненные таким образом, имеют ограниченный срок хранения. Непосредственно добавленный формальдегид будет все больше и больше истощаться в результате процессов диффузии и разложения, так что для достижения сопоставимого срока хранения придется использовать относительно высокие дозировки.
С 2019 года прямое использование формальдегида в косметических продуктах запрещено. Остается только использовать высвобождающие формальдегид, если этот активный ингредиент важен. Приложение V к Регламенту ЕС по косметике содержит правила использования биоцидов в косметических продуктах в Европейском Союзе. Если концентрация свободного формальдегида в косметическом продукте превышает 0,05%, даже если это было выделено средствами, выделяющими формальдегид, это должно быть заявлено в форме заявления «Содержит формальдегид».
Мертвые вакцины
Формальдегид используется в производстве вакцин для инактивации вакцинных вирусов (например, полиовируса ) или бактериальных токсинов (например, дифтерийного токсина , столбнячного токсина или коклюшного токсина ). После очистки готовый вакцинный препарат может содержать максимум 200 мг (вакцины для человека) или 500 мг (вакцины для животных) формальдегида на литр. В случае вакцин для человека это соответствует максимальной концентрации 0,2 мг / мл или 0,02%. Обычно вводится 1–200 мкг на вакцину. Количество однократной вакцинации людей примерно в 600 раз меньше, чем количество, которое может вызвать токсичность в исследованиях на животных. Поскольку количество формальдегида в любом случае часто ниже максимально допустимого, а концентрация 1% обычно используется для патч-теста на формальдегид для тестирования аллергии, количество формальдегида в любой вакцине не может вызвать какие-либо кожные реакции - даже если он находится непосредственно в или будет наноситься на кожу. В крови циркулирует примерно в 10 раз больше формальдегида, чем при вакцинации. Количество содержащегося формальдегида настолько мало, что физиологическое содержание формальдегида в мышцах уменьшается даже при вакцинации. Следовательно, после вакцинации риск образования формальдегида отсутствует.
Сохранение анатомических и биологических образцов
4-8-процентный раствор формальдегида используется в качестве обычного фиксатора в гистотехнологии . Формальдегид представляет собой сшивающую белок добавку-фиксатор, останавливает автолиз и гниение образцов тканей и делает их долговечными. Практическое правило - скорость проникновения 1 мм / ч. Скорость сшивки значительно ниже, чем первичное накопление формальдегида, для адекватной фиксации требуется не менее 2–3 дней. При этом образуются метиленовые мостики и мостики над основаниями Шиффа. Связь может быть отменена промыванием водой или действием горячих буферных растворов с разными значениями pH (поиск антигена). Метиленовые мостики должны быть стабильными. Сшивание и модификация биомолекул формальдегидом может быть обращена нагреванием и / или добавлением оснований .
Такой раствор формальдегида также используется для консервации трупов и для сохранения анатомических и биологических образцов, таких как насекомые, впервые предложенный в 1893 году Исааком Блюмом . Поскольку вставленный таким образом материал долговечен в течение многих лет, его можно легко использовать в качестве иллюстративного или сравнительного материала в медицине и биологии для исследовательских и учебных целей. Британский художник Дэмиен Херст сохранил на акулу как произведение искусства в формальдегиде для художественных целей .
Несмотря на опасность для здоровья, формальдегид по-прежнему в значительной степени незаменим для сохранения и сохранения тканей, особенно из-за его общих антисептических свойств, но техническая перестройка рабочих зон для соответствия предельным значениям рабочего места , например, всасывание непосредственно в рабочей зоне а снижение концентрации формальдегида в консервирующих растворах - обязательная центральная тема современной анатомии и патологии .
Дезинфекция и стерилизация
Формальдегид используется различными способами для дезинфекции и стерилизации . Для дезинфекции помещения формальдегид наносят в газообразном виде или в водном растворе на все поверхности в помещении. В дополнение к испарению формальдегид можно распылять или использовать вещества, выделяющие формальдегид. Кроме того, дезинфекцию можно проводить протиранием средствами, содержащими формальдегид. Формальдегид адсорбируется поверхностями, и после обработки его необходимо тщательно удалить путем ополаскивания. Мелкие детали, используемые в медицине, можно окурить в формальдегидных стерилизаторах.
В интенсивном животноводстве формальдегид используется в качестве фумиганта для предотвращения инфекционных заболеваний, вызываемых вирусами или бактериями. Например, при выращивании и откорме цыплят фумигация обычно проводится перед каждым новым зарыблением стойл.
Экологические аспекты
Формальдегид не накапливается в окружающей среде, потому что он расщепляется солнечным светом или бактериями, присутствующими в почве или воде. Большинство организмов быстро метаболизируют формальдегид и превращают его в муравьиную кислоту, так что он не накапливается в биоаккумуляторе .
Источники выбросов
внутри комнат
Некоторые материалы, содержащие формальдегид, в том числе древесные материалы, напольные покрытия, мебель и текстиль, могут загрязнять воздух, которым мы дышим в закрытых помещениях, из- за выделения газов . В 80-х годах прошлого века ДСП и, в частности , фанера , для производства которых использовались аминопласты в качестве связующих, попали под подозрение в этом контексте . С одной стороны, однако, сегодня в продаже имеется множество не содержащих формальдегид материалов на основе древесины и мебели. С другой стороны, выбросы древесных материалов на основе формальдегида были значительно сокращены. Восстановление зданий, загрязненных формальдегидом, по-прежнему остается большой проблемой, особенно в старых сборных деревянных домах.
Сама древесина выделяет формальдегид в результате термического разложения полисахаридов . Значения выбросов зависят от типа древесины, содержания влаги, температуры и времени хранения древесины. Свежий дуб выделяет около 430 мкг, сухой дуб - около 50 мкг формальдегида на квадратный метр в час.
При курении неполное сгорание образует формальдегид, который в значительной степени способствует загрязнению воздуха в помещении. Общий дым одной сигареты содержит около 0,02–0,1 мг формальдегида.
среда
Процессы неполного сгорания являются важным источником выбросов формальдегида. Их можно найти, например, в двигателях внутреннего сгорания автомобилей, в литейных цехах и при производстве пластмассовых изделий. Когда в газовых двигателях сжигаются биологические, сточные и свалочные газы, в выхлопных газах часто обнаруживаются высокие концентрации формальдегида. Последующая обработка выхлопных газов обычно необходима, чтобы значения выбросов не превышали установленных законом предельных значений.
Сжигание древесины в небольших системах сжигания проблематично, поскольку сжигание часто бывает неполным из-за неравномерной загрузки или сырости древесины . В этих внутренних системах концентрация формальдегида составляет 50–100 мг · м –3 , что в сумме дает общие выбросы около 1000 тонн в год для старых федеральных земель (оценка на 1980 год). У гораздо более производительных и экологически чистых крупных промышленных установок сжигания топливного газа , нефти и угля общий объем выбросов в 1980 году составлял всего 50 тонн в год. В целях противодействия загрязнению воздуха дымоходными печами и другими небольшими системами сжигания, федеральное правительство в постановлении о малых и средних системах сжигания от 26 января 2010 г. разрешило использовать только натуральную древесину, хранившуюся в течение достаточно длительного периода. для горения.
Измерение выбросов
Различные способы могут быть использованы для измерения выбросов . В методе MBTH полностью определяются алифатические альдегиды с короткой цепью, включая формальдегид. Для определения частичный поток отработанного выхлопного газа вводят в реакцию с 3-метил-2-бензотиазолинонгидразоном (MBTH). Это создает катион цианина тетраазапентаметина синего цвета, который можно измерить фотометрически .
Чтобы использовать процесс DNPH , выхлопной газ, содержащий альдегиды и кетоны, реагирует с 2,4-динитрофенилгидразином (DNPH). Это можно сделать либо в абсорбирующем растворе, либо на адсорбенте . Затем полученные 2,4-динитрофенилгидразоны можно определить индивидуально с помощью высокоэффективной жидкостной хроматографии и УФ-детекции. Если метенамин (уротропин) содержится в отбираемых выхлопных газах, как метод DNPH, так и метод MBTH приводят к улучшенным результатам из-за перекрестной чувствительности . В этом случае рекомендуется процедура AHMT . Если, помимо формальдегида, в выхлопном газе есть подозрение , что акролеин и ацетальдегид, можно использовать процесс 2-HMP , в котором альдегиды, содержащиеся в выхлопном газе, реагируют с 2- (гидроксиметил) пиперидином (2-HMP) и продукты реакции затем анализируют с помощью газовой хроматографии . Ацетилацетоновый процесс можно использовать для выхлопных газов с высоким содержанием воды .
Содержание формальдегида в выхлопных газах двигателей внутреннего сгорания определяется с помощью автоматизированного процесса FTIR . Отбираемый отработавший газ проходит через измерительную ячейку, освещаемую инфракрасным излучением. Ослабление определенных длин волн дает информацию о составе выхлопных газов.
токсикология
В 2012 году формальдегид был включен в текущий план действий ЕС ( CoRAP ) в соответствии с Регламентом (ЕС) № 1907/2006 (REACH) в рамках оценки вещества . Воздействие вещества на здоровье человека и окружающую среду повторно оценивается и, при необходимости, принимаются последующие меры. Поглощение формальдегида было вызвано опасениями по поводу его классификации в качестве вещества CMR , воздействия на рабочих , высокого (совокупного) тоннажа и широкого использования. Переоценка проводилась с 2013 года во Франции . Затем был опубликован окончательный отчет.
Острая токсичность
При неправильном использовании формальдегид может вызвать аллергию , раздражение кожи, дыхательных путей или глаз. При концентрации 30 мл / м³ существует острая опасность для жизни (токсический отек легких , пневмония ). В случае хронического воздействия он является канцерогенным, а также влияет на память, способность концентрироваться и спать.
Большинство отравлений происходит не в результате прямого контакта с формальдегидом, а в результате употребления метанола в некачественных алкогольных напитках. Метанол в организме сначала превращается в формальдегид алкогольдегидрогеназой, а затем быстро в муравьиную кислоту альдегиддегидрогеназами . Он медленно метаболизируется и может привести к ацидозу . Сам формальдегид особенно легко денатурирует белки сетчатки , что может привести к слепоте. Добавление формальдегида вызвало различные пищевые скандалы. Зараженные продукты включали макароны, соленую рыбу, тофу, курицу, фрукты и овощи, такие как капуста.
Существует множество лечебных мероприятий от интоксикации формальдегидом. В случае перорального приема рекомендуется прием активированного угля (но не молока, которое увеличивает скорость всасывания ). Ацидоз лечится настоем гидрокарбоната натрия. Дальнейшая терапия может проводиться путем введения седативных средств от кашля , ингаляционных β- симпатомиметиков или ингаляционных глюкокортикоидов . Пары аммиака нейтрализуют действие паров формалина с образованием гексаметилентетраамина .
Канцерогенный риск
Формальдегид является юридически обязательным с 1 апреля 2015 года в Приложении VI Регламента 2008/1272 / EC о классификации, маркировке и упаковке веществ и смесей категории 1B: «вероятно, канцерогенные для человека». В экспериментах на животных с крысами было показано , что формальдегид оказывает канцерогенное действие, но только при высоких концентрациях 6 мл / м 3 или более . В 2004 году Международное агентство по изучению рака (IARC) Всемирной организации здравоохранения изменило классификацию формальдегида, существовавшую с 1995 года, с «предполагаемого канцерогенного эффекта» на «канцерогенный для человека». Вещества, классифицируемые как канцерогенные , мутагенные или токсичные для репродукции («вещества CMR»), считаются особенно опасными и должны быть заменены менее опасными веществами. В основе классификации ВОЗ лежит эпидемиологическое исследование, которое показало повышенный уровень смертности от опухолей носоглотки у рабочих, которые подвергались воздействию формальдегида в промышленности в течение нескольких лет.
Исследование ВОЗ побудило Федеральный институт оценки риска (BfR) пересмотреть риск возникновения рака, связанный с формальдегидом. С 2006 года, основываясь на результатах собственного исследования , BfR считает, что канцерогенные эффекты формальдегида должны быть надлежащим образом задокументированы при его всасывании через дыхание. Эффект зависит от концентрации:
«При содержании в воздухе в помещении 124 микрограммов формальдегида на кубический метр или ниже, канцерогенных эффектов практически не ожидается. Если это значение многократно и значительно превышается, может возникнуть опасность для здоровья ».
Юридически обязательная классификация в категории Carc 1B вступила в силу 1 апреля 2015 года.
В США формальдегид был классифицирован во втором отчете о канцерогенных веществах в 1981 году, первоначально с подозрением на канцерогенное воздействие на человека. С июня 2011 года Министерство здравоохранения США классифицирует формальдегид как канцероген для человека, поскольку имеющиеся исследования предоставляют достаточные доказательства.
Аллерген
Для большинства людей раздражение формальдегидом носит временный и обратимый характер, но может вызвать аллергию. Формальдегид - контактный аллерген . У сенсибилизированных людей формальдегид может вызывать аллергические симптомы даже в концентрации 0,05%. В серии патч- тестов, проведенных Североамериканской группой контактного дерматита (NACDG) с участием около 4500 пациентов, было обнаружено, что формальдегид является седьмым по распространенности аллергеном, при этом 9,0% протестированных показали аллергическую реакцию. Аллергическая реакция, часто наблюдаемая при поражениях кожи, таких как язвы на коже, была в областях, которые имели прямой контакт с веществом из текстиля или косметики.
Предельные значения
Согласно регламенту CLP , дезинфицирующие средства, содержащие формальдегид, должны быть помечены символами опасности и предупреждениями, такими как «Может вызвать аллергическую кожную реакцию», «Вызывает серьезные ожоги кожи и повреждение глаз» или «Может вызвать рак». В связи с классификацией формальдегида в соответствии с правилами CLP, законодатели издали различные правила на национальном и европейском уровне о верхних пределах концентрации формальдегида и о маркировке продуктов с использованием формальдегида. Постановление о потребительских товарах регулирует маркировку моющих и чистящих средств с концентрацией от более 0,1% до 0,2% свободного формальдегида.
Запрет Постановление Химикалии запрещает размещение на рынке моющих и очищающих средств с концентрацией выше , чем 0,2% формальдегида. Согласно регламенту REACH , предельное значение формальдегида в 300 мг на килограмм применяется к одежде, обуви и текстилю, которые не контактируют с кожей человека; с 1 ноября 2023 года предельное значение будет снижено до 75 мг / кг. Европейский стандарт «Безопасность игрушек» Часть 9 (DIN EN 71-9) регулирует содержание формальдегида в игрушках.
В области текстильных изделий (одежды) предел количественного определения 16 мг / кг (16 частей на миллион) применяется к добровольным тестам на загрязняющие вещества как часть тестовой печати (например, Toxproof или Oeko-Tex 100 ). Это также предельное значение для детской одежды. Для одежды, носимой близко к коже, применяют 75 мг / кг, для других текстильных изделий - 300 мг / кг. Допустимое «предельное значение» в Германии составляет 1500 мг / кг (1500 ppm). Это не реальное предельное значение, так как необходимо только приложить примечание о том, что одежду рекомендуется постирать для лучшей переносимости кожей перед тем, как надеть ее в первый раз.
В 2016 году Комитет по стандартным значениям для помещений установил стандартное значение для воздуха в помещении 0,1 мг / м³. В строительной отрасли предельное значение формальдегида 120 мкг / м³ определено для зданий, сертифицированных в соответствии с Немецким советом по устойчивому строительству (DGNB) , и если этот предел превышен, сертификация невозможна. Также определено целевое значение 60 мкг / м³. Рабочая группа экологических исследовательских институтов e. V. (AGÖF) также выпустил ориентировочное значение для планирования 30 мкг / м³.
В марте 2015 года, дополнения к юридически обязывающих профессионального облучения предельных значений в были TRGS 900 объявлены. Было определено значение максимальной концентрации на рабочем месте 0,3 мл / м 3, соответствующей 0,37 мг / м 3 , которая была рекомендована Немецким исследовательским фондом (DFG) .
доказательство
Обнаружение свободного или расщепляемого формальдегида возможно с помощью хромотропной кислоты посредством реакции с хромотропной кислотой . Обнаружение возможно с помощью метилбензотиазолон гидразона или фуксин-серной кислоты ( реагент Шиффа ). Газообразный формальдегид также может быть обнаружен спектроскопически по его поглощению в ближнем УФ и инфракрасном спектральном диапазоне. Это позволяет измерять концентрацию формальдегида в атмосфере Земли с помощью методов дистанционного зондирования со спутников и с земли.
Европейская Фармакопея позволяет испытание предела для формальдегида ацетилацетона допускает. В процессе ацетилацетона формальдегид реагирует с ацетилацетоном в присутствии ацетата аммония в синтезе дигидропиридина по Ганцу с образованием производного 3,5-диацетил-1,4-дигидропиридина, концентрацию которого можно определить фотометрически .
Для древесных материалов существуют различные методы и стандарты количественного определения параметров, которые в конечном итоге позволяют сделать выводы о потенциале выбросов или «реальном» поведении выбросов:
- «Метод перфоратора»: Спецификация в мг формальдегида на 100 г образца, см. Перфоратор (химия).
- Метод эксикатора : «Маленькие» образцы выделяют в воду формальдегид, выраженный в мг / л.
- «Камерные методы»: образцы больших панелей исследуются на эмиссию формальдегида в испытательной камере в течение более длительного периода времени , информация для метода парарозанилина: ppm с 0,01 ppm = 0,0124 мг формальдегида на м³ воздуха в помещении = 12,4 мкг формальдегида на м³ Внутри помещения воздух, предел количественного определения 0,01 ppm
Определение выполняется в соответствии с DIN EN ISO 14184-1: 2011-12 (замена DIN 54260: 1988-029), § 64 LFGB (ранее § 35 LMBG) B 82.02-1 (свободный и высвобождаемый формальдегид) и DIN EN 717-1 (древесные материалы, выделение формальдегида в соответствии с методом испытательной камеры) или согласно DIN EN 120 (древесные материалы - определение содержания формальдегида методом перфоратора).
литература
- Люопин Чжан: формальдегид. Воздействие, токсичность и воздействие на здоровье. Королевское химическое общество, Лондон 2018, ISBN 978-1-78262-973-3 .
- Вильгельм Кейм : Пластмассы. Синтез, производственные процессы, оборудование. Wiley-VCH, Weinheim 2006, ISBN 3-527-31582-9 .
веб ссылки
![]() Wikisource: Formalin - Wikisource содержит текст статьи1911 Encyclopdia Britannica Formalin .
Wikisource: Formalin - Wikisource содержит текст статьи1911 Encyclopdia Britannica Formalin .
Индивидуальные доказательства
- ^ Рош Лексикон Медицина. 4-е издание, Urban & Schwarzenberg 1998, ISBN 3-541-17114-6 .
- ↑ б с д е е г ч запись на формальдегид в базе данных GESTIS вещества в IFA , доступ к 1 февраля 2016 года. (Требуется JavaScript)
- ^ Справочник CRC по химии и физике. 85-е издание, CRC Press, Бока-Ратон, 2004 г.
- ↑ б с Вступил по формальдегиду в классификации и маркировки Перечня в Европейское химическое агентство (ECHA), доступ к 1 февраля 2016 г. Производители или поставщики могут расширить гармонизированной системы классификации и маркировки .
- ↑ Швейцарский фонд страхования от несчастных случаев (Сува): предельные значения - текущие значения MAK и BAT (поиск 50-00-0 или формальдегид ), по состоянию на 13 сентября 2019 г.
- ↑ a b Запись о формальдегиде в базе данных ChemIDplus Национальной медицинской библиотеки США (NLM), доступ осуществлен 17 октября 2016 г.
- ↑ Дэвид Р. Лид (Ред.): Справочник по химии и физике CRC . 97-е издание. (Интернет-версия: 2016), CRC Press / Тейлор и Фрэнсис, Бока-Ратон, Флорида, Стандартные термодинамические свойства химических веществ, стр. 5-20.
- ^ A b Ларс Аксельсен: Перспективы формальдегида и влияние на спрос на метанол. Презентация на 33-й ежегодной всемирной конференции по метанолу IHS; 11-12. Ноябрь 2015 г., Мюнхен.
- ^ A b C. H. Fox, FB Johnson, J. Whiting и PP Roller: фиксация формальдегида. В: Журнал гистохимии и цитохимии . 1985, Vol. 33, No. 8, pp. 845-853.
- ↑ Рейнхард Хильдебранд: Формалин. В: Werner E. Gerabek , Bernhard D. Haage, Gundolf Keil , Wolfgang Wegner (ред.): Enzyklopädie Medizingeschichte. de Gruyter, Берлин / Нью-Йорк 2005, ISBN 3-11-015714-4 , стр. 410.
- ↑ Патент US3816539A : Способ приготовления стабилизированного раствора концентрированного водного формальдегида. Опубликовано 18 декабря 1968 г. Изобретатели: Дж. Сэнборн, У. Леммонс, Дж. Рэми.
- ↑ Патент US656061A : Процесс производства паров формальдегида. Опубликовано 24 ноября 1896 г. , изобретатель: Жан Жозеф Огюст Трилья.
- ↑ а б в Гюнтер Брюгге: Из ранней истории производства формальдегида. В кн . : Химический аппарат . 1931, с. 157-160.
- ↑ Адольф Байер: О соединениях альдегидов с фенолами и ароматическими углеводородами. В: Отчеты Немецкого химического общества . 1872, Vol. 5, No. 2, pp. 1094-1100.
- ^ Б с д е Гюнтер Рейсс, Вальтер Disteldorf, Армин Отто Игрок, Альбрехт Хильта: Формальдегид. В: Энциклопедия промышленной химии Ульмана . Wiley-VCH, Weinheim 2012, ISBN 978-3-527-32943-4 . С. 735-768.
- ^ A b Гюнтер Брюгге: Из ранней истории формальдегида и его применения. В кн . : Химическая технология . 1943 г., том 16, стр. 228-230.
- ↑ Г. Греко, У. Солдано: Новые заводы по производству формальдегида из метанола. В: Инженер-химик Технология . 1959 г., том 31.12, стр. 761-765.
- ↑ Оливер Тюрк: Материальное использование возобновляемого сырья. Springer-Verlag / Vieweg, Висбаден, 2014 г., ISBN 978-3-8348-1763-1 , стр. 130-133.
- ^ Фред Афталион: История международной химической промышленности. Фонд химического наследия, Филадельфия, ISBN 0-941901-29-7 , стр.118 .
- ^ Фред Афталион: История международной химической промышленности. Фонд химического наследия, Филадельфия, ISBN 0-941901-29-7 , стр. 149.
- ^ Фридрих Асингер : Метанол, химическое и энергетическое сырье. Akademie-Verlag, Берлин 1987, ISBN 3-05-500341-1 , стр. 5.
- ↑ М. Клар: Химические продукты из дерева методом сухой перегонки. В: Осмотритесь в науке и технике . 1938, стр. 741-742.
- ↑ Бой Корнилс, Вольфганг А. Херрманн, М. Мюлер, К. Вонг: Катализ от А до Я: Краткая энциклопедия. Wiley-VCH, 2007, ISBN 978-3-527-31438-6 , с. 27.
- ↑ Гомер Адкинс, Уэсли Р. Петерсон: Окисление метанола воздухом над оксидами железа, молибдена и железо-молибдена. В: Журнал Американского химического общества. Том 53, 1931, стр. 1512-1520, DOI: 10.1021 / ja01355a050 .
- ↑ Хорхе Прието, Юрген Кейне: Покрытие древесины. Vincentz Network, 2019, ISBN 978-3-748-60171-5 , стр.41.
- ↑ a b c Европейское агентство по безопасности пищевых продуктов: Обмен эндогенного формальдегида в организме человека по сравнению с экзогенным вкладом из пищевых источников. В: Журнал EFSA . Том 12, 2014 г., стр. 3550-3561, DOI: 10.2903 / j.efsa.2014.3550 .
- ↑ Воздействие токсинов. Второе издание. Липпинкотт Уильямс и Уилкинс, Филадельфия, Пенсильвания, 1999 г., стр. 1008.
- ↑ a b c d Урсула Видерманн-Шмидт и Вольфганг Маурер: Вспомогательные вещества и добавки к вакцинам - Медицинское значение . В: Wiener Klinische Wochenschrift . Лента 117 , нет. 15 , 1 августа 2005 г., ISSN 1613-7671 , с. 510-519 , DOI : 10.1007 / s00508-005-0405-0 .
- ↑ Педер Волкофф, Гуннар Д. Нильсен: Неканцерогенные эффекты формальдегида и актуальность для установления нормативов по воздуху в помещении. В: Environment International . Том 36, 2010, стр. 788-799.
- ↑ I. Kushch et al.: Составы, улучшенные в масс-спектрометрическом профиле выдыхаемого воздуха курильщиков по сравнению с некурящими, как определено в пилотном исследовании с использованием PTR-MS. В: Журнал исследований дыхания . 2008, PMID 21383443 .
- ↑ Т. Сарваш и др:. Определение уровня эндогенного формальдегида в крови человека и моче dimedone- 14 C радиометрического метода. В: Журнал радиоаналитической и ядерной химии . Volume 106, No. 6, 1986, pp. 357-367.
- ^ Ричард С. Хэнсон, Томас Э. Хэнсон: метанотрофные бактерии. В кн . : Микробиологические обзоры . 1996, Vol. 60, No. 2, pp. 439-471.
- ↑ Р. Пол Дженсен, Вентаи Луо, Джеймс Ф. Панкоу, Роберт М. Стронгин, Дэвид Х. Пейтон: Скрытый формальдегид в аэрозоле электронных сигарет. В: Медицинский журнал Новой Англии . Том 372, 2015, стр. 392-394, DOI: 10.1056 / NEJMc1413069 .
- ↑ BJ Vorath, D. Steffens: Безопасность и охрана здоровья при курении. Эргономические заключения № 113. Федеральный институт охраны труда, Дортмунд, 1999, ISSN 0720-1699 .
- ↑ Чуан Ван, Сяо-Фэн Хуан, Ю. и Хань, Б. О. Чжу, Лин-Янь Хэ: Источники и потенциальная фотохимическая роль формальдегида в городской атмосфере в Южном Китае. В: Журнал геофизических исследований . Атмосфера. Том 122, 2017 г., стр. 11934–11947, DOI : 10.1002 / 2017JD027266 .
- ↑ DJ Luecken, SL Napelenok, M. Strum, R. Scheffe, S. Phillips: Чувствительность атмосферного формальдегида и озона к прекурсорам и типам источников в США. В: Наука об окружающей среде и технологии . Том 52, 2018, стр. 4668-4675, DOI : 10.1021 / acs.est.7b05509 .
- ^ Сэмюэл Г. Томас, Уильям А. Гиллори: Фотохимия конденсированной фазы формальдегида. В: Журнал физической химии . Том 77, 1973, стр. 2469-2472, DOI : 10.1021 / j100639a021 .
- ↑ Дональд Дж. Вуэбблс, Кэтрин Хейхо: Атмосферный метан и глобальные изменения. В: Обзоры наук о Земле . Том 57, № 3, 2002 г., стр. 177-210.
- ^ Э. Петерс, Ф. Виттрок, К. Гросманн, У. Фрис, А. Рихтер, Дж. П. Берроуз: Формальдегид и диоксид азота над удаленной западной частью Тихого океана: проверка SCIAMACHY и GOME-2. В: Дискуссии по химии и физике атмосферы . Том 12, 2012 г., стр. 15977, DOI : 10.5194 / acpd-12-15977-2012 .
- ↑ Джозеф П. Пинто, Дж. Рэндалл Гладстон, Юк Лин Юнг: Фотохимическое производство формальдегида в примитивной атмосфере Земли. В кн . : Наука . 1980, стр. 183-185, DOI: 10.1126 / science.210.4466.183 .
- ↑ Бенджамин Цукерман , Д. Буль, П. Палмер, Л. Е. Снайдер: Наблюдения межзвездного формальдегида. В: Астрофизический журнал . 1970, т. 160, стр. 485-506.
- ↑ JG Mangum, J. Darling, KM Menten, C. Henkel: Формальдегидная денситометрия галактик со вспышками звездообразования. В: Астрофизический журнал . 2008 г., том 673, стр. 832-846.
- ↑ К. Хенкель, Р. Гюнстен, Ф. Ф. Гарднер: отношения [ 12 C] / [ 13 C] из формальдегида во внутреннем галактическом диске. В кн . : Астрономия и астрофизика . 1985, Vol. 143, pp. 148-152.
- ↑ Маркус Шухманн и др.: СНО-несущие молекулы в комете 67P / Чурюмов-Герасименко. В кн . : АСУ Земли и космической химии . Том 3, 2019 г., стр. 1854–1861, DOI: 10.1021 / acsearthspacechem.9b00094 .
- ↑ Э. Зубрицкий, Н. Нил-Джонс: РЕЛИЗ 14-038 - Трехмерное исследование комет, проведенное НАСА, показывает, что химический завод работает .
- ↑ MA Cordiner et al.: Картирование высвобождения летучих веществ во внутренней коме комет C / 2012 F6 (Lemmon) И C / 2012 S1 (Ison) с использованием большого массива миллиметров / субмиллиметров Atacama. В: Астрофизический журнал . . Объем 792, 2014, стр L2, DOI : 10,1088 / 2041-8205 / 792/1 / L2 .
- ↑ Г. Д. Коди, Э. Хейинг, С. М. Александер, Л. Р. Ниттлер, А. Л. Килкойн, С. А. Сэндфорд, Р. М. Страуд: Установление взаимосвязи между молекулярными хондритовыми и кометными органическими твердыми телами. В: Известия Национальной академии наук . Том 108, номер 48, ноябрь 2011 г., стр. 19171-19176, DOI : 10.1073 / pnas.1015913108 , PMID 21464292 , PMC 3228457 (полный текст).
- ^ Люопин Чжан: Введение в формальдегид. В: Формальдегид: воздействие, токсичность и влияние на здоровье. Королевское химическое общество, 2018, ISBN 978-1-78262-973-3 , стр. 1-19.
- ↑ a b c d e f g h Ханс-Юрген Арпе : Промышленная органическая химия. Важные предварительные и промежуточные продукты . 6-е издание. Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31540-6 , стр. 41-43 .
- ↑ a b Формальдегиды превышают 52 миллиона тонн.
- ↑ Манфред Бернс , Арно Бер , Аксель Брем, Юрген Гмелинг , Кай-Олаф Хинрихсен, Ханс Хофманн , Регина Палковиц, Ульферт Онкен, Альберт Ренкен: Technische Chemie . 2-е издание. Wiley-VC, Weinheim 2013, ISBN 978-3-527-33072-0 , стр. 594 .
- ^ Грэм Дж. Миллар, Мэри Коллинз: Промышленное производство формальдегида с использованием поликристаллического серебряного катализатора. В: Промышленные и инженерные химические исследования. Том 56, 2017, стр. 9247-9265, DOI : 10.1021 / acs.iecr.7b02388 .
- ↑ Роланд Диттмайер, Вильгельм Кейм, Герхард Крейса, Альфред Оберхольц (ред.): Виннакер • Кюхлер: Химическая технология - процессы и продукты - промежуточные органические соединения, полимеры . 5-е издание. Лента 5 . Wiley-VCH, Weinheim 2005, ISBN 978-3-527-30770-8 .
- ^ Адам В. Франц, Гельмут Кронемайер, Даниэль Пфайффер, Роман Д. Пильц, Гентер Ройсс, Вальтер Дистельдорф, Армин Отто Геймер, Альбрехт Хилт: Формальдегид. В: Энциклопедия промышленной химии Ульмана . Wiley - VCH, 22 ноября 2016 г., doi : 10.1002 / 14356007.a11_619.pub2 .
- ^ Фридрих Асингер : Химия и технология парафиновых углеводородов. Akademie-Verlag, Берлин, 1956, стр. 477-484.
- ↑ Патент US 2977386 : Поглощение формальдегида в щелочном растворе мочевины. Опубликовано 28 марта 1961 г. , изобретатель: Mearl A. Kise.
- ↑ Э. Брандес, В. Мёллер: Параметры безопасности. Том 1: Легковоспламеняющиеся жидкости и газы. Wirtschaftsverlag NW - Verlag für neue Wissenschaft, Бремерхафен, 2003 г.
- ↑ Тепловой атлас VDI. 9-е издание, Springer-Verlag, Берлин 2002, ISBN 978-3-662-10744-7 , DA 7.
- ↑ С.-Х. Венга, Б. Х. Торри, Б. М. Пауэлла: Кристаллическая структура формальдегида. В кн . : Молекулярная физика . Том 68, 1989, стр. 25-31, DOI: 10.1080 / 00268978900101941 .
- ^ DJ Clouthier, Д.А. Рамзи: Спектроскопия формальдегида и тиоформальдегида. В: Ann. Rev. Phys. Chem. 1983, Vol. 34, pp. 31-58.
- ↑ a b К. С. Тевари, Н. К. Вишной: Учебник органической химии. Викас, 2017, ISBN 978-81259-1605-5 , с. 165.
- ↑ Б. Толленс: О растворе аммиачного серебра как реагенте на альдегид. В: Отчеты Немецкого химического общества . 1882 г., т. 15, № 2, стр. 1635-1639.
- ^ Л. Генри: Sur le nitrile glycolique et la synthèse directe de l'acide glycolique. В: Комп. Ренд. 1890, т. 110, с. 759-760.
- ↑ Александр Бутлеров : О некоторых производных иодметилена. В кн . : Анналы химии и фармации . Том 111, 1859, стр. 242-252, DOI : 10.1002 / jlac.18591110219 .
- ↑ К. Манних, В. Креше: О продукте конденсации формальдегида, аммиака и антипирина. В кн . : Архивы аптек . 1912 г., том 250, стр. 647-667, DOI : 10.1002 / ardp.19122500151 .
- ↑ Э. Мюллер. О. Байер. H. Meerwein, K. Ziegler: Houben-Weyl методы органической химии Vo. X / 1, 4-е издание. Нитро, нитрозо и гидроксиламинные соединения. Тиме, Штутгарт, 1971, ISBN 978-3-13-209104-7 , стр. 254.
- ^ FC Whitmore et al.: Производство бензилхлорида хлорметилированием бензола. Лабораторные и опытно-промышленные исследования. В кн . : Промышленная и инженерная химия . Том 38, 1946, стр. 478-485, DOI : 10.1021 / ie50437a013 .
- ^ A b Фридрих Азингер : Метанол, химическое и энергетическое сырье. Akademie-Verlag, Берлин 1987, ISBN 3-05-500341-1 , стр. 437-438.
- ^ Фридрих Асингер : Метанол, химическое и энергетическое сырье. Akademie-Verlag, Берлин 1987, ISBN 3-05-500341-1 , стр. 348.
- ^ Рональд Бреслоу : О механизме формозной реакции. В кн . : Буквы тетраэдра . Том 1, 1959, стр. 22-26, DOI: 10.1016 / S0040-4039 (01) 99487-0 .
- ↑ Запись о формальдегиде. В: Römpp Online . Георг Тиме Верлаг, по состоянию на 28 февраля 2014 г.
- ↑ Манфред Данки, Питер Нимц: Древесные материалы и клеи: Технология и факторы влияния. Springer-Verlag, Берлин / Гейдельберг / Нью-Йорк 2002, ISBN 3-540-42980-8 , стр. 249-302.
- ↑ Николь Вестенфельдер, Эвелин Шлаури: Экологическая одноразовая посуда - Насколько вредны для здоровья бамбуковые тарелки и картонные тубы? В: srf.ch . 16 мая 2021, доступ к 16 мая 2021 .
- ↑ Манфред Данки, Питер Нимц: Древесные материалы и клеи: Технология и факторы влияния. Springer-Verlag, Берлин / Гейдельберг / Нью-Йорк 2002, ISBN 3-540-42980-8 , стр. 303-320.
- ^ Герман Рат: Учебник химии текстиля, включая текстильно-химическую технологию. Springer-Verlag, Берлин / Гейдельберг 1963, ISBN 978-3-662-00065-6 , стр. 112-121.
- ^ Ханс-Юрген Баргель, Герман Хильбранс, Гюнтер Шульце, Карл-Хайнц Хюбнер, Освальд Крюгер: Материаловедение. Springer-Verlag, Берлин / Гейдельберг 2005, ISBN 978-3-540-26107-0 , стр. 386.
- ^ WC Bauman, J. Eichhorn: Основные свойства синтетической катионообменной смолы. В: Журнал Американского химического общества. Том 69, 1947, стр. 2830-2836, DOI : 10.1021 / ja01203a065 .
- ^ Вильгельм Кейм : пластмассы. Синтез, производственные процессы, оборудование. Глава 4, Wiley-VCH, Weinheim 2006, ISBN 3-527-31582-9 .
- ↑ a b Манфред Бернс , Арно Бер , Аксель Брем, Юрген Гмелинг , Кай-Олаф Хинрихсен, Ханс Хофманн , Регина Палковиц, Ульферт Онкен, Альберт Ренкен: Technische Chemie. Wiley-VCH, Weinheim 2013, ISBN 978-3-527-33072-0 , стр. 590.
- ^ Производство изоцианатов: Обзор мирового и российского рынка изоцианатов.
- ↑ Регламент (ЕС) 2019/831 .
- ↑ Постановление (ЕС) № 1223/2009 .
- ↑ Фрэнк Дестефано, Пол А. Оффит и Эллисон Фишер: Безопасность вакцин . В: Стэнли А. Плоткин и др. (Ред.): Вакцины Плоткина . 7-е издание. Эльзевир, Филадельфия, 2017 г., ISBN 978-0-323-35761-6 , стр. 1594 , DOI : 10.1016 / B978-0-323-35761-6.00082-1 .
- ^ Вакцины для человека. В: Европейская фармакопея . Том 8.0, с. 767.
- ^ Вакцины для ветеринарии. В: Европейская фармакопея . Том 8.0, с. 770.
- ↑ а б К. Вайсер, И. Барт, Б. Келлер-Станиславский: Безопасность вакцин . В: Федеральный вестник здравоохранения - Исследования в области здравоохранения - Охрана здоровья . Лента 52 , нет. 11 , 1 ноября 2009 г., ISSN 1437-1588 , с. 1053-1064 , DOI : 10.1007 / s00103-009-0961-у .
- ↑ Вольфганг Маурер: Скептики вакцины - противники вакцины. Из другой реальности в Интернете . В кн . : Аптека в наше время . Лента 37 , нет. 1 , 2008, с. 64-70 , DOI : 10.1002 / pauz.200700252 .
- ^ Хайнц Френкель-Конрат , Б.А. Брэндон, HS Olcott: реакция формальдегида с белками; участие индольных групп; грамицидин. В кн . : Журнал биологической химии . Volume 168, Number 1, April 1947, pp. 99-118, PMID 20291066 .
- ↑ Хайнц Френкель-Конрат, HS Olcott: Реакция формальдегида с белками. Сшивка между амино и первичными амидными или гуанидильными группами. В: Журнал Американского химического общества . Том 70, номер 8, август 1948 г., стр. 2673-2684, PMID 18876976 .
- ^ Хайнц Френкель-Конрат, HS Olcott: Реакция формальдегида с белками. Сшивка аминогрупп фенольными, имидазольными или индольными группами. В кн . : Журнал биологической химии . Volume 174, Number 3, July 1948, pp. 827-843, PMID 18871242 .
- ↑ Роуз-Мария Гропп : Unfrischer Fisch. В: FAZ.net. 29 июня 2006 г.
- ↑ Государственный институт рабочего проектирования земли Северный Рейн-Вестфалия . Проверено 19 мая 2018 года.
- ↑ Производитель медицинского оборудования MEDIS . Проверено 19 мая 2018 года.
- ^ Р. Коулман, И. Коган: Улучшенная жидкость для бальзамирования с низким содержанием формальдегида для сохранения трупов для обучения анатомии. В: J. Anat.192, 1998, pp. 443-446.
- ↑ Дж. Вайнер: Нитритная отверждающая соль-этанол-полиэтиленгликоль раствор 400 для фиксации и сохранения органов и тел животных для обучения и исследований. В: Таксидермист . 2011 г. Т. 57, с. 34-53, ISSN 0032-6542 .
- ↑ В. Тиль: Сохранение целых трупов в естественных цветах. В: Ann. Анат.174 , 1992, с. 185-195.
- ^ Рюдигер Крамме: Медицинские технологии: процедуры - системы - обработка информации. Springer Medizin Verlag, Heidelberg 2007, ISBN 978-3-540-34102-4 , стр. 27-28.
- ↑ Майкл Бергер, Лутц Ничке: Измерение формальдегида при фумигации курятника. В: Опасные вещества - чистота. Воздух . Том 75, №4, 2015, с. 127-132.
- ^ MZM Салем, М. Бём: Понимание выбросов формальдегида из твердой древесины: Обзор. В: БиоРес . 2013, с. 4775-4790.
- ↑ Проблемы формальдегида в газовых двигателях. SGS-RUK GmbH, по состоянию на 5 февраля 2014 г.
- ↑ Вестник федеральных законов I с. 804, 828.
- ↑ Федеральное министерство окружающей среды, охраны природы и безопасности ядерных реакторов: Отопление дровами. Правильное топливо.
- ↑ VDI 3862 лист 1: 1990-12 измерение газовых выбросов; Измерение алифатических альдегидов (от C 1 до C 3 ) в соответствии с методом MBTH (измерение газообразных выбросов; измерение алифатических альдегидов (от C 1 до C 3 ) методом MBTH). Beuth Verlag, Берлин, стр. 2-3.
- ↑ a b VDI 3862, лист 2: 2000-12 измерение газовых выбросов; Измерение алифатических и ароматических альдегидов и кетонов методом DNPH; Метод газовой промывки (измерение газовых выбросов; измерение алифатических и ароматических альдегидов и кетонов методом DNPH; метод импинжера). Beuth Verlag , Берлин, стр. 4-5.
- ↑ VDI 3862 лист 3: 2000-12 измерение газовых выбросов; Измерение алифатических и ароматических альдегидов и кетонов методом DNPH; Картриджный метод (измерение газовых выбросов; измерение алифатических и ароматических альдегидов и кетонов методом DNPH; картриджный метод). Beuth Verlag, Берлин, стр. 5.
- ^ Франц Йозеф Дрейхаупт (ред.): VDI-Lexikon Umwelttechnik. VDI-Verlag Düsseldorf 1994, ISBN 3-18-400891-6 , стр. 515.
- ^ A b Ханс-Гюнтер Хауб, Зигрид Мюльхаузер, Франц-Йозеф Мюллер, Арно Гардзиелла: Измерение выбросов во время отверждения фенольных смол. В: Пыль - чистота. Воздух . Volume 48, No. 4, 1988, pp. 145-149.
- ↑ VDI 3862, лист 4: 2001-05 измерение газовых выбросов; Измерение Измерение формальдегида методом AHMT (измерение газообразных выбросов; Измерение формальдегида методом AHMT). Beuth Verlag, Берлин, стр. 5.
- ↑ VDI 3862, лист 5: 2008-06 измерение газовых выбросов; Измерение низших альдегидов, особенно акролеина, методом 2-HMP - методом ГХ (измерение газообразных выбросов; Измерение низших альдегидов, особенно акролеина, методом 2-HMP - методом ГХ). Beuth Verlag, Берлин, стр. 4.
- ↑ VDI 3862, лист 6: 2004-02 Измерение газообразных выбросов; Измерение формальдегида ацетилацетоновым методом (измерение газообразных выбросов; Измерение формальдегида ацетилацетоновым методом). Beuth Verlag, Берлин, стр. 5.
- ↑ VDI 3862 лист 8: 2015-06 измерение газовых выбросов; Измерение формальдегида в выхлопных газах двигателей внутреннего сгорания; Метод FTIR (Измерение газовых выбросов; Измерение формальдегида в выхлопных газах двигателей внутреннего сгорания; Метод FTIR). Beuth Verlag, Берлин, стр. 3-4.
- ↑ Европейское химическое агентство (ECHA): Заключение по оценке веществ и отчет об оценке.
- ↑ Скользящий план действий Сообщества ( CoRAP ) Европейского химического агентства (ECHA): Formaldehyde , по состоянию на 1 мая 2020 г.
- ^ Информационная страница формальдегида Института прикладных исследований окружающей среды eV
- ^ Лутц Эдлер, DKFZ - Немецкий центр исследования рака, Гейдельберг: формальдегид - история химического вещества в экспериментах на животных, исследованиях на людях и оценке риска. (PDF, 353 кБ) bfr.bund.de, доступ к 6 июня 2009 года .
- ↑ Сделано из Китая . В: Der Spiegel . Нет. 42 , 2012 ( онлайн ).
- ↑ Всемирная организация здравоохранения ВОЗ : МАИР классифицирует формальдегид как канцерогенный для человека. ( Памятка от 10 сентября 2018 г. в Интернет-архиве ). Пресс-релиз 153, 15 июня 2004 г.
- ↑ BfR : Формальдегид - опаснее, чем считалось ранее? (PDF; 59 кБ), заявление от 29 ноября 2004 г.
- ↑ BfR : Токсикологическая оценка формальдегида. (PDF; 111 кБ), Мнение 023/2006, 30 марта 2006 г.
- ↑ BfR : Канцерогенные эффекты вдыхаемого формальдегида были достаточно доказаны. Пресс-релиз 14/2006, 29 мая 2006 г.
- ^ Национальный институт наук об окружающей среде. 13-й отчет о канцерогенных веществах (RoC): формальдегид. Проверено 18 ноября 2014 года.
- ↑ Кэтрин А. Цуг и др.: Результаты патч-теста Североамериканской группы контактного дерматита 2005-2006 гг. В: дерматит. Том 20, 2009 г., стр. 149-160, DOI: 10.2310 / 6620.2009.08097 .
- ↑ Постановление о потребительских товарах .
- ↑ ChemVerbotsV, Приложение 1 Запреты на размещение на рынке.
- ↑ Регламент (ЕС) 2018/1513 Комиссии от 10 октября 2018 г. о внесении поправок в Приложение XVII Регламента (ЕС) № 1907/2006 Европейского парламента и Совета о регистрации, оценке, разрешении и ограничении химических веществ (REACH ) в отношении определенных веществ, классифицируемых как канцерогенные, мутагенные для зародышевых клеток или токсичные для репродукции (CMR) категории 1A или 1B .
- ↑ Сообщение Федерального агентства по окружающей среде. Ориентировочное значение формальдегида в воздухе помещений. Август 2016 г. (PDF; 127 kB).
- ↑ Формальдегид в воздухе помещения. Исходная информация. В: ee-concept.de. Проверено 11 апреля 2014 г.
- ↑ Ориентировочные значения AGÖF для летучих органических соединений в воздухе помещений, 2013 г. Arbeitsgemeinschaft Ökologischer Forschungsinstitute e. V. (AGÖF), по состоянию на 11 апреля 2014 г.
- ↑ Изменения и новые дополнения к TRGS 900 «Пределы воздействия на рабочем месте» .
- ↑ Йоханнес Орфал , Келли Ченс: сечения поглощения ультрафиолетового и видимого света для HITRAN. В: Журнал количественной спектроскопии и переноса излучения . Том 82, №1, 2003 г., стр. 491-504.
- ^ I. Де Смедт и др.: Двенадцать лет глобальных наблюдений за формальдегидом в тропосфере с использованием датчиков GOME и SCIAMACHY. В кн . : Химия и физика атмосферы . Том 8, 2008, стр. 4947-4963.
- ↑ E. Peters et al.: Формальдегид и диоксид азота над удаленной западной частью Тихого океана: проверка SCIAMACHY и GOME-2 с использованием судовых наблюдений MAX-DOAS. В кн . : Химия и физика атмосферы. Том 12, №22, 2012 г., стр. 11179-11197.
- ↑ VDI 3484, лист 2: 2001-11: Измерение эмиссии газообразных веществ; Измерение загрязнения воздуха в помещениях; Определение концентрации формальдегида ацетилацетоновым методом (измерение газообразного окружающего воздуха; измерение загрязнения воздуха в помещении; измерение концентрации формальдегида акатилацетоновым методом). Beuth Verlag, Берлин, стр. 4.

















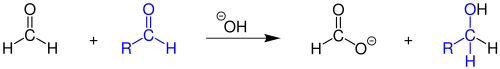
![{\ Displaystyle \ mathrm {CH_ {2} O + 2 \ [Ag (NH_ {3}) _ {2}] ^ {+} + 2 \ OH ^ {-} \ longrightarrow}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f144ec092e566bf5d594c572f95177feb09d9e7)